鲨鱼软骨粉抑制白细胞介素-1β诱导的人软骨细胞凋亡的实验研究
2019-06-05马溢聪徐文飞刘凤李旭辉
马溢聪 徐文飞 刘凤 李旭辉
骨关节炎(osteoarthritis,OA)是临床上一种常见 的慢性骨关节退行性疾病,并且随着年龄的增长发病概率逐渐升高。OA的基本特征为多种原因引起的软骨细胞降解。在疾病的早期发生过程中,白细胞介素(IL)-1β、肿瘤坏死因子-α等促炎性细胞因子能够通过调控Nuclear factor kappa-B(NF-κB)、Mitogen-activated protein kinase(MAPK)等信号通路促进炎症反应的进行[1]。而在OA的发展过程中,软骨细胞的过度凋亡成为疾病加重的另一个重要原因[2]。Bcl-xl(B-cell lymphoma-extralarge)和Survivin是两个拮抗细胞凋亡的信号分子,当拮抗细胞凋亡的蛋白表达受到抑制后,会影响细胞正常的生命活动,引起细胞过度凋亡[3,4]。近年来,硫酸软骨素(chondroitin sulfate,CS)作为一种新型的关节软骨保护剂在临床上发挥了较好的治疗效果,能明显减轻OA病人骨关节疼痛并改善骨关节功能[5]。鲨鱼软骨粉含有丰富的硫酸软骨素及其他多糖类物质,临床上有鲨鱼软骨素制剂有效改善OA病人关节疼痛、减少病情反复发作的实例[6],但作用机制尚不明确。本研究通过体外培养人正常软骨细胞C28/I2,观察鲨鱼软骨粉对细胞凋亡及相关蛋白表达的影响,探讨鲨鱼软骨粉保护软骨细胞的可能机制。
材料与方法
一、实验细胞、药品、试剂及实验仪器
人正常软骨细胞C28/I2购于上海钰博生物科技有限公司(中国)。鲨鱼软骨粉(硫酸软骨素含量为33%,嘉兴纽迪康生物科技有限公司,中国),DMEM高糖培养基[维森特生物技术(中国)有限公司],胎牛血清[维森特生物技术(中国)有限公司],青链霉素混合液(Life Technologies公司,美国),IL-1β(Cell Signaling Technology公司,美国),CellTiter 96TM Aqueous One Solution Reagent细胞增殖试剂盒(Promega,美国),0.25%胰蛋白酶[维森特生物技术(中国)有限公司],Alexa Fluor®488 annexin V/Dead Cell Apoptosis Kit with Alexa®(Invitrogen公司,美国),FxCycleTMPI/RNase Staining Solution(Life Technologies公司,美国),Quick StartTMBradford 1×Dye Reagent(Bio-Rad公司,美国),Bcl-xl Antibody(Cell Signaling Technology公司,美国),Survivin Antibody(Cell Signaling Technology公司,美国),p65 Antibody(Santa Cruz,美国),p-p65 Antibody(Cell Signaling Technology公司,美国),STAT3 Antibody(Santa Cruz公司,美国),p-STAT3 Antibody(Cell Signaling Technology公司,美国),β-actin Antibody(Santa Cruz公司,美国),ERK(Cell Signaling Technology公司,美国),p-ERK(Cell Signaling Technology公司,美国)。倒置生物显微镜(上海蔡康光学仪器有限公司,中国),生物安全柜NUAIR(天美科技公司,中国),CO2细胞培养箱(SANYO三洋公司,日本),全波长酶标仪Sepctra Max M5(Molecular Devices公司,美国),高速冷冻离心机(浙江省科学仪器进出口有限公司,中国),BD AccuriTMC6 Plus Flow Cytometer(BD Biosciences公司,美国),ImageQuant LAS 4000mini成像仪(通用电气GE,美国)。
二、实验方法
(一)药物配制
取鲨鱼软骨粉(含33%的硫酸软骨素)3.7878 g,加入50 ml去离子水搅拌至溶解,将药物溶液转移至50 ml离心管中,室温下,10 000 r/min,离心10 min。吸取上清液,0.22 μm过滤器除菌过滤后即得到硫酸软骨素浓度为25 mg/ml的鲨鱼软骨粉母液,以下统称鲨鱼软骨粉溶液,不同浓度的鲨鱼软骨粉溶液均由鲨鱼软骨粉母液加培养基配置。在10 μg的IL-1β粉末中加入200 μl的PBS,配成浓度为50 μg/ml的IL-1β母液,使用时用培养基稀释为所需浓度。
(二)软骨细胞培养
将细胞放入细胞培养箱中静置2 h,在显微镜下观察细胞状态及数量。待细胞融合率达到80%~90%时即可传代。弃原培养基,加入3 ml磷酸盐缓冲液(phosphate buffer saline,PBS)清洗2次。加入1 ml 0.25%胰酶,放入培养箱内消化约1 min。加入3 ml培养基,轻轻吹打终止消化。再将细胞悬液转移至15 ml离心管。室温下,1 000 r/min,离心5 min,弃上清,吸取完全后,培养基吹匀细胞,按1∶2将细胞接种到新的培养皿中,摇匀。于37℃、5%CO2的细胞培养箱内贴壁培养。
(三)细胞增殖检测
在显微镜下观察细胞的生长状态,待细胞融合率达90%时常规消化细胞,将细胞接种于24孔板中,接种密度为每孔2×104个细胞,贴壁培养24 h。将细胞分为对照组和鲨鱼软骨粉组。对照组不作处理,更换新鲜培养基;鲨鱼软骨粉组分别加入0.1、0.2、1、5、10 mg/ml鲨鱼软骨粉溶液,于细胞培养箱内培养48 h。采用MTS法,酶标仪检测490 nm下的吸光度值(A490值)。
(四)细胞凋亡检测
将生长状态良好的细胞接种于6孔板中,贴壁培养24 h。将细胞分为对照组、IL-1β组和鲨鱼软骨粉组。对照组不作处理,IL-1β组和鲨鱼软骨粉组加10 ng/ml IL-1β处理24 h后,鲨鱼软骨粉组加入鲨鱼软骨粉溶液(5 mg/ml),培养48 h。
室温下消化收集细胞于离心管中,1 000 r/min,离心5 min,吸弃上清液。预冷的PBS清洗细胞两次。按照凋亡试剂盒的说明书对细胞进行染色:将5×annexin-binding buffer稀释为1×。将5 μl 1 mg/ml的PI与45 μl 1× annexin-binding buffer混匀,使PI的终浓度为 100 μg/ml。取 100 μl 1×annexin-binding buffer吹散细胞后加入5 μl Alexa Fluor®488 annexin V 和 1 μl 100 μg/ml的 PI。室温下孵育 15 min。加入400 μl 1×annexin-binding buffer,轻吹混匀。放置在冰上,流式细胞仪检测。结果用BD Accuri C6 Plus软件处理。
(五)细胞周期检测
收取各组细胞于1.5 ml离心管中,70%的乙醇吹散细胞,固定过夜。PBS清洗细胞两次,室温下,1 000 r/min,离心5 min,吸弃上清液。每个离心管中加入 500 μl FxCycleTM PI/RNase Staining Solution,吹匀细胞。室温下,避光孵育15 min。尽快上流式细胞仪检测。结果用Modifit软件处理。
(六)Western blot
弃各孔培养基,用预冷的PBS清洗2次,每孔加入60 μl裂解液。用细胞刮刀刮下细胞并收集到1.5 ml离心管中,旋转裂解40 min。4℃,13 000 r/min,离心30 min。小心吸取上清液到新的1.5 ml离心管中。用Quick StartTMBradford试剂进行蛋白质的定量检测。蛋白质溶液与上样缓冲液混合后,充分煮沸变性10 min,进行sodium dodecyl sulfate-polyacrylamide gel electrophoresis(SDS-PAGE)电泳,然后将蛋白转印至 Polyvinylidene fluoride(PVDF)膜上,转印完毕后室温下用5%脱脂牛奶进行封闭1 h,Phosphate buffered saline tween-20(PBST)清洗3次,每次5 min。于4℃冰箱内孵育一抗过夜。PBST清洗3次,每次10 min。室温下孵育二抗1 h,用enhanced chemiluminescence(ECL)显色液显色后,于 ImageQuant LAS 4000mini成像系统曝光。
三、统计学处理
所有实验重复三次,数据以均值±标准差()表示,采用SPSS 20.0软件(IBM公司,美国)进行统计学处理,采用单因素方差分析和独立样本t检验,P<0.05表示差异具有统计学意义,P<0.01表示有显著性差异,P<0.001表示具有极显著性差异。
结 果
一、鲨鱼软骨粉溶液对软骨细胞增殖的影响
分别用浓度为0.1、0.2、1、5、10 mg/ml的药物溶液处理软骨细胞48 h后,结果如图1所示,与对照组相比,在药物浓度为0.1~5 mg/ml时,软骨细胞随着药物浓度的增加而增多,浓度为0.2、1、5 mg/ml时与对照组比较,差异具有统计学意义(P<0.05,P<0.001,P<0.001),在5 mg/ml时促进作用最为明显,而当药物浓度达到10 mg/ml时,软骨细胞的增殖反而受到抑制。因此选用5 mg/ml进行后续实验。
二、鲨鱼软骨粉溶液对软骨细胞凋亡的影响
IL-1β组和鲨鱼软骨粉组细胞凋亡情况如图2所示,与对照组相比,IL-1β组的软骨细胞凋亡明显增加(P<0.001),与IL-1β组相比,鲨鱼软骨粉组的软骨细胞凋亡明显减少(P<0.001)。
三、鲨鱼软骨粉溶液对软骨细胞周期的影响
如图3所示,与对照组相比,IL-1β组细胞经IL-1β处理后G1期细胞比例增加,S期细胞比例降低,且差异具有统计学意义(P<0.001);与IL-1β组比较,鲨鱼软骨粉组的细胞经5 mg/ml的鲨鱼软骨粉溶液处理后,G1细胞明显减少(P<0.001),S期和G2期细胞比例明显增加(P<0.001,P<0.01)。
四、鲨鱼软骨粉溶液对炎症因子磷酸化的影响
STAT3和NF-κB蛋白家族重要成员p65是两种关键的促炎信号分子,经磷酸化激活后发挥作用。如图4所示,与对照组相比,IL-1β组软骨细胞内STAT3和p65的磷酸化增加(P<0.01,P<0.001),其中p65磷酸化增加的尤其明显;与IL-1β组相比,鲨鱼软骨粉组软骨细胞内STAT3和p65的磷酸化明显减少(P<0.05,P<0.001)。各组STAT3和p65蛋白的总表达量并没有显著的变化(P均>0.05)。
五、鲨鱼软骨粉溶液对ERK蛋白磷酸化的影响
如图5所示,与对照组相比,IL-1β组软骨细胞内ERK的磷酸化明显增加,差异有统计学意义(P<0.001)。而与IL-1β组相比,鲨鱼软骨粉组软骨细胞内ERK的磷酸化明显减少,差异有统计学意义(P<0.05)。各组ERK蛋白的总表达量并没有显著的变化(P均>0.05)。
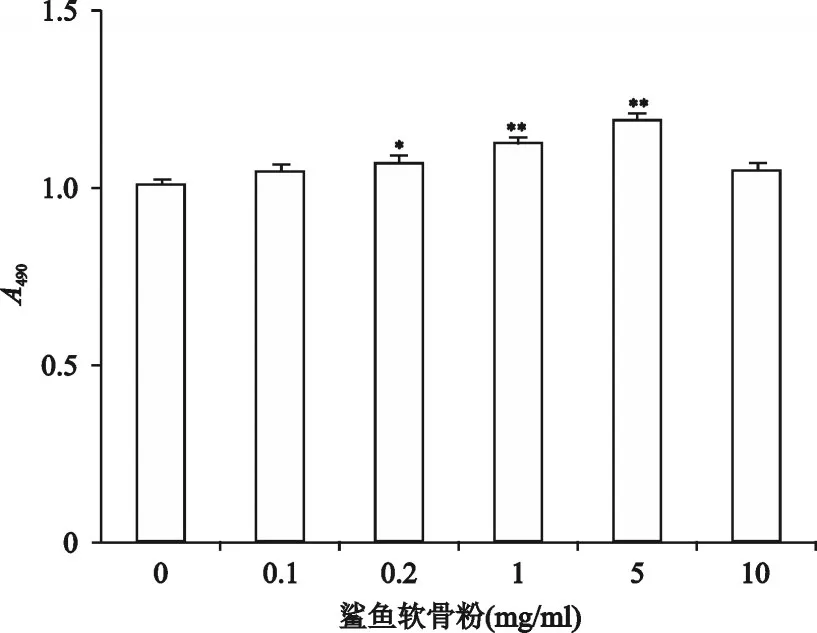
图1 鲨鱼软骨粉溶液对软骨细胞增殖的影响
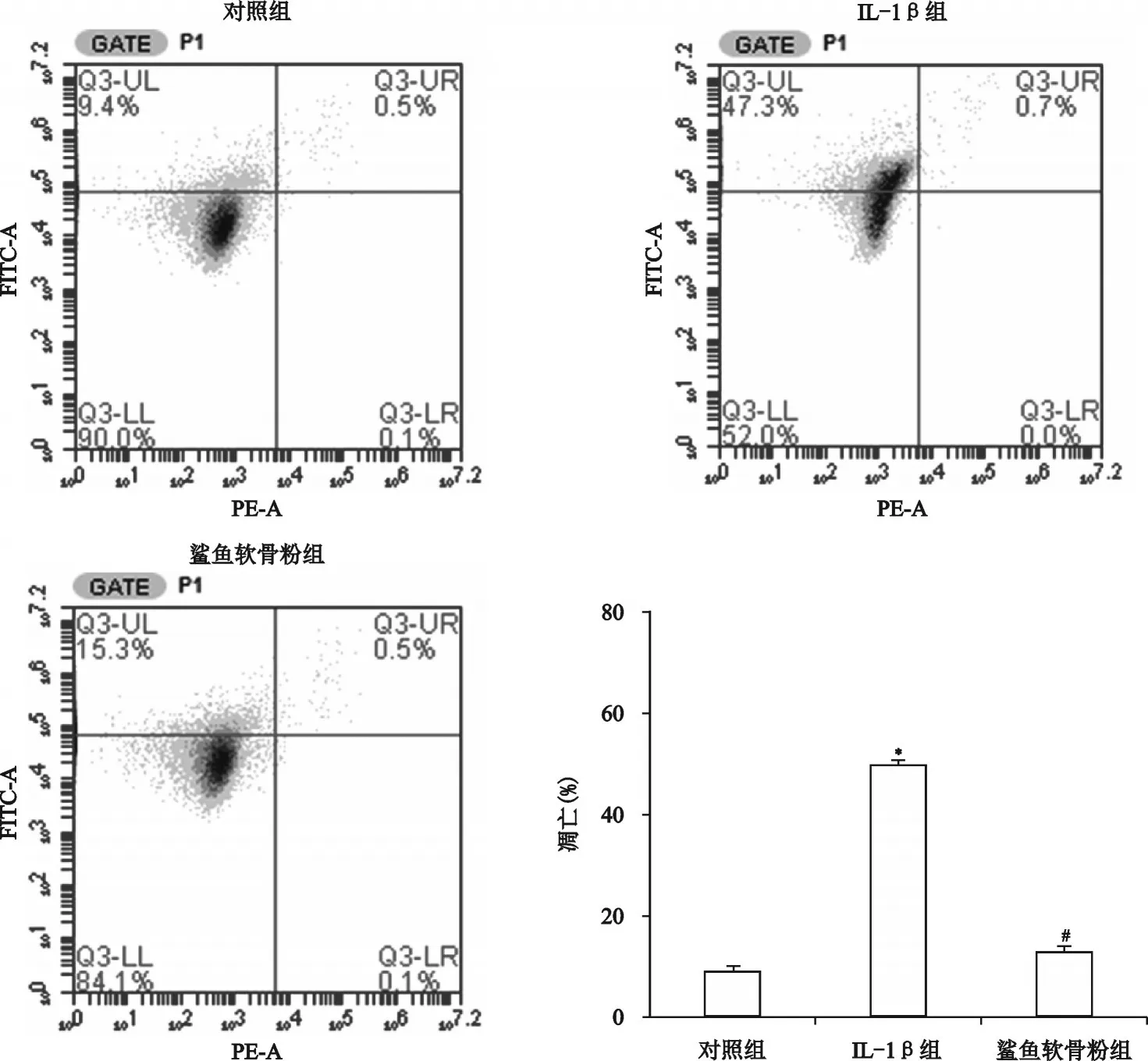
图2 鲨鱼软骨粉溶液对软骨细胞凋亡的影响
六、鲨鱼软骨粉溶液对抗凋亡蛋白表达的影响
如图6所示,与对照组相比,IL-1β组软骨细胞内抗凋亡蛋白Bcl-xl和Survivin的表达量明显减少,差异有统计学意义(P<0.05,P<0.01);与IL-1β组相比,鲨鱼软骨粉组软骨细胞内Bcl-xl和Survivin的表达量明显增加,差异有统计学意义(P均<0.01)。
讨 论
OA是一种骨关节退行性病变,多见于中老年人及肥胖病人。常用的药物多为非甾体类抗炎药和镇痛药,都只能起到暂时缓解关节内炎症和疼痛的效果,而对于减缓病情发展、减少或修复关节损坏几乎没有效果[7]。近年来,对于骨关节炎的研究及治疗越来越多地集中在修复关节内结构,减缓软骨细胞死亡,从而减缓病情发展[8-10]。鲨鱼软骨粉是从鲨鱼软骨中分离提纯得到的生物制品,含有丰富的生物活性成分,其中最早确定药用价值的成分为硫酸软骨素。本实验中我们用不同浓度的鲨鱼软骨粉溶液处理人正常软骨细胞C28/I2后,发现在一定药物浓度范围内,软骨细胞的数量随着药物浓度升高而增多,且在5 mg/ml时细胞达到最多,说明鲨鱼软骨粉溶液能够促进软骨细胞的增殖,在本实验条件下,浓度为5 mg/ml时促进作用最强。
在骨关节炎的发生、发展过程中,促炎因子IL-1β对于病情的加重起着至关重要的作用。IL-1β能够刺激基质金属蛋白酶和蛋白聚糖酶的表达,而这两者均能引起软骨细胞的降解[11]。IL-1β能刺激软骨细胞中环氧合酶(COX)-2和前列腺素等炎症因子表达从而进一步加重炎症反应[12]。IL-1β还能通过调节细胞内多条信号通路使得软骨细胞发生坏死或凋亡[13]。本实验利用IL-1β刺激人正常软骨细胞,探究鲨鱼软骨粉溶液是否对IL-1β引起的细胞凋亡起到保护作用,实验结果显示IL-1β处理软骨细胞后,细胞凋亡明显增加,而鲨鱼软骨粉溶液处理后细胞凋亡明显减少。此结果说明一定浓度的鲨鱼软骨粉溶液能够减少IL-1β引起的细胞凋亡,对软骨细胞起到一定的保护作用。
细胞周期分为4个阶段:G1期是DNA合成的准备期,S期是DNA合成期,G2期是有丝分裂前的准备期,M期是有丝分裂期。在此过程中有两个检查点,一个是G1/S检查点,其作用是确保细胞顺利由G1期向S期推进,DNA准确合成。另一个是G2/M检查点,其作用是保证细胞正常进入有丝分裂。G1期决定了细胞能否进入以下几个阶段,因此,可直接影响细胞能否继续增殖[14,15]。本研究结果显示IL-1β处理细胞后G1期细胞比例增加,S期细胞比例减少,说明IL-1β能够引起细胞G1/S期阻滞从而抑制细胞分裂。鲨鱼软骨粉溶液处理细胞后,G1期细胞比例明显减少,S期和G2期的细胞比例明显增加,说明鲨鱼软骨粉溶液能够缓解IL-1β对细胞周期的抑制,并且促进软骨细胞有丝分裂的进行。
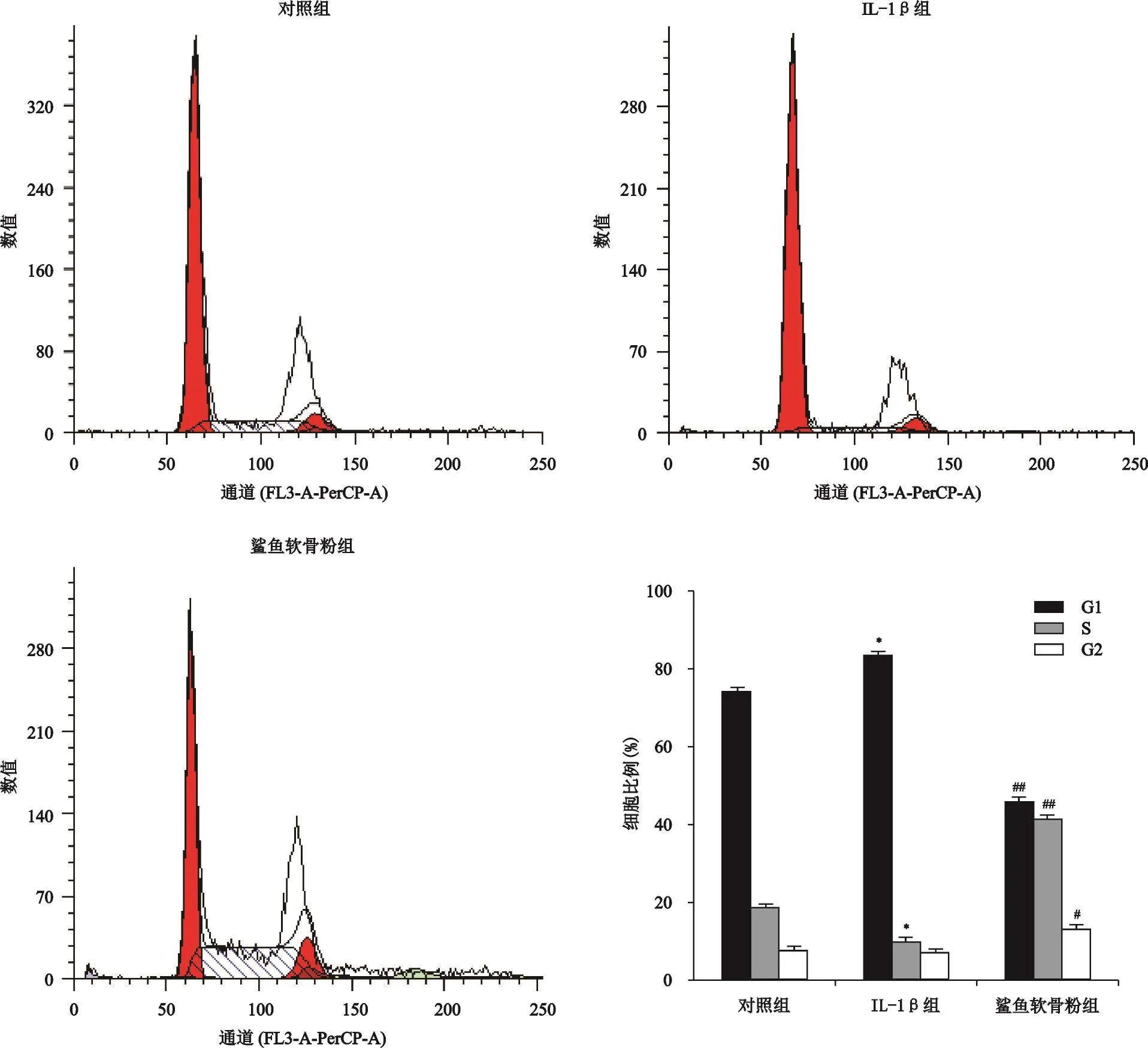
图3 鲨鱼软骨素溶液对软骨细胞周期的影响
NF-κB和STAT3是细胞内两条重要的信号通路的关键调控分子,其调控下游多种炎症因子的表达,是炎症反应发生、发展必不可少的调控通路。正常情况下,NF-κB以无活性的形式存在于细胞中,而经IL-1β刺激后,NF-κB被磷酸化激活,进入到细胞核从而调节炎症分子的表达[16]。有实验证明敲除NF-κB家族成员p65能够减少IL-1β刺激引起的软骨细胞内COX-2、一氧化氮合酶和基质金属蛋白酶-9的表达[17]。STAT3的激活过程与NF-κB类似,而且同样在骨关节炎软骨细胞内对于炎症因子的调控发挥重要的作用。实验证明IL-1β能够刺激STAT3磷酸化而使其激活,促进炎症因子及凋亡因子的表达,抑制STAT3激活后能明显减少软骨细胞凋亡,减轻软骨组织损坏[18,19]。因此本实验观察鲨鱼软骨粉溶液是否能够减少p65及STAT3的激活,结果显示IL-1β刺激软骨细胞后p65及STAT3的磷酸化明显增加,而鲨鱼软骨粉溶液处理细胞后p65及STAT3的磷酸化明显减少,说明鲨鱼软骨粉溶液能够通过减少p65及STAT3磷酸化抑制其激活。
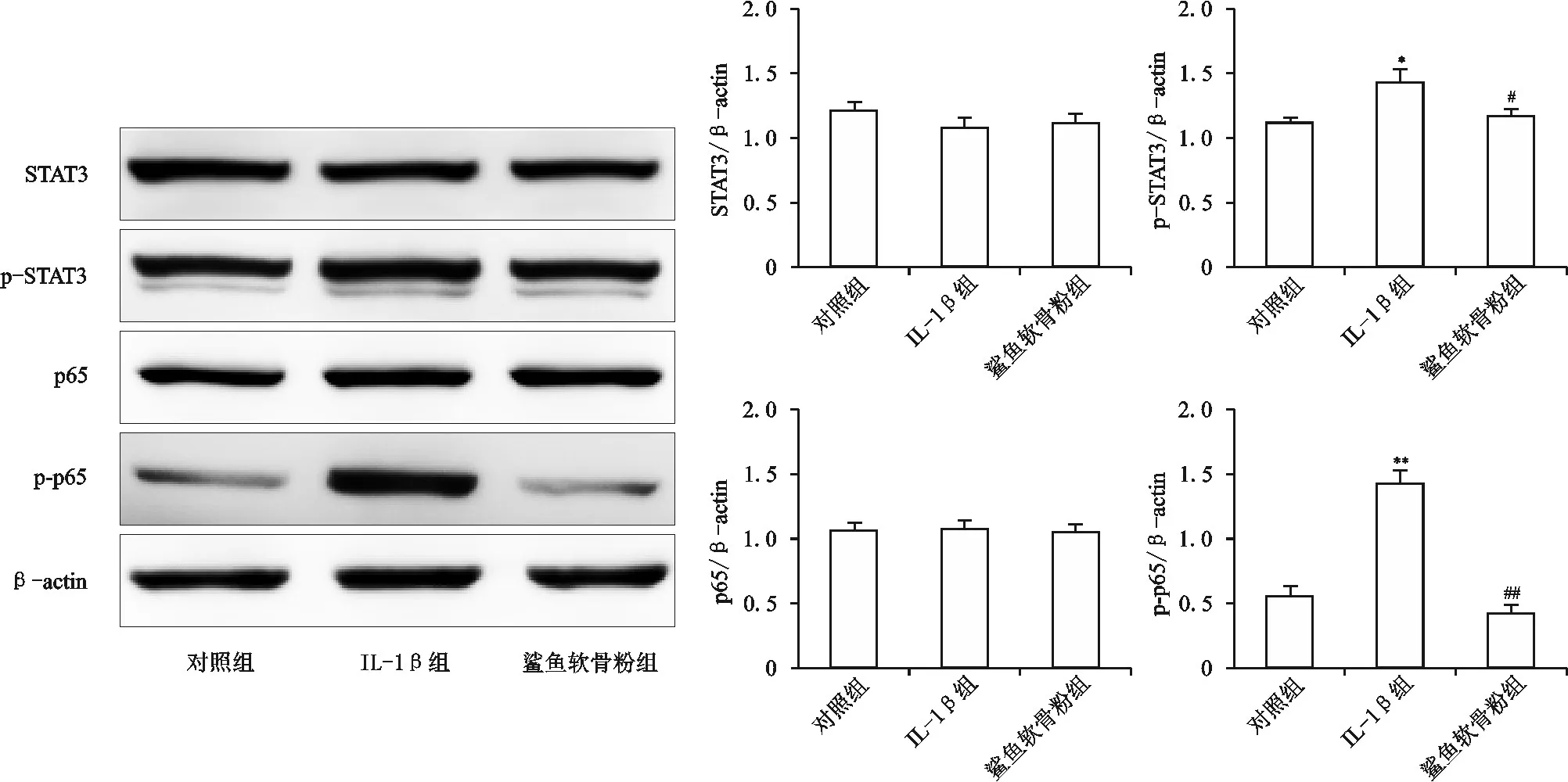
图4 鲨鱼软骨粉溶液对STAT3和p65磷酸化的影响
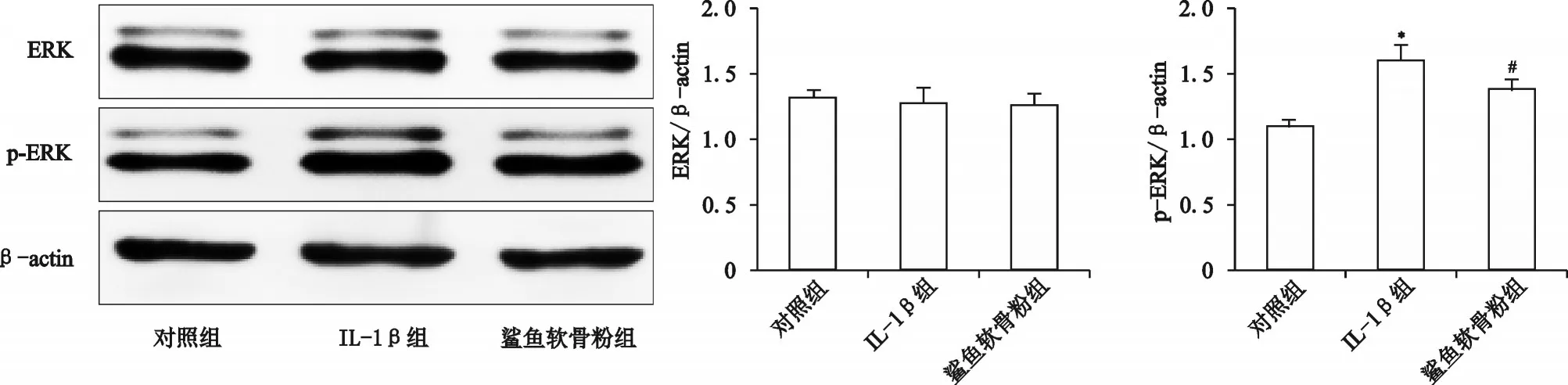
图5 鲨鱼软骨粉溶液对ERK磷酸化的影响
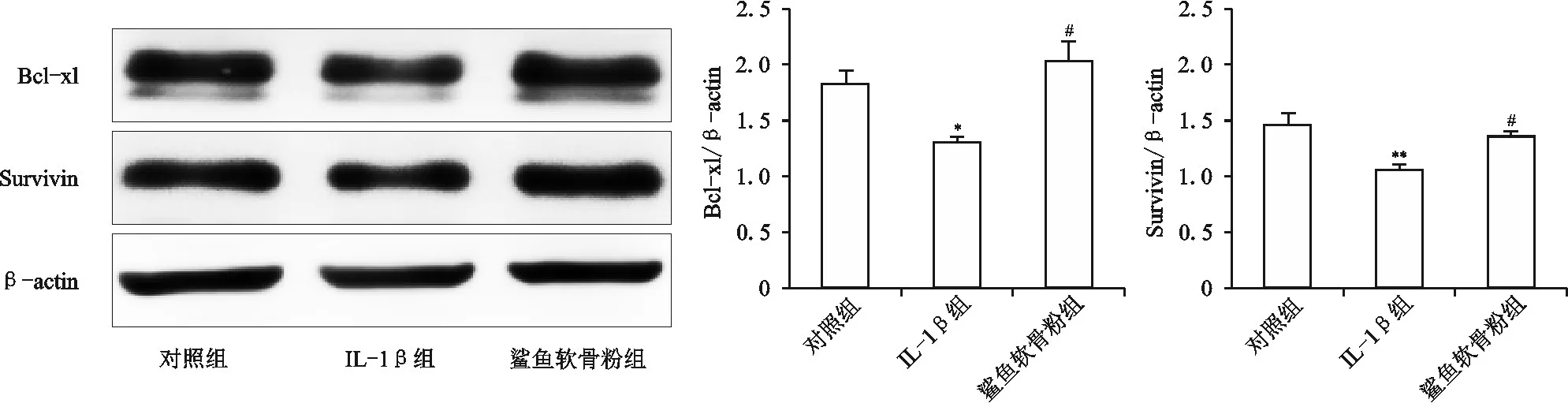
图6 鲨鱼软骨粉溶液对Bcl-xl和Survivin表达的影响
细胞外调节激酶(Extracellular regulated protein kinases,ERK)是MAPK家族一类代表性的激酶,与细胞的增殖分化、细胞骨架的构建、细胞凋亡等基本生命活动密切相关。IL-1β能够刺激软骨细胞内ERK的磷酸化,而且在骨关节炎的软骨细胞内MAPK的磷酸化水平要高于正常的软骨细胞[20]。MAPK家族蛋白激活后能够促进众多炎症调节因子的表达,包括一氧化氮、前列腺素以及基质金属蛋白酶等,而这些炎症调节分子会进一步加重炎症、破坏软骨结构[21]。Bcl-xl和Survivin是两种抗凋亡蛋白,当Bcl-xl上调后类风湿性关节炎的滑膜细胞凋亡减少,而且有实验证明Bcl-xl的上调与抑制STAT3激活有关[22]。Survivin的表达受到抑制后可引起软骨细胞周期阻滞从而诱导细胞凋亡[23]。本实验结果显示鲨鱼软骨粉溶液能减少IL-1β引起的ERK磷酸化,减弱IL-1β对Bcl-xl和Survivin的抑制作用。说明鲨鱼软骨粉溶液能够减少ERK的激活,增加Bclxl和Survivin的表达从而减少IL-1β引起的软骨细胞凋亡。
综上,本实验证明了鲨鱼软骨粉溶液能够促进软骨细胞增殖、减少IL-1β引起的软骨细胞凋亡及细胞周期阻滞,其可能的机制包括减少炎症因子p65、STAT3及细胞外调节激酶ERK的激活、增加抗凋亡蛋白Bcl-xl、Survivin的表达。骨关节组织结构特殊,损坏之后很难恢复,而且骨关节炎的发病机制复杂,目前尚没有确定的病因。在国外,硫酸软骨素已经被作为辅助用药治疗骨关节炎[24]。本实验的结果为鲨鱼软骨粉溶液成为骨关节炎的辅助用药提供了一定的理论依据,但细胞内信号通路的调控机制错综复杂,鲨鱼软骨粉溶液对于软骨细胞的作用及其机制还有待于进一步研究。