植物生长调节剂对纳塔栎插穗生根及其生理生化特性的影响
2019-06-05吴岐奎张子晗喻方圆姚忠贤
陈 晨 吴岐奎 张子晗 喻方圆 吴 文 姚忠贤
( 1. 南京林业大学林学院, 江苏 南京 210037;2. 南方现代林业协同创新中心,江苏 南京 210037;3. 上海市林业总站,上海 200040;4. 上海君冠花木种植专业合作社,上海 201500)
纳塔栎(Quercus nuttallii),壳斗科(Fagaceae)栎属(Quercus)落叶乔木。纳塔栎原产美国,在佛罗里达西部至德克萨斯东南部沿海平原低洼地分布较广。我国自19世纪末20世纪初大量引种栎树[1],其中纳塔栎在浙江、上海、江苏等地引种后生长良好,适应性强,引种前景广阔[2]。前人对纳塔栎种质资源的引进、收集,以及抗逆性等已经有了较多研究[3]。15年生纳塔栎在每年10月中旬至2月中旬淹水的情况下,仍有89%的存活率[4];Stanturf等在对美国密西西比河地区树种划分耐涝级别时将纳塔栎划分为中等耐水级[5]。姜琳等通过测定净光合速率、蒸腾速率和气孔导度等光合参数研究3种不同叶色栎树,即纳塔栎(Q. nuttallii)、鲜红栎(Q. coccinea)和加州白栎(Q. lyrata)光合特性,结果发现3种栎树净光合速率、蒸腾速率和气孔导度日变化夏季呈双峰曲线,秋季呈单峰曲线[6]。栎类树种体内含有生根抑制物质,如单宁、酚类物质等,因此属于扦插难生根树种[7]。目前纳塔栎主要依靠种子繁殖,而纳塔栎种子价格高、运输费用贵,种子需低温沙藏3个月以打破休眠,大规模育苗的成本比较高。扦插繁殖具有保持母本的优良性状、繁殖周期短等优点,而关于纳塔栎无性繁殖的报道很少见。为解决纳塔栎繁殖速度慢、规模化生产困难等问题,本试验通过研究不同植物生长调节剂处理对纳塔栎插穗生根指标的影响,以及生根过程中生理指标的变化,探讨其扦插生根机理,为纳塔栎无性系快繁提供参考。
1 材料与方法
1.1 试验地概况
试验地位于上海市金山区枫泾镇上海君冠花木种植专业合作社苗圃(东经121°9′,北纬 30°54′)。属北亚热带季风气候,全年平均气温16.6 ℃,年平均降雨量1 156.7 mm左右,光照充足。
1.2 插穗的采集与制备
2017年6月24日,选取生长健壮、长势一致且无病虫害的2年生纳塔栎母树采集嫩枝制备插穗,每穗长10~12 cm,保留1个叶1个芽,在形态学上端1 cm处平剪,形态学下端0.5 cm处斜剪。
1.3 试验设计
插穗生根试验:采用随机区组试验设计,设200 mg/kg ABT、200 mg/kg IAA、200 mg/kg NAA和清水对照4个处理。每处理3个重复,每个重复30根插穗。将剪好的插穗基部分别在不同处理的溶液中浸泡2 h,扦插于珍珠岩中。
插穗生根机理试验:设200 mg/kg ABT和清水对照2个处理。每处理3个重复,每个重复30根插穗。将剪好的插穗基部分别在不同处理的溶液中浸泡2 h,扦插于珍珠岩中。
1.4 插后管理
扦插后压实周围基质,株行距控制在5 cm×5 cm左右,全部扦插完一次性浇透水。根据天气情况开启自动喷雾,气温较高时增加喷雾频率,阴雨凉爽时则适当降低频率。
1.5 测定指标
插穗生根试验中,扦插60 d后调查纳塔栎插穗生根情况。调查指标包括生根率(%)、平均生根数(条/株)、平均根长(cm)和生根指数。计算方法如下:

插穗生根机理试验中,从插后0 d即开始取样,每隔7 d取一次样,每次取样每处理每重复4根,共取样7次。分别剥取不同处理插穗基部韧皮部并混合均匀,于-80 ℃冰箱中保存待测。可溶性糖含量、可溶性蛋白含量及超氧化物歧化酶(SOD)活性采用李合生[8]的方法测定;过氧化物酶(POD)活性、多酚氧化酶(PPO)活性及丙二醛(MDA)含量采用高俊凤[9]的方法测定;内源激素含量采用酶联免疫吸附法测定[10]。
1.6 数据统计与分析
使用Excel 2010整理数据及绘图;利用SPSS 18.0统计分析软件对不同处理间插穗生根指标和生理生化指标的数据进行单因素方差分析和多重比较。每个指标数据均为3个重复的平均值,结果用平均值±标准误表示。
2 结果与分析
2.1 不同处理对纳塔栎插穗生根的影响
由表1知,不同植物生长调节剂处理均提高了插穗的生根率、平均根数、根长和生根指数,与对照达到显著或极显著差异水平。200 mg/kg ABT处理的插穗各项生根指标均为最高,与200 mg/kg IAA与200 mg/kg NAA存在显著差异。而200 mg/kg IAA与200 mg/kg NAA处理差异不显著。因此,200 mg/kg ABT处理效果最佳。

表 1 不同植物生长调节剂对纳塔栎插穗生根率和生根质量的影响Table 1 Effects of different plant growth regulators on rooting rate and quality of Q. nuttallii cuttings
2.2 插穗生根过程中营养物质含量的变化
由图1可知,纳塔栎插穗基部可溶性糖含量大致呈现先下降后上升再下降的趋势。扦插初期插穗要维持正常生命活动,因此消耗了自身储存的可溶性糖导致含量下降,而在愈伤组织形成期大幅上升,并在21 d时达到最大值,这为后期插穗生根储存了碳源;对照组可溶性糖含量在28 d才上升到最大值。21 d后处理组可溶性糖含量开始下降,此时不定根形成,呼吸作用加强,可溶性糖大量消耗以保证能量供应。扦插后期,处理组可溶性糖含量又出现小幅上升,原因是叶片光合作用产生的光合产物向插穗基部运输减缓了可溶性糖的消耗。28 d后对照组可溶性糖含量下降,可见经植物生长调节剂处理可以使纳塔栎生根提前7 d左右。
由图2可知,可溶性蛋白含量在初期有个短暂的积累过程,此时积累一定量的可溶性蛋白对愈伤组织的形成有利。不定根生成后可溶性蛋白逐渐被消耗,此时可溶性蛋白用于不定根的生长以及新细胞的形成。对照组可溶性蛋白变化规律与处理组大致相同,不过在21 d才开始下降。
2.3 插穗生根过程中相关酶活性及MDA含量的变化
由图3可知,0~7 d POD活性小幅下降后大幅上升,高活性的POD可以增强离体插穗抗逆性。对照组POD活性变化幅度小于处理组,可见植物生长调节剂处理可以显著加强受损插穗的抗逆性。21~28 d处理组POD活性再次呈现下降趋势,35 d时处理组POD活性出现第2个峰值,此时高活性POD降低了IAA对生根的抑制作用。此后随着不定根大量形成,插穗生长趋于稳定,POD活性下降。对照组变化规律相似,幅度较小,说明植物生长调节剂处理能显著改变插穗基部POD活性,对于根系形成有促进作用。

图 1 插穗生根过程中可溶性糖含量变化Fig. 1 The dynamic changes of soluble sugar content in cuttings during rooting process

图 2 插穗生根过程中可溶性蛋白含量变化Fig. 2 The dynamic changes of soluble protein content in cuttings during rooting process
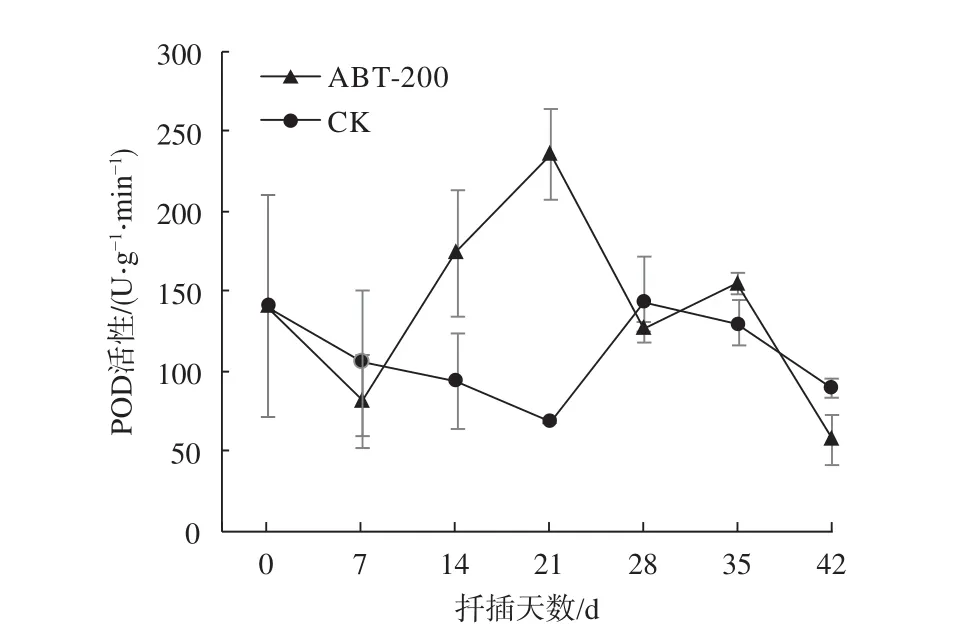
图 3 插穗生根过程中POD活性变化Fig. 3 The dynamic changes of POD activity incuttings during rooting process
由图4可知,处理组插穗基部PPO活性在14 d达到第1个峰值,此时高活性的PPO有利于愈伤组织的形成。28 d达到第2个峰值,此时不定根大量出现,随后活性降低。总的来看,经植物生长调节剂处理的插穗基部PPO活性始终保持在较高水平且高于对照组,这对愈伤组织和不定根的形成有促进作用。
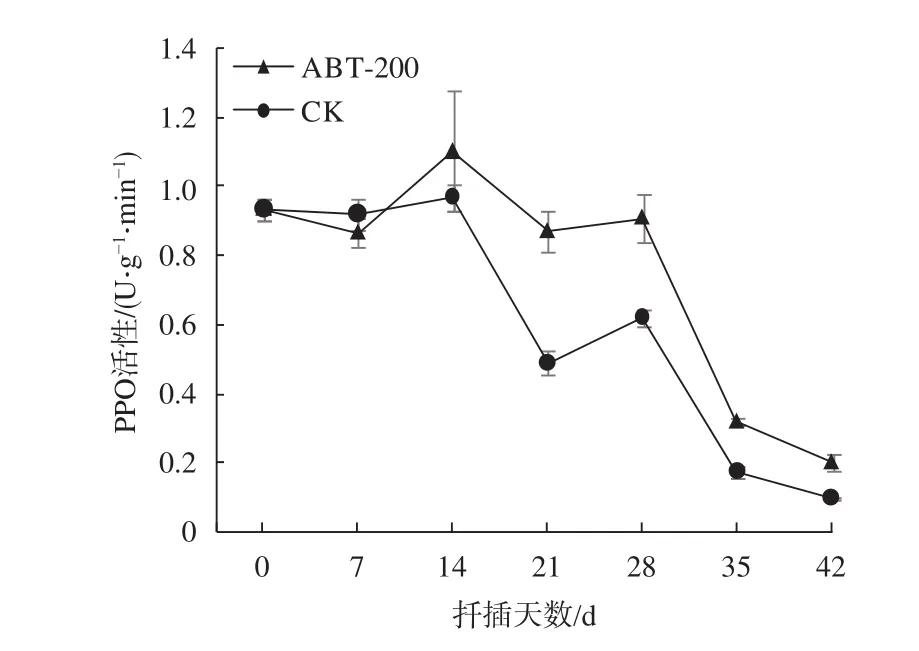
图 4 插穗生根过程中PPO活性变化Fig. 4 The dynamic changes of PPO activity in cuttings during rooting process
由图5可知,0~7 d处理组插穗基部SOD活性升高有利于自由基的消除。随着愈伤组织出现,插穗内各种生命活动恢复正常水平,SOD活性降低。14 d后再次上升,伴随着不定根形成以及叶片的展开,插穗逐渐具备了正常植株的功能,导致自由基大量减少,SOD活性相应降低。对照组SOD活性在14 d后才持续降低,可见植物生长调节剂处理不仅提前了生根时间,对于保护离体插穗免受外界胁迫有着重要作用。
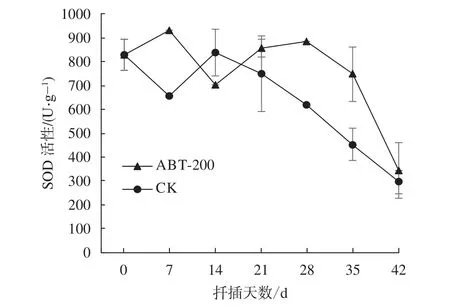
图 5 插穗生根过程中SOD活性变化Fig. 5 The dynamic changes of SOD activity in cuttings during rooting process
由图6可知,插穗离体后水分蒸发较快,受损严重,处理组插穗基部MDA含量小幅上升。随着SOD活性升高,愈伤组织及不定根的形成,插穗内MDA含量逐步下降。对照组中,插穗基部韧皮部MDA含量在扦插后14 d开始下降,相比于处理组晚了7 d,但两组的变化趋势大致相同。可见植物生长调节剂处理的插穗受逆境胁迫程度更小、时间更短。
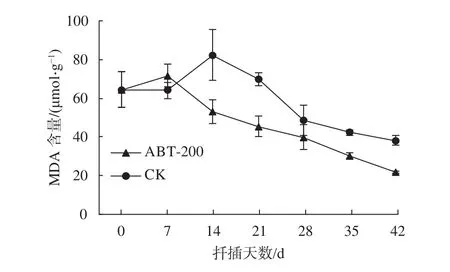
图 6 插穗生根过程中MDA含量变化Fig. 6 The dynamic changes of MDA content in cuttings during rooting process
2.4 插穗生根过程中内源激素含量的变化
由图7可知,扦插初期插穗基部GA3含量上升,可能的原因是植物生长调节剂的处理提高其含量,14 d达到峰值,说明高含量的GA3对愈伤组织的形成有促进作用。14 d后GA3含量呈下降趋势,此时不定根形成以及根突破表皮,可见GA3对根原基分化有重要作用。ZR含量经历了短暂的积累后随着愈伤组织的出现大幅降低,28 d后随着不定根生成,自身合成了ZR,含量小幅上升。处理组ZR含量始终高于对照组,由此可见植物生长调节剂处理可以提高插穗内ZR含量。植物生长调节剂处理使得0~14 d IAA含量不断上升,而愈伤组织出现后IAA含量下降。由于不定根的形成自身合成内源IAA以及POD活性降低使得21 d后IAA含量再次增加,处理组IAA含量始终高于对照组。通常认为ABA会对插穗生根起抑制作用,将插穗生根过程中ABA浓度控制在较低水平有利于增强IAA的运输,促进离体器官生长。扦插初期,ABA含量上升,原因是离体插穗受损严重,刺激了ABA的合成,而当愈伤组织出现后ABA含量降低;本试验中处理组插穗基部ABA浓度始终低于对照组。有报道认为IAA/ABA比值与生根率呈正相关;本试验中,植物生长调节剂处理过的插穗IAA/ABA高于对照组,与前人研究一致。
3 结论与讨论
3.1 植物生长调节剂处理与插穗生根的关系
插穗生根过程中,离体插穗的不定根再生能力与植物生长调节剂的处理有很大关系。母树年龄、树种特性、生根方式和外界条件等都是选择植物生长调节剂时应该考虑到的要素[11]。本试验中,200 mg/kg ABT处理插穗生根效果最好,生根率达33.30%,生根指数为1.693。不同种类植物生长调节剂处理纳塔栎嫩枝插穗时,生根效果最好的是ABT,其次为IAA和NAA,可能的原因是不同植物生长调节剂对木本植物扦插生根效果影响不同[12]。这与高银祥等[13]对南方红豆杉(Taxus chinensisvar.mairei)的扦插研究结果相似。
3.2 营养物质含量与插穗生根的关系
营养物质尤其是碳水化合物和氮素化合物,为插穗生根和植物正常生长提供物质和能量[14-15]。可溶性糖可作为呼吸底物被植物利用,为插穗生根提供能量,是插穗能量的主要来源。本试验中,扦插初期处理组插穗消耗储存的可溶性糖维持自身生命活动,导致可溶性糖含量大幅下降,而对照组有个短暂的积累过程才呈现下降趋势;愈伤组织出现后,基部代谢活跃,可溶性糖含量得到积累;21 d处理组插穗基部可溶性糖被大量消耗以用于不定根形成;扦插后期,处理组可溶性糖含量小幅上升,原因是叶片光合作用产生的光合产物弥补了基部可溶性糖的消耗。马尾松(Pinus massoniana)的扦插试验中,插穗基部可溶性糖含量在扦插后先升高,在生根时达到峰值,然后再次下降,该研究结果与本试验结果不同[16],可能的原因是取自不同树种的插穗基部可溶性糖原始含量不同。赵爽等[17]在对山木通(Clematis finetiana)扦插时得出的可溶性糖含量变化与本试验结果一致。
本试验中,处理组插穗基部可溶性蛋白先短暂积累后逐渐降低,原因是愈伤组织的出现需要积累可溶性蛋白,而不定根的生长以及新细胞的形成需要消耗可溶性蛋白。对照组可溶性蛋白变化趋势与处理组一致。张忠微等[18]在金露梅(Potentilla fruticosa)嫩枝插穗生根过程中发现,可溶性蛋白含量先降低再升高又降低,与本试验不同,可能的原因是扦插初期伤呼吸加强,代谢旺盛导致可溶性蛋白含量降低,而中期经过积累后可溶性蛋白大量消耗用于根原基和不定根的生长。
3.3 相关酶活性及MDA含量与插穗生根的关系
POD是插穗生根标志之一,同时在不定根发生过程中发挥重要作用[19-20]。本试验中,处理组POD活性出现2个峰值。21 d第1个峰值出现,此时插穗离体受损严重,高活性的POD增强了插穗的抗逆性;35 d出现第2个峰值,此时高活性POD能够减少IAA对生根的抑制作用。插穗生根过程中对照组POD活性与处理组相比较低,说明植物生长调节剂处理能够显著提高POD活性,有效促进根系的形成。扈红军等在榛子(Corylus heterophylla)扦插试验中发现POD活性仅出现1个峰值,这可能与插穗所受胁迫程度有关[21]。
本试验中,处理组与对照组PPO活性变化趋势基本一致,均出现2个峰值。扦插初期PPO活性较高对愈伤组织的形成有利,随后PPO活性降低。PPO活性第2个峰值出现在不定根大量出现时期。处理组PPO活性始终高于对照组,植物生长调节剂处理对愈伤组织和不定根的形成有着促进作用。Yilmaz等在对不同品种葡萄(Vitis vinifera)扦插时也得出此结论[22]。
SOD不仅可以提高植物的抗氧化能力,而且与不定根的形成关系密切[23]。插穗生根初期,高活性的SOD能清除多余的自由基,增强离体插穗的抗逆性;随着愈伤组织的出现,SOD活性逐渐降低;不定根出现前SOD活性再次升高,有利于起到保护生根的作用;插穗恢复正常植株功能后,体内自由基含量减少,SOD活性也逐渐降低。王关林等[24]通过喷洒代谢调节剂MHS加强对插穗生理生化的调控,从而提高了插穗的防御能力,促进生根。
MDA含量不仅可以用来衡量植物受损程度,而且还是鉴别植物发生衰老的指标之一[25]。纳塔栎嫩枝扦插过程中,MDA含量在扦插初期小幅上升,此时插穗离体,遭受较重伤害;而当SOD活性升高以及不定根大量形成,插穗内各项生命活性恢复正常,生长代谢趋于稳定,MDA含量逐渐下降。王云丽[26]在对沙棘(Hippophae rhamnoides)扦插时也得到了相同的结论。
3.4 内源激素与插穗生根的关系
插穗生根过程中愈伤组织的形成、根原基的诱导以及不定根的形成都与植物内源激素的含量以及相互作用密切相关[27]。本试验中,0~14 d IAA含量升高,原因是植物生长调节剂处理插穗后使得IAA含量升高;当愈伤组织出现后IAA含量下降;由于不定根形成之后,插穗自身会合成内源IAA,使得内源IAA含量再次升高。处理组IAA含量始终高于对照组,与史锋厚等[28]研究结果一致。普遍认为ABA在生根过程中起抑制作用,纳塔栎嫩枝扦插过程中对照组ABA含量始终高于处理组,这也是对照组生根率较低的原因。麻文俊在日本落叶松(Larix kaempferi)扦插时发现,IAA含量与扦插生根率并无显著联系,反而是ABA含量与生根率相关性较高[29]。植物器官内激素种类众多,每种激素含量及作用各不相同,植物的各种生理效应取决于某几种激素的相对含量,而某一种激素的绝对含量影响甚微。本试验中IAA/ABA值较小,生根率较低,与前人研究结果一致。愈伤组织的形成需要高含量的GA3,而当不定根形成以及根突破表皮,GA3含量大幅下降。董胜君等在研究山杏(Armeniaca sibirica)嫩枝扦插生根过程中插穗内源激素含量的变化时发现,GA3含量总体呈现下降趋势,在生根阶段下降趋势尤为明显[30]。ZR含量变化趋势大致为“上升—下降—上升”,愈伤组织大量出现时ZR含量下降幅度大,而不定根形成后自身合成了ZR。尹万元在对光叶榉(Zelkova serrata)进行扦插时,插穗基部ZR含量呈明显上升趋势,与生根过程同步[31]。
综上所述,植物生长调节剂处理显著提高了插穗的生根能力,且处理后的插穗营养物质含量、相关酶活性及内源激素含量显著升高。200 mg/kg ABT为纳塔栎最适宜的植物生长调节剂处理,该处理可在生产中推广应用。
