肿瘤3D细胞模型在体外药敏实验中的应用
2019-06-03刘艳红余孝其
刘艳红, 李 静, 余孝其, 王 娜, 刘 媛, 张 骥
(四川大学a.基础化学实验教学中心;b.化学学院,成都610064)
0 引言
国家“双创”政策的推行对高校人才培养提出了新的要求。如何扭转传统教学中“唯分数论”的教学评价体系,形成以培养创新思维、激发内源性创新动力为目标的人才培养体系,是高校教学改革的重要方向[1]。高校本科实验作为学生探索、实践的重要载体,在培养学生以“解决问题”为导向的批判性、创新性思维中发挥着重要作用。在本科实验教学中,不断改进旧的实验体系,逐步减少验证性实验项目的数量,增加“以问题”为导向的综合型、创新性实验项目的比重,是“双创”环境下,本科实验改革和发展的方向。本文以肿瘤个体化治疗的需求为依据,以建立体内外治疗效果一致的模型为目标,设计了一个创新型本科实验。
近年来,恶性肿瘤的发病率持续上升,手术联合化疗药物治疗依然是肿瘤治疗的主要手段[2]。但由于个体间存在差异,同一种分化类型的肿瘤在不同个体中表现出不同的药物敏感性[3]。因此,在体外建立与体内治疗效果一致且操作简单、易于评价的药敏检测方法是改善肿瘤化疗效果,提高肿瘤治愈率,实现肿瘤个体化治疗的重要途径。基于肿瘤个体化治疗的需求,结合最新的科研成果,将3D肿瘤细胞模型应用于体外药敏检测。通过该实验的开设鼓励学生关注不同学科的研究进展,提高学生运用前沿的实验技术、分析方法解决实际问题的能力。
1 实验
1.1 实验目的
学习并掌握肿瘤3D细胞模型的培养方法;了解体外药敏实验的检测方法;理解并掌握化疗药物敏感性的评价方法。提高学生查阅文献、获取信息、设计实验方案的能力;加强学生对体外不同细胞模型的认知。
1.2 实验原理
3D细胞培养是近年来化学生物学实验领域一项重要的新技术,与传统的单层细胞培养相比,该模型中细胞生长状态更接近于在体细胞中的状态,可以反映细胞与细胞、细胞与微环境之间的相互作用,在一定程度上重现疾病发生发展的过程[4-5]。目前,该模型已经应用于体外药物筛选、生物安全性评价、肿瘤浸润迁移等方面的研究[6-10]。3D细胞球是一种简单的3D细胞培养系统[11],主要采用悬滴法和低黏附培养法培养[12]。该细胞模型操作简便、大小可控、重复性好、易于大量培养,适合开发为本科教学实验。
体外药敏检测采用ATP生物荧光法(ATP-TCA)。该方法是体外药敏检测中灵敏度较高、稳定性较好、操作最简便的一种方法[13]。ATP-TCA法是通过对活细胞中的ATP进行定量检测,用ATP的含量反映活细胞的数量。其检测原理为:ATP是活细胞新陈代谢的一个指标,在正常生理状态下,细胞内ATP的含量稳定不变,但是,当细胞凋亡或坏死时,细胞内ATP可迅速降解。荧光素酶在有氧条件下,与荧光素结合,催化ATP转化成AMP,同时释放出荧光,荧光的强度与ATP含量呈正相关。因此,可以通过检测荧光强度反映活细胞的数量[14]。
1.3 实验试剂和仪器
1.3.1 实验试剂
琼脂糖、DMEM培养基、澳洲胎牛血清和 Live/Dead Cell Imaging Kit,美国赛默飞世尔科技公司;CellTiter-Glo3D Cell Viability Assay,美国Promega公司;甲基纤维素,美国Amresco公司;5-氟尿嘧啶(5-FU)和紫杉醇(PTX)为原料药,北京Solabio公司;氯化钠、氯化钾、磷酸二氢钠、磷酸氢二钾均为国产分析纯。
1.3.2 实验仪器
化学-荧光发光仪,美国赛默飞世尔科技公司;LSM 780共聚焦显微镜,德国蔡司公司;TS-100型倒置显微镜,日本尼康公司;二氧化碳培养箱,美国赛默飞世尔科技公司;超净工作台,苏州安泰空气技术有限公司等。
1.4 实验方法
1.4.1 细胞培养
人肝癌细胞HepG2培养于高糖DMEM培养基中,内含10% 胎牛血清和1%青-链霉素混合液。人肺癌细胞 A549用含10% 胎牛血清和1%青-链霉素的RPMI1640培养基培养。当细胞汇合率达到90%以上时,用于后续实验。
1.4.2 3D 细胞培养
将HepG2和A549细胞分别消化成单细胞悬液,并计数。然后,用含0.24% 甲基纤维素的完全培养基将HepG2细胞悬液稀释至1×105个/mL,A549细胞的密度调整为1.5×105个/mL,混合均匀后将其滴加至细胞培养皿内盖上,每滴25 μL,内盖反扣盖好后放置于37℃,5%CO2培养箱中培养。次日,将内盖上已形成的多细胞团转移至琼脂糖(质量体积比为1%)预包被的96孔板中,每孔一个细胞团,单孔加入100 μL完全培养基,置于培养箱中继续培养,待细胞球的直径约为500 μm时用于后续实验。
1.4.3 化疗药物体外药敏检测
根据化疗药物5-FU和PTX在动物体内的血浆峰值浓度(PPC)配制200×母液,其中,5-FU的 PPC为160 μg/mL,PTX 的 PPC 为 54 μg/mL[15]。实验前,吸去96孔板内的培养基,加入新鲜的完全培养基,每孔100 μL。将药物按照 8×PPC、4×PPC、2 ×PPC、1 ×PPC、0.5 ×PPC、0.25 ×PPC、0.125 × PPC 和 0.0625 ×PPC加入96孔板中,每个浓度设8个复孔,然后置于细胞培养箱中培养。药物作用48 h后,每孔加入100 μL ATP检测试剂,室温震荡5 min后,再放置25 min,然后采用化学-荧光发光仪进行读数。
1.4.4 药物敏感性评价
采用Origin 8.5软件计算化疗药物每个浓度对3D肿瘤细胞生长的抑制率,计算方法如下:
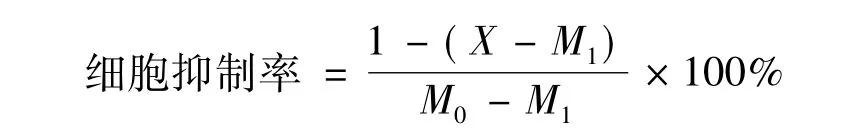
其中:X为药物组8个复孔的平均发光值;M1为未加细胞和药物的对照组8个复孔的平均发光值;M0为未加药物对照组8个复孔的平均发光值。
计算出一系列不同浓度的化疗药物对HepG2肿瘤细胞球的抑制率后绘制抑制曲线,并计算不同药物的IC50值和IC90值。按 Kurbacher[16]、翁春梅等[14]的标准判定肿瘤对化疗治疗药物的敏感性。
1.4.5 Live/Dead 细胞成像分析
化疗药物5-FU和PTX按照PPC浓度作用HepG2 3D细胞48 h后,采用Live/Dead细胞双色染色法进行染色,染色方法参考说明书。将Live Green和Dead Red试剂等比例混合,配制成2×工作液,然后等体积加入到待检测细胞培养孔中,室温孵育15 min后,通过激光共聚焦成像进行分析。活细胞成像的最大激发和发射波长为488 nm和515 nm,死细胞成像的最大激发和发射波长为570 nm和602 nm。
1.4.6 统计学分析
采用SPSS13.0统计软件进行统计学分析。数据用均数±标准差(X±s)表示,药敏检测结果用t检验,P<0.05表示差异有统计学意义。
2 实验结果
2.1 体外药敏检测结果
3D肿瘤细胞球对化疗药物5-FU和PTX的药物敏感性结果如图1所示。化疗药物5-FU在低浓度时即表现出明显的抑制细胞生长作用,其中,对A549细胞球的抑制作用明显强于HepG2细胞[图1(a)]。作为抑制微管解聚类药物,PTX可以有效地抑制两种细胞球的生长,且半数抑制浓度IC50值均小于PPC值。PTX 对 HepG2 细胞球的IC50为 1.48 μg/mL,是 PTX PPC浓度的2.7%,PTX对 A549细胞球的IC50值为9.91 μg/mL,是 PPC 的18.3%。与5-FU 不同,PTX 对HepG2细胞球的抑制作用明显强于A549细胞[图1(b)]。按照 Kurbacher等[16]对化疗药物敏感性的评价标准对实验结果进行分析,结果见表1。A549 3D细胞模型对两种化疗药物均表现出中度敏感,而HepG2 3D细胞模型对化疗药物PTX中度敏感,对5-FU不敏感。
2.2 Live/Dead细胞成像结果
由于活细胞的细胞膜具有选择透过性,一些荧光染料无法进入活细胞,被排除在活细胞之外。利用活细胞和死细胞膜通透性的不同,实验采用双色荧光染色的方法对HepG2 3D细胞进行染色,结果如图2所示。5-FU作用3D细胞48 h后,细胞球内部出现少量红色荧光着色细胞,但是细胞球的结构依然致密,表明5-FU对HepG2 3D细胞具有一定的杀伤作用。PTX作用48 h后,3D细胞球结构变得疏松,出现大量零散的细胞团,红色荧光着色细胞量增加,显示 PTX对HepG2 3D细胞具有明显的毒性。该结果与体外药敏检测结果一致。

图1 5-FU和PTX对3D细胞球生长的抑制曲线

表1 两种肿瘤3D细胞球对化疗药物的敏感性

图2 双色荧光染色显示活细胞和死细胞
图2中A和B为共聚焦成像后的三维重构图,a和b为3D细胞球横向和纵向的截面图(注:图中标尺所示为 100 μm)。
本实验在体外建立了应用于化疗药物敏感性检测的3D肿瘤细胞模型,结果表明,HepG2细胞球对化疗药物PTX中度敏感,对5-FU不敏感。A549细胞球对化疗药物PTX和5-FU中度敏感。
3 教学效果分析
(1)以“解决问题”为导向,改革实验项目,激发学生的内在动力。以“问题”为导向,设计创新性实验项目,鼓励学生查阅文献,并结合已掌握的专业知识,创造性地解决实际问题,可以激发学生学习的动力。本实验以解决“在体外建立与体内效果一致的药敏检测体系”为目标,设计了一个创新性实验。实验前,鼓励学生参与实验设计,独立分析和解决问题,在实践中培养学生独立思考、善于分析的能力,激发学生敢于突破、勇于创新的内在动力。
(2)将先进的实验方法引入本科实验,拓展学生的知识视野。3D细胞培养是一种新的细胞体外培养方法。它弥补了传统单层细胞培养的不足,是单层细胞模型和实验动物模型连接的有效桥梁[4]。目前,3D细胞模型已经成为科学研究领域的一项重要技术。将该实验方法引入,向学生介绍最前沿的实验技术,打通了科研与教学的壁垒,增加了学生对学科前沿的了解。
(3)通过创新性实验的设计,培养学生的批判性、创新性思维。体外药敏检测方法有多种,如何选择适用于3D细胞球的检测方法,需要在实践中去尝试和探索。目前,已报道的ATP-TCA法主要应用于单层细胞模型的检测,该方法的灵敏度很高,最低检测限为几百个细胞。通过与其他细胞活力检测方法的比较发现,该方法同样适用于较小细胞团细胞活力的检测。另外,该方法操作简便、稳定性好,且检测时间短,因此,选用ATP-TCA法检测3D细胞球的细胞活力。通过以“问题”为导向实验项目的设计,在实践中训练学生获取信息、分析归纳、探索总结的能力,并逐步培养学生的批判性、创新性思维。
4 结语
“培养创新精神,激发内在创新动力”是“双创”政策的核心思想,也是对高校实验教学体系改革的要求。在本科实验教学中,加大以“问题”为导向的创新性实验项目比例有利于学生创新思维的培养。“肿瘤3D细胞模型在体外药敏实验中的应用”是以解决肿瘤个体化治疗中的实际问题为导向,以最新的实验技术和分析方法为主要内容的一个创新性实验项目,也是“双创”环境下的一次重要的尝试。该实验项目已经取得了阶段性的成果,还需要在推广中不断地完善。而这种以解决问题为导向,以紧跟学科前沿的先进方法、先进技术为实验内容的创新实验项目的开发将有助于高校实验教学改革和创新人才培养。
