不同海拔对福建戴云山黄山松林土壤微生物生物量和土壤酶活性的影响
2019-05-31赵盼盼周嘉聪林开淼林伟盛曾晓敏徐建国陈岳民杨玉盛
赵盼盼,周嘉聪,林开淼,林伟盛,袁 萍,曾晓敏,苏 莹,徐建国,陈岳民,*,杨玉盛
1 福建师范大学湿润亚热带生态地理过程教育部重点实验室, 福州 350007 2 福建师范大学地理研究所, 福州 350007 3 福建戴云山国家级自然保护区管理局, 福建泉州 362500
海拔梯度作为一种自然地理变化,会导致温度、光照、水分等多种环境因子的变化,进而直接或间接影响土壤微生物生物量、群落结构以及土壤酶活性[1-2]。其中土壤微生物生物量和土壤酶在碳源碳汇动态及通量变化、土壤养分转化和循环过程中具有不可代替的作用,是土壤生态系统代谢的重要动力[3]。土壤酶是催化土壤有机物质分解的蛋白质,主要来源于微生物、植物根系及动物的分泌释放。它常参与土壤中有机物质转化的全过程,直接或间接影响着土壤一系列的生物化学反应[4-5],对生态系统的物质循环产生重要影响[6-7]。
目前关于不同海拔梯度对森林土壤酶活性的影响并无统一定论。许多研究结果表明,随海拔梯度增加土壤酶活性下降,如Lei等人[8]研究发现,多酚氧化酶、过氧化物酶、门冬酰胺酶、蛋白酶、脲酶和碱性磷酸酶活性均随海拔梯度增加而下降;斯贵才等[9]在念青唐古拉山沼泽(4325—4956 m)也得出一致结论。这是因为土壤温度往往是影响土壤酶活性的重要环境因子[10],土壤温度上升影响土壤酶的动力学,从而影响土壤酶活性,增温后土壤酶活性显著增加[11- 12]。但海拔梯度并非简单地反映温度的变化,随着海拔梯度许多环境因子会同时发生变化[13],如光照、水分、温度、土壤养分、凋落物质量、植物根系等[14],而这些变化又会造成区域小气候、土壤理化性质、植被类型等垂直地带性上的差异[2]。曹瑞等[15]在川西海拔1563—3994 m的高山峡谷区5个不同植被带(干旱河谷、干旱河谷山地森林交错带、亚高山针叶林、高山森林和高山草甸)研究发现随海拔升高有机层土壤中土壤蔗糖酶、脲酶及ACP酶活性呈现出先增加后减少再增加的变化特点。然而金裕华等[16]在武夷山不同海拔4个典型植被带(常绿阔叶林、针叶林、亚高山矮林以及高山草甸)研究发现土壤酶活性随海拔升高总体上呈上升趋势。不同海拔上不同植物类型所产生的凋落物及根系分泌物性状差异较大,在输入土壤中容易对微生物群落结构、功能及其多样性产生影响[17],进而影响土壤酶活性。因此,植被类型的差异可能会复杂化酶活性对海拔梯度的响应。本研究通过控制植被类型变量,探究土壤酶活性对海拔的响应,这对未来全球变化大背景下,森林土壤生态过程(如养分循环)具有积极指示作用。
黄山松(Pinustaiwanensis)又称台湾松,常绿针叶乔木,分布于中国东南部,是高山地绿化和用材的优良树种[18],也是亚热带地区的主要建群种。戴云山山脉是东南地区重要的生物多样性的基因库,也是中国最大的黄山松种质基因基地[19],现已成为研究的热点区域[20-22]。因此,本研究以不同海拔黄山松林为研究对象,探究不同海拔对中亚热带黄山松森林土壤微生物生物量和土壤胞外酶酶活性有何影响及驱动酶活性变化的关键环境因子,以期为戴云山不同海拔梯度上黄山松林长期发展和管理提供科学依据。
1 试验区与试验设计
样地位于福建省泉州市戴云山自然保护区(25°38′—25°43′N,118°05′—118°05′E),该保护区地处中亚热带向南亚热带的过渡区域,是中国单位面积生物多样性程度最高的自然保护区之一。气候类型为亚热带海洋性季风气候,具有冬冷夏热,水热同期,湿润多雨等特点。年平均气温20℃,年降水量达1700—2000 mm,年平均相对湿度80%[23]。2017年5月,选取戴云山3个海拔1300 m(L)、1450 m(M)、1600 m(H)样地条件基本相近的黄山松纯林,于每个海拔梯度设置20 m×20 m的标准样地,每个标准样地的主要优势树种均为黄山松,林内其他乔木较少,林下植被相似,L、M海拔和H海拔相比灌木较多,林下灌木层优势树种以肿节少穗竹(Oligostachyumoedogonatum)为主,伴生有钝齿冬青(Llexcrenata)、鹿角杜鹃(Rhododendronlatoucheae)、窄基红褐柃(Euryarubiginosavar.attenuata)和短尾越桔(Vacciniumcarlesii)等;草本层以里白(Hicriopterisglauca)为主,伴生有德化假卫茅(Microtropisdehuaensis)、藜芦(Veratrumnigrum)、狗脊蕨(Woodwardiajaponica)和黑莎草(Gahniatristis)等,土壤均为花岗岩发育的黄壤。样地基本情况详见表1。

表1 不同海拔土壤样地基本情况
2 研究方法
2.1 土壤样品采集
在每个标准样地内随机布设5个2 m×2 m小样区,去除表面凋落物,每个小样区采用“S”型混合采样方法设置5个点混合取样,按土壤的发生层划分为淋溶层(A层),取土深度约为10 cm;淀积层(B层),取土深度约为10—25 cm。将采集的土壤样品迅速带回实验室保鲜。去除可见根系、石粒等及动植物残体后,将土壤过2 mm筛。然后将土样用四分法分为两部分,一部分鲜土用于土壤速效养分、含水率、土壤微生物生物量和土壤酶活性的测定;另一部分土壤室内自然风干后过0.149 mm筛,用于测定土壤总氮磷等基本理化指标。
2.2 土壤理化性质测定方法
土壤总碳、总氮用碳氮元素分析仪(Elementar Vario EL III,Elementar,德国)测定。总磷采用HClO4-H2SO4法[24]消解后,通过0.45 μm玻璃纤维过滤器(Q/IEF J01- 1997,上海),并用连续流动分析仪(Skalar san++,Skalar,荷兰)测定。土壤pH通过玻璃电极pH计(STARTER 300,OHAUS,美国)测定,水土比为2.5∶1。土壤温度采用手持式长柄温度计(SK- 250WP,SK Stoto,日本)测定。
2.3 土壤可溶性养分

2.4 土壤微生物生物量碳、氮、磷测定
微生物生物量碳(MBC)和微生物生物量氮(MBN)采用氯仿熏蒸-K2SO4浸提法[25],最后用总有机碳分析仪(TOC-VCPH/CPN,日本)测定提取液中MBC,用连续流动分析仪(Skalar san++,荷兰)测定MBN。MBC计算公式:BC=ΔEC/kC,式中:ΔEC为熏蒸与未熏蒸土壤有机碳含量的差值,kC为转换系数,取值0.45。MBN计算公式:BN=ΔEN/kN,式中:ΔEN为熏蒸与未熏蒸土壤有机氮含量的差值,kN为转换系数,取值0.54。土壤微生物生物量磷(MBP)采用氯仿熏蒸-NaHCO3浸提法[26],计算公式为:BP=ΔEP/kP,转换系数kP取值0.40。
2.5 土壤酶活性测定
土壤酶活性参照Saiya-Cork和Sinsabaugh[27]的方法提取和培养土壤中6种与碳、氮、磷循环相关的水解酶和氧化酶。用伞形酮(MUB)作为底物标示水解酶活性,用L-二羟苯丙氨酸(DOPA)为底物标示氧化酶活性。微平板置于暗环境下经过20℃恒温培养,水解酶和氧化酶分别培养4 h和18 h,用多功能酶标仪(SpectraMax M5,美国)测定其荧光度(水解酶)或吸光度(氧化酶)。6种土壤酶的名称、缩写、编号、功能及所用标定底物见表2。各种酶都通过预实验确定获得最大酶活性所需要的底物浓度和培养时间。

表2 土壤酶活性的种类、缩写、类型和所用底物
2.6 数据处理
数据经过Microsoft Excel 2013软件处理后,采用SPSS 21.0统计软件对不同海拔土壤各指标进行统计分析。采用单因素方差分析(one-way ANOVA)检验不同海拔处理之间土壤理化性质,土壤微生物生物量及土壤酶活性的差异显著性(Duncan法,α=0.05);用双因素方差分析(two-way ANOVA)比较分析海拔和土层下土壤理化性质,土壤微生物生物量及土壤酶活性的差异显著性(Duncan法,α=0.05)。采用Canoco Software 5.0软件以土壤理化性质及微生物生物量为解释变量,以土壤酶活性作为物种变量做冗余分析(Redundancy Analysis,RDA);绘图由Origin 9.0软件完成。
3 结果与分析
3.1 不同海拔对土壤理化性质的影响
在A层土壤中,随海拔升高,土壤含水量、土壤温度、土壤总碳含量、总氮和C/N均具有下降的趋势,尤其在L和H海拔之间具有显著差异(P<0.05)(表3)。随着海拔的升高,pH呈现出下降的趋势,但未达到显著水平。在B层土壤中,海拔变化对pH和土壤温度无显著影响,但海拔升高显著降低土壤含水量、总碳、总氮、总磷和C/N(P<0.05)。


表3 不同海拔黄山松林土壤基本理化性质

3.2 不同海拔对微生物生物量的影响
土壤微生物生物量在不同海拔之间呈现出相同的变化趋势。除A层的MBC含量外,A和B层土壤中MBC、MBN、MBP的含量随海拔升高均呈显著下降(P<0.05,图1)。海拔和土层对MBC、MBN、MBP均有显著影响(P<0.05),此外海拔×土层只对MBP有显著的交互作用(P<0.05)。
3.3 不同海拔对土壤酶活性的影响
整体而言,不同海拔梯度对A层土壤的酶活性影响显著,对B层土壤的酶活性影响整体较小(表4)。随海拔升高A层土壤中βG和CBH活性显著下降(P<0.05),和L海拔相比,H海拔βG和CBH活性下降幅度分别达36.87%和42.79%,而ACP酶活性显著增加(P<0.05),此外PEO酶活性在L海拔最低,而海拔效应对NAG无影响。B层土壤中,M海拔βG、PEO、NAG活性最小;而CBH和ACP酶活性随海拔梯度则无显著变化。海拔变化对4种水解酶和两种氧化酶活性均有显著影响,其中对βG和PEO达到极显著影响(P<0.001)。除PHO以外,土层对其他酶均有极显著影响(P<0.001)。海拔×土层对6种酶均有显著的交互作用(P<0.05)。
3.4 土壤酶活性变化的RDA分析
以土壤酶活性作为响应变量,土壤理化性质和土壤微生物生物量作为环境解释变量,并结合不同海拔处理样点,分别对A、B两层土壤的酶活性进行冗余分析。
如图2所示,不同海拔梯度都按照一定的规律进行了很好的聚类,说明海拔显著影响了土壤酶活性。图2中共解释了A层土壤酶活性变异程度的79.95%。其中MBP与第一轴呈明显正相关,解释了A层土壤酶变异的47.40%,C/N解释了该土层土壤酶变异的12.50%,说明二者对A层土壤酶活性起着重要的作用。图2中共解释了B层土壤酶活性变异程度的66.33%。而MBP和WC是解释度最高的2个环境因子,其中WC于第一轴呈明显正相关,解释了B土层土壤酶变异的27.80%,MBP解释了27.10%,说明两者对B层土壤酶活性起重要作用。

图1 不同海拔对土壤微生物生物量的影响Fig.1 Effects of different altitudes on soil microbial biomass表中数据为平均值±标准差(n=5),不同小写字母表示不同海拔相同土层之间差异显著(P<0.05); ns, 表示无显著性影响;*, **, ***分别代表P<0.05, P<0.01, P<0.001
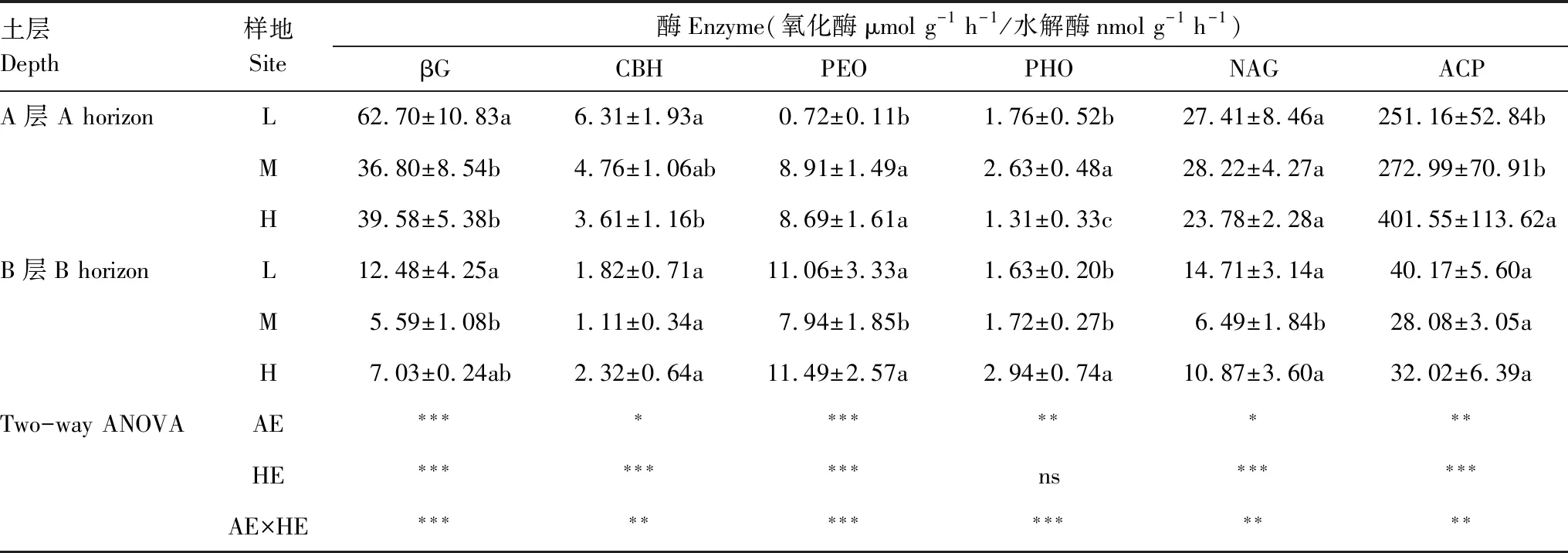
土层Depth样地Site酶Enzyme(氧化酶μmol g-1 h-1/水解酶nmol g-1 h-1)βGCBHPEOPHONAGACPA层 A horizonL62.70±10.83a6.31±1.93a0.72±0.11b1.76±0.52b27.41±8.46a251.16±52.84bM36.80±8.54b4.76±1.06ab8.91±1.49a2.63±0.48a28.22±4.27a272.99±70.91bH39.58±5.38b3.61±1.16b8.69±1.61a1.31±0.33c23.78±2.28a401.55±113.62aB层B horizonL12.48±4.25a1.82±0.71a11.06±3.33a1.63±0.20b14.71±3.14a40.17±5.60aM5.59±1.08b1.11±0.34a7.94±1.85b1.72±0.27b6.49±1.84b28.08±3.05aH7.03±0.24ab2.32±0.64a11.49±2.57a2.94±0.74a10.87±3.60a32.02±6.39aTwo-way ANOVAAE∗∗∗∗∗∗∗∗∗∗∗∗HE∗∗∗∗∗∗∗∗∗ns∗∗∗∗∗∗AE×HE∗∗∗∗∗∗∗∗∗∗∗∗∗∗∗
AE:海拔, Altitude effect; HE:土层, Horizon effect; AE×HE:海拔和土层交互作用, Interaction effect of altitude and horizon; 表中数据为平均值±标准差(n=5), 同一列不同小写字母表示同一土层不同海拔间差异显著; ns, 表示无显著性影响;*, **, ***分别代表P<0.05,P<0.01,P<0.001; βG: β-葡萄糖苷酶, β- 1,4-glucosidase; CBH: 纤维素水解酶, Cellobiohydrolase; PHO: 多酚氧化酶, Polyphenol oxidase; PEO: 过氧化物酶, Peroxidase; NAG: β-N-乙酰氨基葡萄糖苷酶; ACP: 酸性磷酸酶, Acid phosphatase

图2 不同海拔对A层和B层土壤酶活性影响的冗余分析Fig.2 Correlations of soil enzyme activities in A and B horizons to soil properties as determined by redundancy analysis(RDA)LA/B:1300 m海拔A/B层; MA/B:1450 m海拔A/B层; HA/B:1600 m海拔A/B层; MBP:微生物生物量磷, Microbial biomass phosphorus; TP:总磷, Total phosphorus; AP:有效磷, Available phosphorus; WC:含水率, Water content; C/N:碳/氮, Carbon/nitrogen
4 讨论
4.1 不同海拔下土壤理化性质变化
4.2 不同海拔下土壤微生物生物量的变化
土壤微生物生物量是土壤微生物发挥作用的重要基础,由于其周转快、灵敏度高,可以反映土壤肥力和土壤环境质量的微小变化[37]。可以作为非稳定性有机碳的指示器[38-39],是生态系统重要的活性炭库和养分库,对水热环境条件变化敏感[40-41]。本研究发现MBC、MBN和MBP含量都随海拔升高呈下降趋势,这与Hamilton和Frank[42]研究结果相似。L地区土壤温度较高,提高土壤温度能够促进根系生长[43],增加根系分泌物,微生物生物量随之增加,另一方面土壤温度升高促进了微生物繁殖,提高了微生物活性,使微生物分解有机质作用加强,因此增加了微生物生物量。还有研究表明,土壤有机质含量是影响土壤微生物量的重要因素[44-45],胡宗达等[46]研究发现,MBC、MBN与SOC和TN含量间存在良好的正相关关系。本研究H海拔的A层TC和TN含量相比于L海拔较低,这也可能导致该海拔下A层土壤MBC和MBN含量最低的原因。A和B两层微生物生物量总体变化趋势一致。曹瑞等[15]在海拔1563—3994 m的川西高山峡谷区得出类似的结果,研究也表明矿质层中MBC、MBN的总体变化趋势与有机层基本一致。
4.3 土壤酶活性对不同海拔的响应
土壤酶常作为微生物代谢的指标,在生态系统养分循环中起着重要的作用[47]。βG和CBH酶是纤维素水解酶类,它们的活性与纤维素分解的快慢密切相关。其中βG酶是土壤有机碳变化的重要指标,被认为是土壤中主要的碳素获得酶之一[48]。PEO和PHO酶是木质素降解酶类,它们是土壤中主要的木质素降解酶[49]。NAG酶主要参与分解土壤中的几丁质,被认为是主要的N素获得酶之一[48]。ACP酶活性的高低影响土壤有机磷的矿化,是酸性土壤中最重要的磷素获得酶[48]。
4.4 驱动土壤酶活性变化的关键因子
已有研究表明,土壤酶活性主要是受温度、水分[59]、微生物生物量[60]、pH和养分有效性[61]、真菌/细菌比[62-63]以及地上优势种植物种类[64]的影响。在本研究中发现MBP和C/N是驱动A层土壤酶活性变化的主要因子,WC和MBP是驱动B层土壤酶活性变化的主要因子,MBP均是驱动两层土壤酶活性变化的重要因子。有研究者通过微生物-酶模型表明土壤微生物生物量在土壤C、N周转中起重要作用[65]。Gao等[66]研究表明养分相对缺少的环境下,MBC等养分的状况是决定酶活性强弱的主导因素。而本地区是磷限制地区,随海拔升高,磷素含量显著下降,缺磷现象加剧,MBP常作为磷的一种有效库,具有决定作用,可以对土壤中的有效磷进行补充,因此这可以解释MBP是决定本地区酶活性的关键因子。另外C/N也是影响A层土壤酶活性的重要因子,随海拔升高,C/N显著下降,与参与C、N循环相关的βG,NAG,CBH呈现正相关关系,有研究表明土壤C/N较低时有机质具有较快的矿化作用[67],H海拔地区C/N较低,表明该海拔梯度内有机质分解的速度较快,因而H海拔地区A层土壤的有效氮和DON含量较高。海拔是一个综合性的环境因素,亚热带山地受到复杂地形因子的影响,温度等因子共同影响土壤养分循环及微生物活动。