南宁市某医院2014-2017年结核分枝杆菌rpoB、katG和inhA突变监测分析*
2019-05-30韦善求麻秋英罗顺达倪祖彥文乐敏
韦善求,麻秋英,罗顺达,倪祖彥,文乐敏
(广西壮族自治区南宁市第四人民医院:1.检验科;2.医务部 530023)
耐多药结核病(multidrug-resistant tuberculosis,MDR-TB)治愈率低、病死率高,是全球性的难题和挑战。中国是全球22个结核病高负担国家之一[1],耐药率及广泛耐药率均高于全球平均水平。近年发现MDR-TB有直接传播的证据,其中诊断延迟是重要的高危因素[2]。药敏试验是我国诊断结核菌耐药的金标准,但时间长约2~3个月,是影响耐药结核病疗效和传染源控制的重要因素。线性探针技术(lineprobe assay,LipA)通过检测结核分枝杆菌(mycobacterrium tuberculosis,MTB)rpoB、katG和inhA突变预测利福平(rifampicin,RFP)和异烟肼(isoniazid,INH)耐药,最快6 h内完成检测,特异度和灵敏度高,被世界卫生组织(WHO)推荐应用于MDR-TB诊断[3],这项技术在我国得到了广泛应用[4]。2014年起本院采用LipA技术对部分MTB -DNA阳性标本进行了rpoB、katG和inhA突变监测,及时为患者提供了用药指导,现将结果进行回顾分析,为本地区结核病耐药防控政策制定提供基础数据。
1 材料与方法
1.1材料
1.1.1标本来源 随机选取2014年1月至2017年12月在本院进行MTB-DNA检测,结果阳性且定量聚合酶链反应(PCR)循环阈值(cycle threshold,CT)≤20的标本,排除同一患者重复标本。MTB-DNA阳性的判定符合《结核病实验室标准化操作与网络建设》[5]的相关标准。
1.1.2主要试剂 MTB-DNA试剂盒购自中山达安基因公司,Geno Type MTBDRplus试剂盒购自德国Hain Lifesciences公司。
1.1.3主要仪器 实时荧光RCR扩增仪购自美国ABI公司,RCR扩增仪购自Biometra公司,TwinCubator®杂交仪购自德国Hain Lifesciences公司。
1.2方法
1.2.1标本采集 用宽口螺旋盖无菌培养瓶采集下呼吸道痰液、肺泡灌洗液或脓性分泌物1~3 mL送检。
1.2.2MTB-DNA检测 在标本中加1~2倍体积4%氢氧化钠溶液,涡旋振荡30 s,静置15 min,使标本均匀化。取1 mL加入1.5 mL离心管,14 000 r/min离心5 min,弃上清液。沉淀加灭菌生理盐水1 mL混匀,14 000 r/min离心5 min,弃上清液,再重复1次,阳性质控品不需要均匀化,处理方法与标本相同;取MTB阴性、临界阳性质控品8 000 r/min离心5 s,吸50 μL加入1.5 mL离心管中。在标本管和各质控品管中加50 μL DNA提取液,充分混匀,100 ℃恒温处理10 min,10 000 r/min离心5 min,取上清液2 μL加入PCR反应管,上机扩增。结果分析按照说明书要求执行。
1.2.3rpoB、katG和inhA突变检测 包括4个步骤:(1)DNA提取,选取MTB-DNA阳性且CT≤20的标本,沉淀物处理方法与1.2.2相同,用100 μL水中重悬沉淀物,95 ℃干浴器上灭活20 min,超声波水浴中超声振荡15 min,10 000 r/min离心5 min,上清液即DNA模板。(2)多重PCR扩增,准备含有DNA聚合酶的扩增体系 45 μL,加5 μL DNA 模板上机扩增,反应条件为:95 ℃ 15 min;95 ℃ 30 s,58 ℃ 2 min,循环10次;95 ℃ 25 s,53 ℃ 40 s,70 ℃ 40 s,循环30次;70 ℃ 8 min。(3)杂交:扩增产物与Gene Type MTBDRplus试剂盒中的膜条进行杂交,按说明书操作。(4)结果判读:试条上有27条反应带,质控带6条包括标记物质控CC、扩增质控AC、确认结核分枝杆菌复合群TUB带、rpoB及katG和inhA位点质控带;11条野生型探针带(WT),10条突变探针带(MUT),当6条质控带均显色表示结果有效,按以下规则判读:某一基因区所有WT带均显色,而无MUT带显色,表示该基因区没有发生可检测的突变,试验菌株对相应药物敏感;若某基因区至少有1条WT带缺失或(和)MUT显色,表示试验菌株对相应药物耐药;若某基因区所有WT均显色,但同时MUT显色,提示标本中同时存在耐药株和敏感株(异质性耐药)。
1.2.4耐药判定 rpoB+katG 或(和)inhA突变判定为MDR、katG或inhA突变判定为耐INH,rpoB突变判定为耐RFP,无rpoB、katG和inhA突变判定为敏感,MDR是指对一种以上的抗结核药物至少包括 RFP 和 INH 同时耐药。
1.3统计学处理 检出率、耐药率及观察指标中各参数的构成比采用百分率方法进行统计。
2 结 果
2.1LipA检测结果 部分结果见图1。10号条膜rpoBWT条带全部显色,MUT2B(+),判定为RFP异质性耐药;11号条膜[katGWT(-)MUT1(+)],判定为INH耐药;12号条膜[rpoBWT2/3(-)katGWT(-)MUT1(+)],14号条膜 [rpoBWT3/4/5(-)katGWT(-)MUT1(+)],判定为MDR;5~9、13、16、18~22号标本的WT带均显色,无MUT显色,判定为敏感株;1~4、15、17号条膜TUB(-),判为试验失败。
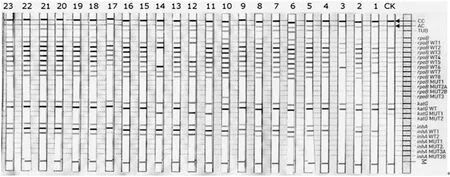
CK为空白对照;23号为37RV标准株;10号为rpoB WT(+)MUT2B(+);11号为katGWT(-)MUT1(+);12号为rpoBWT2/3(-)katGWT(-)MUT1(+);14号为rpoBWT3/4/5(-)katGWT(-)MUT1(+);5~9、13、16、18~22号均为rpoBWT(+)、katGWT(+)、inhAWT(+)及对应的MUT(-);1~4、15、17 号均为TUB(-)
图1 线性探针检测结果图
a:包括H526 (R,P*,Q*,N,L,S,C)位点突变;b:罕见的突变,仅在理论上能被检测到,在体外可能检测不到这种突变;c:包括rpoBWT1、2、3、2/3、3/4、4/5、5/6、7/8 野生型探针缺失
2.2rpoB、katG及inhA突变及其主要位点频率 对2 624份标本进行LipA检测,2 072份结果有效,菌株的主要突变类型及位点见表1。rpoB突变株中,突变频率居前的3个位点是S531L位,占194株(63.40%)、H526Y或H526D位,分别占34株(11.11%)、其他H526位,占26株 (8.50%);INH耐药相关突变包括katG突变245株、inhA突变52株、katG和inhA均突变6株,其中katG 315位点突变251株(82.85%)。rpoB、katG及inhA突变率见表2。
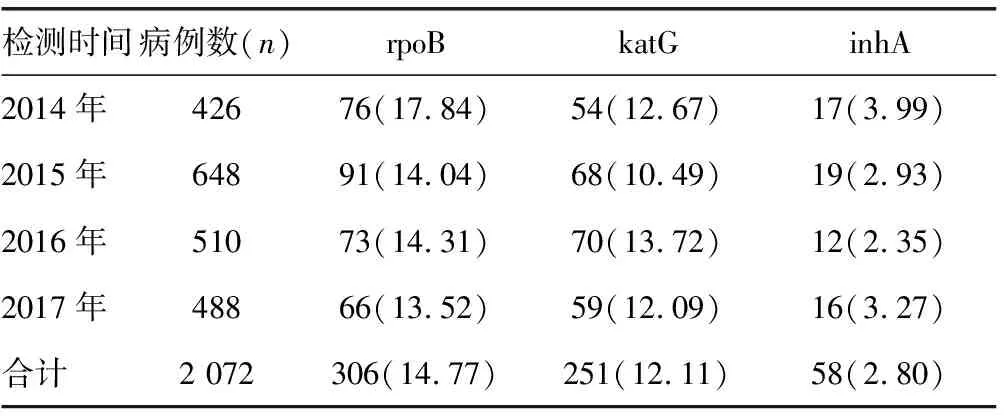
表2 rpoB、katG及inhA突变率[n(%)]
2.3突变类型 WT包括各种基因最重要的耐药区, MUT是常见突变位点。根据“WT是否缺失或(和)MUT出现”分4种类型(表3),其中“MUT出现并对应WT缺失”是热点突变型,“仅MUT出现”或“MUT出现并WT缺失(非对应)”突变型是异质耐药型,本研究共检测到35株异质性耐药菌,突变型中“MUT出现并对应WT缺失”型占81.37%。
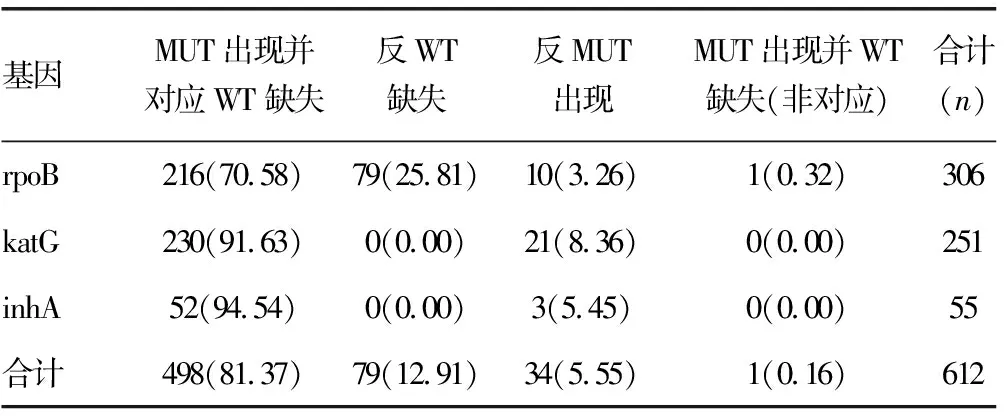
表3 rpoB、katG和inhA突变类型[n(%)]
2.4相关耐药 根据基因突变与表型耐药的关系,本组病例有410例耐药,其中303例耐INH,306例耐RFP,199例MDR(表4)。在rpoB突变株中耐多药株占65.03%(199/306),从无rpoB、katG和inhA突变株中随机抽查同期进行MTB培养和药敏试验的患者30例,药敏试验结果全部敏感。
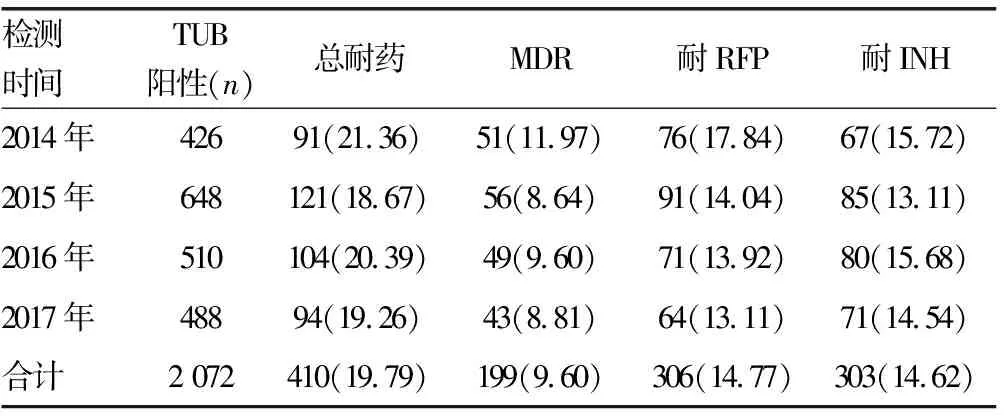
表4 rpoB、KatG及inhA突变相关耐药[n(%)]
3 讨 论
结核菌耐药的主要机制是因为基因突变导致药物作用靶位改变。RFP耐药与rpoB突变有关,其中编码507~533氨基酸位点的81个碱基是其耐药决定区,RFP耐药株中超过95%是在此区域发生突变;MTB对异烟肼产生耐药与katG、inhA、kasA、ndh等多个基因突变有关,约有34.6%~94.3%在katG315位点发生突变,2.9%~21.5%在inhA启动子区域发生突变。LipA法就是通过检测rpoB、katG和inhA突变快捷获得MDR信息,目前已经在临床推广应用。
根据文献资料,湖南[6]、四川[7]和云南[8]地区结核病患者rpoB的突变频率分别为13.09%、28.85%、35.39%,katG的突变频率分别为10.05%、21.19%、30.15%,inhA的突变频率分别为1.55%、3.31%、21.76%,本研究结果与湖南地区一致,但低于云南和四川地区,显示我国不同地域MTB耐药基因突变频率存在差异性。在耐药性方面,本院MTB耐多药率、INH及RFP耐药率低于重庆肺科医院(16.70%、33.20%、32.94%)[9],高于浙江省疑似结核病患者(6.66%、13.24%、9.78%)[10],也高于广西2010~2011年抽样调查的数据(6.28%、12.10%、8.28%)[11],而与广西某结核病治疗医院培养法检测的结果相近(10.97%、17.43%、16.78%)[12],表明结核病定点治疗医院就诊者中难治、复治的患者相对较多,耐药情况相对严重,同时间接说明LipA法用于一线抗结核药物耐药的快速筛查是可行的。本院2 072例结核病患者中有19.79%对一线抗结核药物耐药,对这些感染者如果按照经验性使用国家推荐的标准方案(2H-R-Z-E/4H-R或2H2-R2-Z2-E2/4H2-R2)治疗,结果是无效或是效果不佳,因此对于涂片阳性或MTB-DNA阳性的患者早期进行基因型耐药检测十分必要,这对提高结核病治愈率和控制MDR-TB疫情将有很好促进作用。
本资料中,rpoB 531、katG315位点的突变频率与浙江[10]、湖北[13]和北京[14]地区的报道基本一致;耐RFP株中耐多药占65.03%,提示rpoB突变后进一步转化为MDR的概率高,可以作为诊断MDR-TB的分子标志。已知katG和inhA突变与不同耐药水平相关,katG突变往往显示高水平耐药(>1 μg/mL),inhA突变显示低水平耐药(<1 μg/mL),本研究中katG突变占INH耐药相关突变的82.84%,说明本地区MTB对INH主要呈现高水平耐药。
异质性耐药是指在同一标本中同时存在敏感菌和耐药菌的现象,主要由于敏感和耐药菌株共感染或敏感菌株部分亚群发生耐药突变所致。LipA法检测表现为,当MTB中耐药亚群比例高于其方法学灵敏度时,突变型和野生型基因序列可同时被检出,但表型是否耐药取决于突变与非突变基因序列的比例。本研究中35株表现为“MUT出现并无对应WT缺失”,说明标本中同时存在敏感株和耐药株。因此,对于异质性耐药的患者需要进一步做药敏试验以观察其表型耐药情况,如果菌株暂时保持药物敏感性时,需要持续关注其耐药变化,以便指导及时调整治疗。
结核菌耐药除了基因突变机制外,还有药物外排泵机制、外膜蛋白缺失或数量减少以及其他未知的机制等。LipA法仅检测结核分枝杆菌复合群由 rpoB、katG和inhA 区突变引起的耐药,由其他耐药机制引起的耐药则不能检测。所以LipA法主要适用于MDR-TB快速筛查而不能取代药敏试验。
