丰富环境对大鼠脑缺血再灌注损伤后缺血半暗带区凋亡蛋白的影响*
2019-05-30张继荣
李 敏,陶 陶,张继荣
(1.贵州医科大学/贵州医科大学附属医院康复医学科,贵阳 550001;2.贵州省人民医院康复医学科,贵阳 550002;3.贵州医科大学附属医院康复医学科,贵阳 550001)
脑缺血再灌注(cerebral ischemia-reperfusion,CIR)损伤是一种病理生理复杂的过程,CIR后的致病机制可能与能力衰竭、细胞内Ca2+水平升高、兴奋神经递质释放、氧化应激、炎症等有关。上述机制既相互作用又相互影响,进而促进缺血再灌注(ischemia-reperfusion,I/R)损伤后梗死灶的形成,神经功能的缺失。脑组织损伤后神经细胞表现为坏死和凋亡,凋亡是I/R损伤最重要的形式。丰富环境是一种新奇的康复训练方式,已被应用于基础研究,例如,脑卒中动物神经功能康复训练,并且取得良好的训练效果,但是丰富环境如何使神经功能得以康复的机制却少有研究。近期研究发现,丰富环境能使脑卒中大鼠神经功能得以恢复,考虑与神经元发生凋亡有关;丰富环境可使相关凋亡蛋白表达发生上调或者下调,使得凋亡减少,从而神经功能得以恢复[1-2]。P53是目前公认促进细胞凋亡的因子,其在脑缺血中的表达调控已成为目前缺血神经元死亡机制中的关键环节。本研究对丰富环境下大鼠CIR损伤后缺血半暗带区P53蛋白表达进行研究,现将结果报道如下。
1 材料与方法
1.1材料
1.1.1实验动物与分组 Sprague-Dawley(SD)雄性大鼠,体质量250~280 g,购自贵州医科大学实验动物中心,实验动物生产批号:SCXK(黔)2016-0001。动物使用符合贵州省动物管理委员会管理条例。将大鼠分为假手术组(n=20)、标准环境模型组(n=20)、丰富环境模型组(n=20)。
1.1.2主要试剂 直径18~20 mm的尼龙线栓(北京西浓科技),Solarbio苏木素-伊红(HE)染色试剂盒(索来宝公司),Antin-P53抗体(武汉三鹰),罗丹明(Rhodamine)标记山抗大鼠二抗(北京中杉金桥生物技术有限公司),免疫荧光试剂盒,TRIzol Reagent(Thermo Fisher Scientific),反转录试剂盒RevertAid First Strand cDNA Synthesis Kit(Thermo Fisher Scientific)。rat p53 F-GGC TCC GAC TAT ACC ACT ATC CAC TAC,rat p53 R-TTC TTC CTC TGT CCG ACG GTC TC,rat actin F-TGT CAC CAA CTG GGA CGA TA,rat actin R-GGG GTG TTG AAG GTC TCA AA,FastStart Universal SYBR Green Master(发光),焦碳酸二乙酯(DEPC)水。
1.2方法
1.2.1造模 参照Longa法建立大鼠右侧大脑中动脉栓塞再灌注损伤模型,具体操作如下:腹腔注射麻醉大鼠,仰卧位,取颈部正中切口,钝性分离出右侧颈总动脉、右侧颈内动脉、右侧颈外动脉,在近心端结扎右侧颈总动脉,在颈内动脉起始处放置小动脉夹暂时夹闭血流,在颈总动脉剪一小口插入线栓,放开动脉夹将线栓经颈内动脉轻柔插入(插入深度自颈内动脉分叉处约18 cm),缺血90 min后,再次麻醉大鼠,拔出线栓,缝合颈部切口,即完成大鼠缺血90 min再灌注损伤模型。大鼠苏醒后观察其步态和行为,以判断模型是否制备成功。假手术组线栓不插入大脑中动脉,其余操作与模型组相同。
1.2.2环境设置 标准环境:每只笼子(45 cm×30 cm×20 cm)饲养3只大鼠,予以正常饮食,无玩具饰品等。丰富环境:大小为150 cm×120 cm×80 cm,铁链和秋千悬于笼中,各种小木块及各种带有颜色的小玩具每周更换1次。同时给予声音及昼夜交替光照刺激。
1.2.3改良神经功能缺失(modified neurological deficit score,mNSS)评分 分别在1、28 d对各组大鼠进行mNSS评分,总分为0~18分,分级如下:0~6分为轻度损伤;7~12分为中度损伤;13~18分为严重损伤。分数越高表明行为缺陷更严重。
1.2.4石蜡切片制备 将假手术组、标准环境模型组、丰富环境模型组各个时间点SD大鼠经10%水合氯醛腹腔麻醉后,4%多聚甲醛灌注后断头取脑,4%多聚甲醛固定24 h,然后梯度乙醇脱水,二甲苯透明、浸蜡、包埋、切片。
1.2.5HE染色 取各组各时间点石蜡切片,按照Solarbio HE染色试剂盒说明书进行染色。
1.2.6免疫荧光标记法检测缺血半暗带区中P53蛋白表达 取各组各时间点石蜡切片常规梯度乙醇脱水,0.01 mol/L磷酸缓冲盐溶液(PBS)冲洗3次,每次5 min,柠檬酸盐缓冲液煮沸,将各组各时间点石蜡切片放入其中,微波炉中高温加热20 min,牛血清清蛋白(BSA)封闭液,37 ℃封闭30 min。每张切片滴加一抗(1∶150),湿盒4 ℃避光孵育过夜,次日取出切片,0.01 mmol/L PBS冲洗3次,每次5 min,滴加蓝色荧光二抗,湿盒内避光孵育1 h,滴加抗荧光猝灭剂,盖玻片封片,立即置于荧光显微镜下观察,统计缺血侧梗死灶周边缺血半暗带区200倍视野下荧光阳性细胞数,每张切片取3个互不重叠部位,每份标本取3张切片,用Image J软件分析。
1.2.7实时荧光定量聚合酶链反应(qPCR)检测缺血半暗带区P53 mRNA表达 在各时间点将各组大鼠麻醉后断头取脑,冰面上快速分离出梗死侧大脑半球,进行样品制备,用Trizol法提取RNA,测量RNA纯度,纯度在1.8~2.1即可使用,按照反转录试剂盒实验步骤将RNA反转录为cDNA,取得各组各时间点cDNA,按照50 μL反应体系分别加入反应混合物(ROX)、前后引物序列、DEPC水、cDNA。设置反应qPCR仪反应条件为:预变性95 ℃ 15 min;变性95 ℃ 10 s,退火60 ℃ 15 s,延伸 72 ℃ 20 s,循环40次;溶解曲线阶段95 ℃ 15 s,60 ℃ 1 min。相对基因表达水平为根据ΔCt(ΔΔCt)方法计算如下:目标量=2-ΔΔCt。
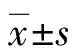
2 结 果
2.1mNSS评分结果 假手术组各个时间点mNSS评分均为0分。在第1天时,标准环境模型组与丰富环境模型组评分比较差异无统计学意义(P>0.05);在第28天时,丰富环境模型组评分(8.00±1.10)分比标准环境模型组(9.83±1.17)分降低(P<0.05)。见图1。
a:P<0.05,与丰富环境模型组比
图1mNSS评分结果
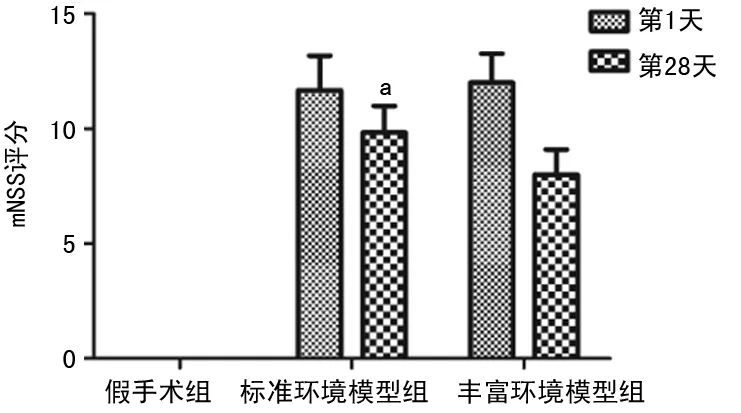
2.2HE染色结果 光学显微镜下见假手术组神经元结构正常,核仁清晰。标准环境模型组大鼠见其梗死侧脑组织疏松,神经细胞数量减少,形态呈三角形或扇形,轴突缺失,胞核固缩,核仁消失。梗死中心区神经元脱失,残存细胞结构不完整;缺血半暗带以神经元固缩为主,未见明显的神经元脱失。丰富环境模型组在CIR 28 d后神经元病理学改变明显减轻,缺血半暗带神经元脱失减轻,周边皮层神经细胞形态趋于正常。见图2。
图2 各组28 d时HE染色病理切片(×200)
2.3免疫荧光标记法测量缺血半暗带区P53蛋白表达结果 假手术组大鼠右侧脑组织皮纹下纹状区见极弱P53蛋白表达的阳性细胞。再灌注第1天时,标准环境模型组缺血侧脑组织梗死灶周边半暗带区出现大量P53阳性细胞,丰富环境模型组同上述表现。再灌注第28天时,标准环境模型组(157.42±0.37)缺血侧脑组织梗死灶周边半暗带区仍有大量P53阳性细胞,但丰富环境模型组(129.43±0.42)缺血侧脑组织梗死灶周边半暗带区P53阳性细胞明显减少。见图3。
2.4qPCR检测缺血半暗带区P53 mRNA表达 假手术组各个时间点P53 mRNA呈极弱表达。再灌注第1天时,标准环境模型组及丰富环境模型组P53 mRNA表达迅速增加;两者相比差异无统计学意义(P>0.05);再灌注第28天时,丰富环境模型组P53 mRNA表达(2.11±0.04)较第1天时明显下降,但标准环境模型组(2.36±0.12)较第1天时未见明显降低,与丰富环境模型组比较,差异有统计学意义(P<0.01)。见图4、5。

图3 各组各时间点P53蛋白阳性细胞(免疫荧光标记法×200)
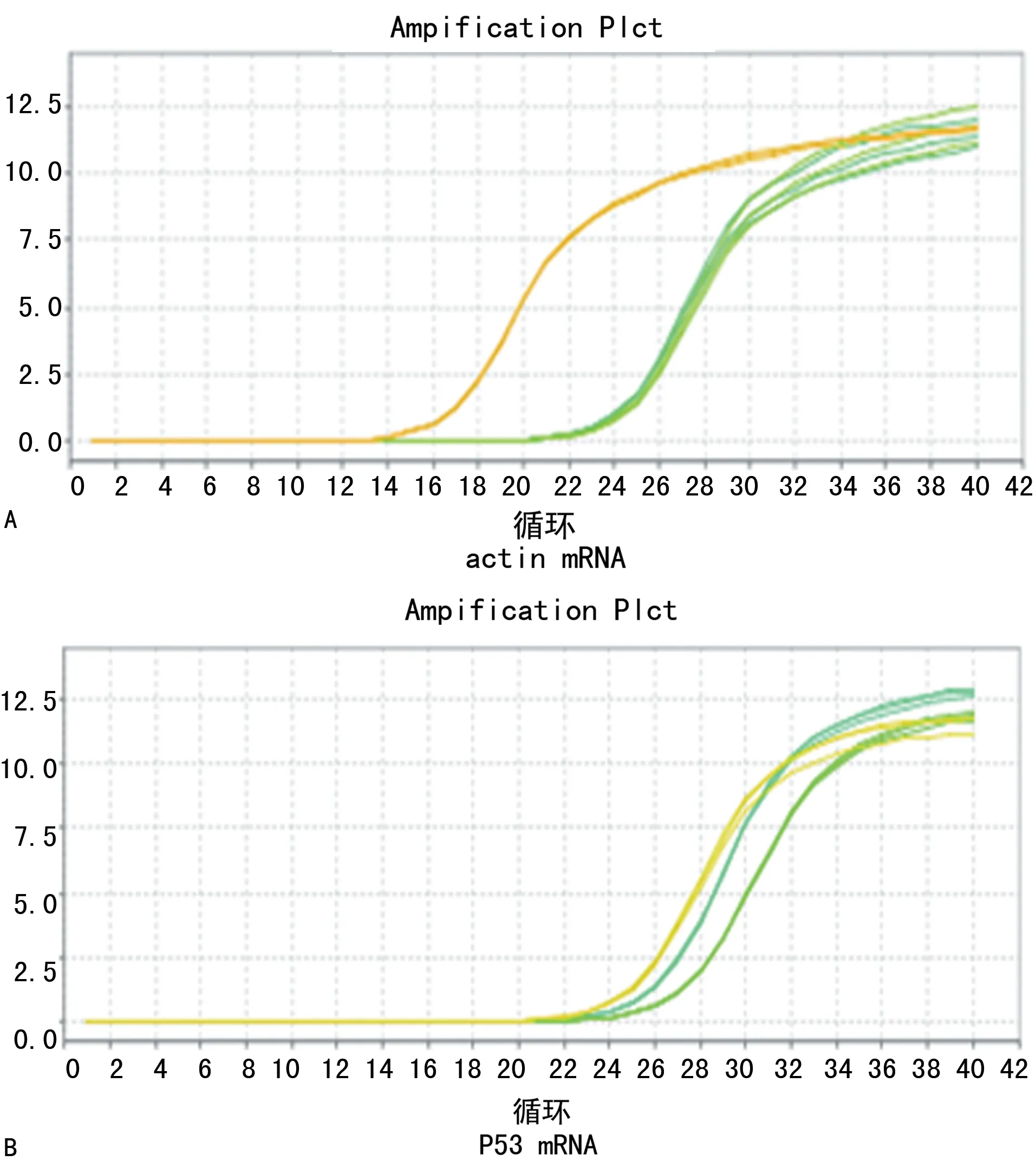
A:actin mRNA溶解曲线图;B:p53 mRNA溶解曲线图
图4各组各时间点所测actinmRNA、P53mRNA
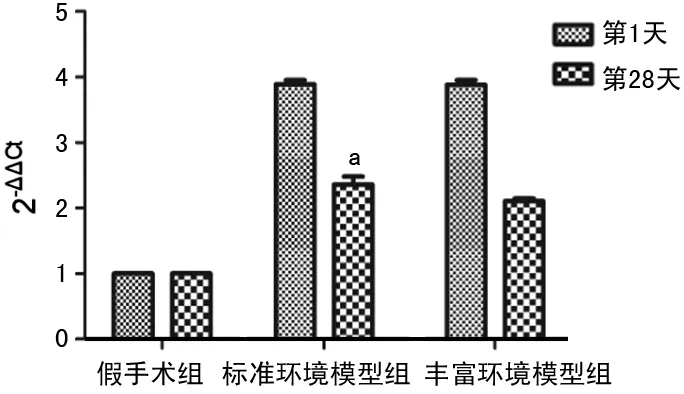
a:P<0.01,与丰富环境模型组比
图5各组各时间点所测P53mRNA表达比较
3 讨 论
丰富环境已经在大量动物模型中显示了对大脑发育和损伤的恢复有好处。与动物研究中的其他康复技术(如约束和特殊肢体训练)不同,丰富环境不同的应用,在于它有利于实验者能够自愿参与周围环境中,且能被无挑战性活动刺激[3]。大部分研究报告将丰富环境应用于卒中后的动物,对动物的神经功能和学习能力有增强的功效[4]。在本次实验中发现,处于丰富环境模型组的大鼠,其神经功能缺损改善情况明显优于标准环境模型组,实验结果与上述大部分研究报告结果交相呼应。越来越多实验证据显示,丰富环境对脑损伤有着神经保护作用和改善神经功能作用,其作用是通过诱导神经发生、增加树突分枝和脊柱密度、促进营养因素的产生和基因表达的变化发挥的[5-9]。CHEN等[1]通过建立中脑动物闭塞(MCAO)模型调查丰富环境治疗对CIR损伤后周围皮质神经元凋亡的影响,显示丰富环境能改善大鼠神经功能,减少大鼠脑组织梗死灶体积,提高神经元存活率,减少神经细胞凋亡,增加Bcl-2蛋白水平,降低Bax、细胞色素C、Caspase-3表达。推测丰富环境治疗可介导线粒体损伤途径调控细胞凋亡。
P53是目前公认促进细胞凋亡的因子。P53促进细胞凋亡机制主要以转录非依赖信号途径为主,而非依赖信号途径最主要的是线粒体途径。在细胞质中的P53转录非依赖活性是通过抑制抗凋亡蛋白Bcl-2和Bcl-xl或激发促凋亡蛋白Bax引发细胞凋亡。这个机制正好与CHEN等[1]的研究相似。P53在脑缺血中的表达调控已成为目前缺血神经元死亡机制中的关键环节。去除P53基因的脑缺血大鼠,神经细胞凋亡显著减少,进一步证实了P53蛋白在调控脑缺血后神经细胞凋亡的重要作用[10]。有实验证实,通过运动预处理的CIR动物模型中P53的表达受到抑制,从而发挥其脑神经保护作用[11]。徐坚等[12]研究发现,天麻及电针治疗能够抑制或延迟P53蛋白的表达途径,使缺血半暗带区神经细胞凋亡降低,以便改善局部缺血缺氧、改善微循环,使脑I/R损伤程度降低。在本实验mNSS评分结果得出,丰富环境可以改善I/R损伤后大鼠神经功能缺失症状。通过免疫荧光及qPCR结果可以看出,丰富环境可使缺血半暗带区P53表达下降,与徐坚等[12]实验结果一致,运动预处理、电针均属于康复方式,丰富环境也是一种新兴的康复训练方式,积极康复训练均可使I/R损伤大鼠神经功能得到改善。从微观促凋亡因子P53表达到大鼠神经功能改善情况,可以大胆推测,I/R损伤后大鼠神经功能改善可能与丰富环境干预大脑缺血半暗带区促凋亡因子P53表达有关。
本实验探讨丰富环境对SD雄性大鼠CIR损伤后的神经功能缺失症状、脑组织内P53表达随干预时间延长的变化,结果显示丰富环境对脑组织低氧应答起保护作用,为临床上应用丰富环境治疗缺血性脑卒中提供了理论依据。
