血管结构对椎动脉支架术后再狭窄的影响研究
2019-05-30李景植华扬刘然田晓洁焦力群
李景植 华扬 刘然 田晓洁 焦力群
病因学分析指出,缺血性卒中占所有卒中事件的80%,后循环卒中约占20%,而椎动脉起始段狭窄(vertebral artery ostium stenosis,VAOS)是后循环缺血性卒中事件的主要原因[1]。临床对于VAOS治疗的基本方案是抗血小板聚集或抗凝治疗,强化药物治疗后仍发生后循环缺血症状的患者,应考虑血运再通治疗[2],包括开放性手术治疗、血管内球囊扩张术及支架置入术[3]。支架置入术以其创伤性小、操作安全性高及治疗的相对有效性,已成为现阶段治疗VAOS的主要手段之一[4]。大样本临床研究证实,支架置入术的手术成功率高达99%~100%[5-7]。然而,支架置入术后支架内再狭窄(in-stent restenosis,ISR)的发生率较高,ISR发生率的相关报道存在明显的差异[2,8-9]。本研究通过彩色多普勒超声(color Doppler ultrasonography,CDUS)对VAOS患者支架置入术后进行定期随访监测,分析目标椎动脉的血管结构及相关临床信息,拟探讨VAOS支架置入术后发生ISR的影响因素。
1 对象与方法
1.1 对象
回顾性连续纳入2013年1月至2014年12月首都医科大学宣武医院神经外科椎动脉起始段重度狭窄行支架置入术的患者400例(2例存在双侧病变),排除临床资料、影像检查信息及术后随访资料不全者75例,最终本研究共纳入325例患者。所有患者均经常规CDUS检查诊断,并经DSA证实为椎动脉起始段重度狭窄(狭窄率≥70%)。325例患者中,男273例,女52例;年龄38~84岁,平均(65±9)岁;左侧165例,右侧160例;糖尿病102例(31.4%),高血压病212例(65.2%),高脂血症137例(42.2%),吸烟200例(61.5%);后循环症状309(95.1%),后循环脑梗死92(28.3%)。根据是否发生ISR,将325例患者分为ISR组(116例)和无ISR组(209例)。ISR组中男102例,女14例;年龄42~84岁,平均(66±9)岁;左侧65例,右侧51例。无ISR组中男171例,女38例;年龄38~82岁,平均(65±9)岁;左侧100例,右侧109例。两组患者性别、年龄及椎动脉起始段重度狭窄侧别的差异均无统计学意义(均P>0.05),具有可比性。本研究方案经首都医科大学宣武医院伦理委员会批准,患者或其家属签署了诊治知情同意书。
1.2 纳入及排除标准
1.2.1 纳入标准:(1)年龄30~80岁;(2)术前CDUS诊断为VAOS重度狭窄(狭窄率≥70%)[10],并经DSA证实;(3)对动脉粥样硬化的一般危险因素如高血压病、糖尿病、高血脂症及吸烟的界定均参照文献[11]标准。
1.2.2 排除标准:(1)术前或术后1周内未行CDUS或DSA检查;(2)合并患侧锁骨下动脉重度狭窄或闭塞;(3)合并心源性疾病;(4)放疗术后的血管狭窄;(5)二次支架介入治疗;(6)随访资料不完整;(7)联合锁骨下动脉、椎动脉支架置入治疗。
1.3 支架置入术
DSA检查与支架置入术均在Neurostar Plus/TOP双C臂血管造影系统(Siemens, Munich,德国)下进行。通过6 F导引导管定位在第3颈椎至第4颈椎水平的靶向椎动脉。在微导丝引导下,将球囊安装支架通过病变定位并释放后,复查DSA观察颅内椎动脉血供的改善。置入支架的类型包括Apollo(微创医疗科学有限公司,中国)、 Endeavor(美敦力公司,爱尔兰)、Firebird2 (微创医疗科学有限公司,中国)、Palmaz Blue (Cordis Corp.Oosteinde LJ Roden,荷兰)、Xience V (雅培公司,美国),根据治疗类型分为药物洗脱支架(drug eluting stent,DES)和金属裸支架(bare metal stent,BMS)。根据术前椎动脉走行,依据既往研究报道,椎动脉起始段走行弯曲包括走行起伏、弯折、卷曲,其中走行起伏分类为“S”“C”或“Z”形[12]。支架置入术后椎动脉形态学的改变由两名医师对DSA图像分别进行评定并取得一致结论。支架置入术后患者均在临床医师的指导下,规律进行抗血小板聚集药物治疗,即阿司匹林100 mg/d+氯吡格雷75 mg/d(BMS至少3个月,DES至少6个月),之后采用一种药物长期服用[5]。
1.4 CDUS监测
分别采用美国Philips公司生产的IU-Eilite及日立公司生产的HI VISION Ascendus超声诊断仪,前者为3.0~9.0 MHz线阵探头及2.0~5.0 MHz凸阵探头;后者为4.0~8.0 MHz微凸探头及1.0~5.0 MHz凸阵探头。检查并记录术前患侧VAOS段的残余管径、原始管径、收缩期峰值流速(PSV)、舒张期末流速(EDV)及椎间隙段(第4颈椎至第5颈椎间或第3颈椎至第4颈椎间)的PSV、EDV。嘱患者分别于术后1 d、3个月、6个月、12个月及此后每年规律行CDUS复查随访。随访终止时间为2018年12月31日。随访时测量并记录支架的血流动力学参数,具体内容与术前CDUS评估指标一致。为分析椎动脉的扩张程度对ISR的影响,计算椎动脉术后血管内径与术前原始内径之比(血管扩张比)。
1.5 终点事件
所有患者进行临床与CDUS复查联合随访。主要终点事件为出现新发后循环卒中、心肌梗死及死亡。对于出现主要终点事件者,详细记录发生的时间及相关临床资料以供进一步分析。次要终点事件:随访期内出现ISR(狭窄率≥50%),再狭窄定义为支架内PSV≥170 cm/s,狭窄段EDV≥45 cm/s,狭窄段PSV/椎间隙段PSV≥2.7[12]。记录ISR确诊时间及患者随访期内出现与ISR相关的后循环缺血事件,如眩晕、平衡障碍、复视等后循环症状或后循环脑梗死[12]。对于所有患者是否出现终点事件以在随访期内最后一次随访时的结果进行认定。
1.6 统计学分析
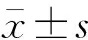
2 结果
2.1 一般资料比较
两组椎动脉起始段重度狭窄行支架置入术患者年龄、性别、重度狭窄侧别、糖尿病、高血压病、吸烟史、后循环症状、后循环脑梗死的组间差异均无统计学意义(均P>0.05)。见表1。325例患者中位随访时间为14(6,38)个月,其中ISR占35.7%(116例),症状性ISR发生率为2.5%(8例),主要表现为头晕;应用DES和BMS分别为173例(53.2%)和152例(46.8%);目标椎动脉存在血管走行弯曲者105例(32.3%),术后形态改变者76例(23.4%)。
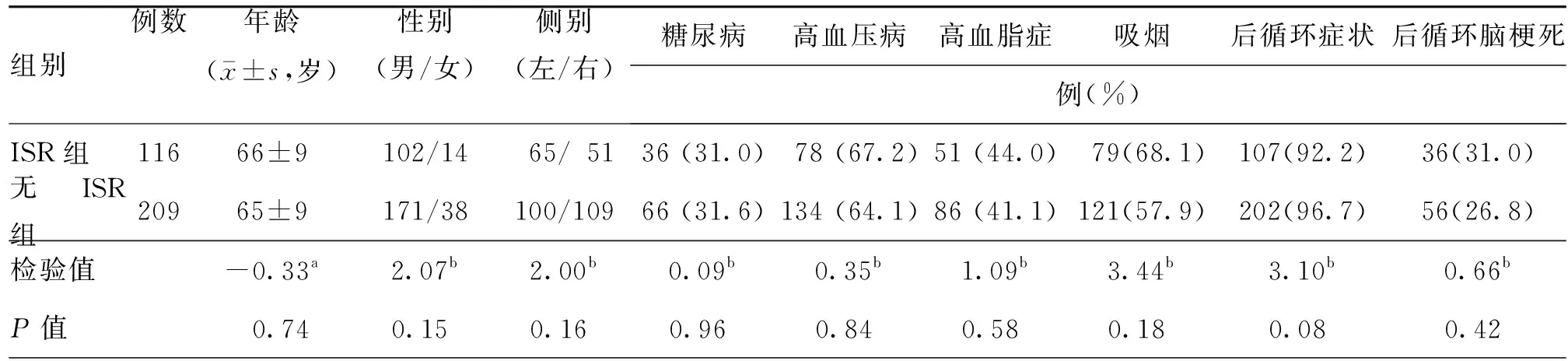
表1 两组椎动脉起始段重度狭窄行支架置入术患者一般资料比较
注:ISR为支架内再狭窄;a为t值,b为χ2值
2.2 支架资料比较
两组支架类型的差异有统计学意义(P<0.01);ISR组使用支架的内径大于无ISR组,组间差异有统计学意义(P<0.05);两组使用支架长度的差异无统计学意义(P>0.05)。见表2。
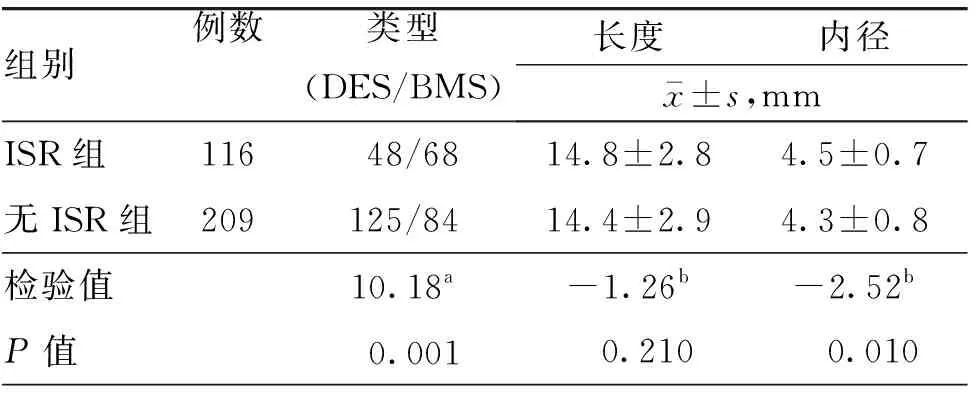
表2 两组椎动脉起始段重度狭窄行支架置入术患者支架资料比较
注:ISR为支架内再狭窄,DES为药物洗脱支架,BMS为金属裸支架;a为χ2值,b为t值
2.3 病变椎动脉结构特征比较
325例患者中,椎动脉走行弯曲发生率为32.3%(105例)。ISR组椎动脉存在血管走行弯曲者比例及支架置入术前椎动脉原始内径均大于无ISR组,组间差异均有统计学意义(均P<0.05);余椎动脉结构特征的组间差异均无统计学意义(均P>0.05)。见表3。
2.4 椎动脉起始段重度狭窄行支架置入术后发生ISR的多因素Cox逐步回归分析
将单因素分析结果中P<0.1的支架资料和病变椎动脉结构特征参数进行多因素Cox逐步回归分析,结果显示,使用DES是VAOS支架术后ISR的保护因素,目标椎动脉走行弯曲是VAOS支架术后ISR的危险因素(均P<0.05);术后血管内径与术前原始内径之比与发生ISR无明显相关性(P>0.05)。见表4。
2.5 椎动脉起始段重度狭窄患者不同类型支架置入术后发生ISR的生存曲线分层分析
根据单因素及多因素Cox逐步回归分析结果,对血管走行弯曲者的ISR累积发生率进行了Kaplan-Meier生存曲线分析,结果显示,使用BMS的椎动脉走行弯曲者ISR累积发生率的差异无统计学意义(Log-rankχ2=1.72,P=0.19,图1a),使用DES的椎动脉走行弯曲者ISR累积发生率的差异有统计学意义(Log-rankχ2=8.62,P=0.003,图1b)。


表3 两组椎动脉起始段重度狭窄行支架置入术患者病变椎动脉结构特征比较
注:ISR为支架内再狭窄;a为χ2值,b为t值
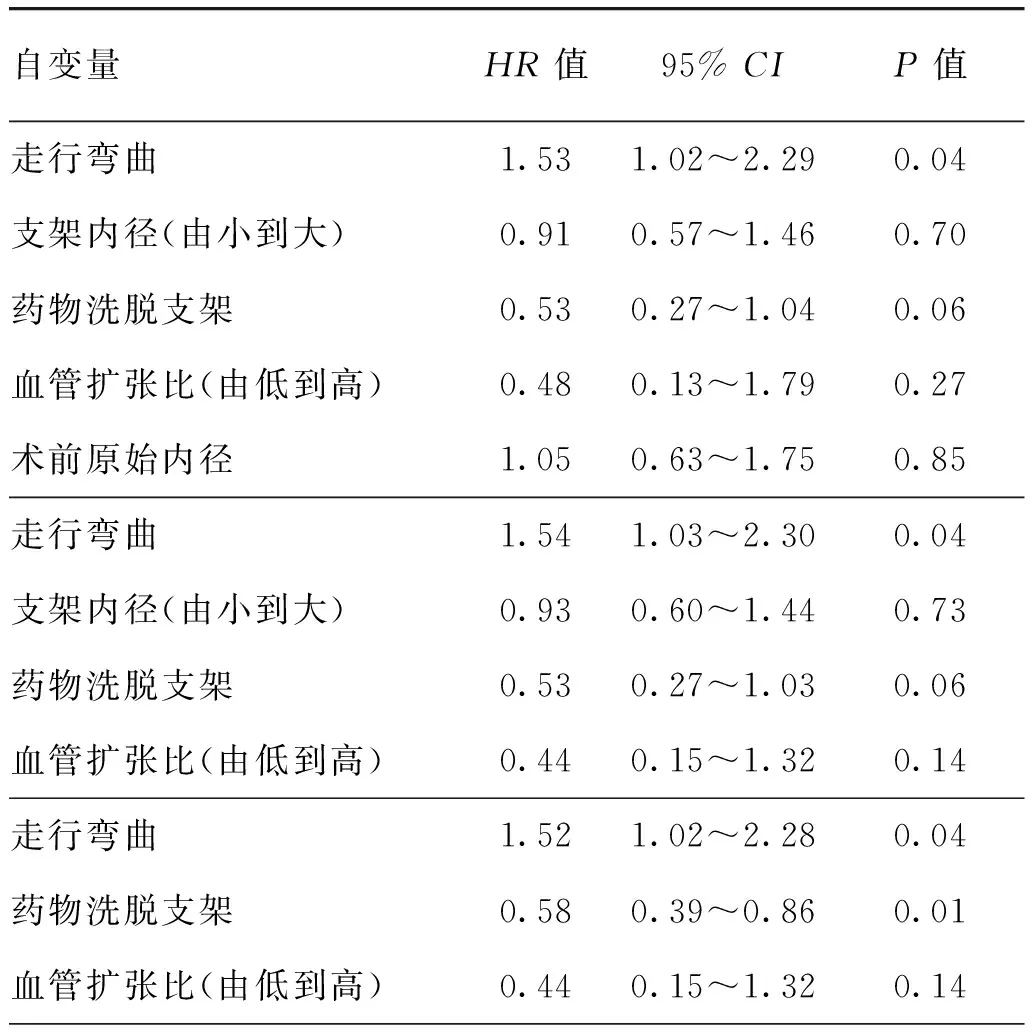
表4 椎动脉起始段重度狭窄行支架置入术后发生支架内再狭窄的多因素Cox逐步回归分析
3 讨论
本研究对VAOS患者支架置入术后ISR发生率进行分析表明,目标椎动脉走行弯曲是发生ISR的独立危险因素,且目标椎动脉走行弯曲对DES置入术后ISR的影响更为明显。
冠状动脉的生理特性、结构与椎动脉类似。因此,现阶段对于VAOS支架置入术主要采用冠状动脉支架系统,即球囊扩张支架系统[3]。早期球囊扩张支架均为BMS,但多项研究报道了应用BMS治疗VAOS远期的ISR发生率过高,使得研究者开始质疑支架置入术的远期疗效[13-16]。随着21世纪初DES的出现,有研究开始尝试应用DES治疗VAOS[17]。随后,多项临床研究结果证实,应用DES可有效减少远期ISR的发生率[5,18-21]。本研究两组使用支架类型的差异有统计学意义(P<0.01),且使用DES是VAOS支架术后ISR的保护因素,可有效减少ISR的发生,与上述研究结果基本一致。但需要指出的是,本研究同既往的研究均为回顾性研究,因此,对于应用DES可减少VAOS支架置入术后远期ISR的发生仍需大样本、前瞻性随机对照研究进一步证实。
既往研究报道,椎动脉起始段走行弯曲发生率为33.8%~47.2%[8],本研究结果显示为32.3%(105/325),与文献报道相似。ISR组椎动脉存在血管走行弯曲者比例大于无ISR组,组间差异有统计学意义[42.2%(49/116)比26.8%(56/209),P<0.05],进一步行多因素Cox逐步回归分析显示,目标椎动脉走行弯曲是VAOS支架术后ISR的危险因素(OR=1.52,95%CI:1.02~2.28,P=0.04),与既往研究结论一致[12]。分析其原因可能与以下因素有关:(1)在进行血管成形术和支架置入术的操作过程中,弯曲的椎动脉更容易受损伤,继发成纤维细胞和内膜过度增生是导致ISR的重要因素之一[18]。(2)椎动脉走行弯曲者行支架置入术通常会将起始段弯曲非自然性矫直,而增加支架置入后动脉的回缩力,导致发生ISR的风险增加。基于该假设,本研究通过椎动脉术后形变对ISR影响的分析表明,ISR组与无ISR术后椎动脉形态改变的差异无统计学意义(P=0.290)。分析该结果的原因可能在于本研究中对支架术后目标椎动脉的形变为回顾性定性变量,并未采用可量化的指标对术后形变大小进行统计分析。因此,今后可通过探讨可量化的形变指标进行进一步探讨。
然而,本研究通过多因素Cox逐步回归分析表明,支架的类型和椎动脉走行弯曲均为ISR的影响因素。进一步通过Kaplan-Meier分层统计分析的结果表明,DES患者中椎动脉走行弯曲是ISR发生的危险因素。既往冠状动脉支架相关文献报道指出,冠状动脉走行弯曲是药物涂层支架断裂的重要因素之一[19-21]。此外,Tang等[9]对56例VAOS患者行DES置入术后平均随访28个月,结果表明,椎动脉扭曲与支架断裂明显相关。同时,有研究描述了DES断裂的高发生率可能是导致ISR的主要因素[22-23]。因此,本研究证实椎动脉走行弯曲是DES置入术后再狭窄的危险因素,其原因可能与椎动脉走行弯曲增加了DES断裂的风险有关,但该结果仍需要大样本的临床试验进一步验证。
Zheng等[24]与Chen等[25]均于2018年发表了置入支架的内径是ISR的影响因素且较小支架内径会增加ISR的风险。本研究结果显示,ISR组置入的支架内径大于无ISR组(P=0.010),与之前的文献报道结果不一致。并且,本研究通过测量椎动脉原始内径,证实ISR组的原始内径大于无ISR组,组间差异具有统计学意义(P=0.010)。
既往对于置入支架的技术性研究报道,选择合适的支架内径和大小是VAOS支架置入术成功的必要条件[3]。本研究中,所用置入支架的规格均由经验丰富的临床医师根据病变的特点进行选择,从支架内径、目标椎动脉原始内经的组间统计结果证实所选支架内径与病变特征相对匹配,随访结果也表明,支架内径并非ISR的影响因素。
术后血管内径与术前原始内径之比在一定程度上反映了支架扩张与目标椎动脉内径的匹配程度,为进一步研究目标血管内径对ISR的影响,本研究采用超声监测获得的术后血管内径与术前原始内径之比进行统计学分析表明,ISR组与无ISR组术后血管内径与术前原始内径之比(血管扩张比)的差异无统计学意义(P>0.05)。分析该结果的原因可能由于椎动脉起始段的解剖位置较深,尤其左侧更为显著,采用超声检测椎动脉的原始内径在技术操作上存在一定的难度,可能存在测量误差。因此,术后血管内径与术前原始内径之比对于支架置入术后ISR的影响仍需进一步采用更精确的测量方法进行研究。
综上,本研究长期随访观察显示, DES可有效减少VAOS支架置入术后ISR的发生,且椎动脉走行弯曲是支架置入术后ISR发生的危险因素。因此,对存在椎动脉走行弯曲的VAOS患者的支架选择提供了重要的临床依据。
