紫苏茉莉酸羟基甲基转移酶基因PfJMT的克隆及表达分析
2019-05-28白辉扬鲁庚陆俊杏管丽唐鑫张涛
白辉扬,鲁庚,陆俊杏,管丽,唐鑫,张涛
(重庆师范大学生命科学学院,重庆401331)
0 引言
【研究意义】JA及其衍生物MeJA是植物防御以及多种发育过程(如种子萌发、开花、果实发育和衰老)的重要细胞调节剂[1-3]。JMT是MeJA生物合成的关键酶,负责将JA甲基化为MeJA[4]。通过对JMT表达模式的研究,对植物防御和植物发育的调控,以及进一步利用JMT改良作物品种具有重要意义。【前人研究进展】茉莉酸起源于α-亚麻酸,在质体中经脂氧合酶(lipoxygenase,LOX)氧化,然后通过丙二烯氧化物合酶(allene oxide synthase,AOS)和丙二烯氧化物环化酶(allene oxide cyclase,AOC)转化为12-氧代植二烯酸(12-OPDA),再转运到过氧化物酶体,最后经过3次β氧化形成茉莉酸[5-7]。JA有多种代谢途径,通常经JMT甲基化产生MeJA或者通过茉莉酸共轭合酶(JA conjugate synthase,JAR1)与氨基酸(如异亮氨酸)缀合,形成高生物活性的茉莉酸异亮氨酸共轭物(jasmonoyl-isoleucine,JA-Ile)[8]。茉莉酸及其衍生物是拟南芥[9]和番茄[10]花发育的最后阶段所必需的,STITZ等[11]对烟草开花的研究中也发现茉莉酸及其衍生物对开花起调控作用,JMT可以通过调节茉莉酸相关代谢物的水平参与此过程。SEO等[4]从拟南芥中克隆获得AtJMT,发现过表达AtJMT增强了拟南芥对灰霉病菌的抗性。WU等[12]研究发现,MeJA处理引发的抗性不是由MeJA直接引起,而是由其去甲基化产物 JA所引起。STITZ等[13]在烟草中过表达AtJMT并沉默了烟草甲基茉莉酯酶基因(methyl jasmonate esterase,MJE),发现在伤口处理后,这种突变体(35S-jmt/ir-mje)未能出现和野生型一样的JA,JA-Ile的上调,而是被一系列内源性MeJA取代,结果导致在总茉莉酸(Jas)水平没有差异的情况下,苏氨酸脱氨酶和胰蛋白酶抑制剂(2种JA诱导的防御基因)的表达均显着降低。QI等[14]对水稻OsJMT的研究发现,OsJMT通过介导JA和相关代谢物的水平,在水稻的生长和防御中起作用,MeJA可能是调节植物生长发育而非防御的信号,而 JA和其他信号,如JA-Ile可能主要介导防御。并且发现过表达OsJMT会显著降低穗长、每穗颖花数和结实率,导致单株产量减少,但千粒重有所提高。在过去对JMT的研究报道中,过表达JMT通常会导致植物种子减产。如在拟南芥中,CIPOLLINI等[15]过表达AtJMT导致拟南芥种子重量和数量的减少。KIM等[16]在水稻中过表达AtJMT,也导致了谷粒产量和幼苗高度的降低。但有趣的是,过表达JMT却会使块茎类作物增产,如SOHN等[17]在马铃薯中过表达AtJMT,导致马铃薯的块茎产量和大小的增加,并且JMT的表达水平越高,块茎的产量也越高。而KIM等[18]在人参中过表达AtJMT也导致人参根系生长和人参皂苷异质性的刺激。NAM 等[19]对过表达AtJMT大豆种子进行评估,发现转基因大豆的各成分均在商业上可获得的大豆参考范围内,从而证明了这些转基因和非转基因大豆种子的实质等同性。以上研究表明,JMT可能间接参与植物防御反应以及在种子和块茎发育过程中起着重要作用,且具有一定的商业应用前景。【本研究切入点】紫苏含有丰富的MeJA合成前体α-亚麻酸,是研究α-亚麻酸代谢途径中JMT功能较好的植物[20-21]。之前均是对JMT在植物防御中作用的研究,而关于JMT在种子发育中的研究鲜有报道。【拟解决的关键问题】本文通过对紫苏各组织包括不同发育时期种子中JMT表达的研究,揭示PfJMT在紫苏种子发育中的表达模式。并使用外源MeJA和SA处理植物,研究PfJM在不同胁迫中的表达模式。为解决过表达JMT对植物种子产量的影响提供参考,验证JMT在植物防御反应中的作用。
1 材料与方法
1.1 材料
紫苏种子由重庆师范大学油用牡丹种质资源创新与利用重点实验室保存。大肠杆菌DH5α、Premix Taq酶、DL2000Maker、T/A克隆载体pGEM-T、T4 DNA连接酶、逆转录试剂盒均购于TaKaRa公司。EASYspin植物RNA快速提取试剂盒(DNaseⅠ)购于北京博迈德公司。荧光定量试剂盒购于成都百乐公司。
2018年4月将紫苏种子播种于重庆师范大学生命科学学院实验基地,取开花期的根、茎、叶、花等组织,并取开花后5、10、15、20、25和30 d的种子,液氮速冻后,-80℃保存备用。2018年 7月,用 25µmol·L-1MeJA[22]和 1 mmol·L-1SA[23]喷洒处理种植于花盆中具有4片真叶的紫苏幼苗,并浇灌根部,分别取处理0、2、4、8、16、24和48 h后的紫苏根、叶组织,液氮速冻后,-80℃保存备用。
1.2 PfJMT的克隆
采用 CTAB法提取紫苏种子 DNA,利用植物总RNA试剂盒提取紫苏各组织 RNA,并反转录为cDNA,-20℃保存备用(所有操作都严格按照说明书进行)。根据紫苏种子转录组测序结果[24],设计PfJMT引物(PfJMT-F:5′-ATGGAAGTAGTACAAGTACT-3′,PfJMT-R:5′-TTATCTCCTGGTCAACGAAACG-3′)。分别以紫苏DNA和种子cDNA为模板进行PCR扩增,将胶回收产物与pGEM-T载体连接,转化,筛选阳性单克隆测序。引物合成和测序均由英潍捷基有限公司完成。
1.3 PfJMT的生物信息学分析
利用NCBI在线工具BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对PfJMT的氨基酸序列进行比对分析。使用 Vector NTI系列软件进行序列分析,查找ORF、翻译成氨基酸序列等。使用 ExPASy(https://www.expasy.org/)分析PfJMT蛋白的分子量、等电点pI、疏水性等。用 SignalP4.1(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽,用 TMHMM Server v.2.0(http://www.cbs.dtu.dk/ services/TMHMM/)分析跨膜区,利用 Softberry(http://linux1.softberry.com/berry.phtml)预测亚细胞定位。使用CDD(www.ncbi.nlm.nih.gov/Structure/cdd/ wrpsb.cgi)分析其保守结构域。使用软件DNAMAN进行多序列比对分析。采用邻接法,利用MEGA7.0软件对不同物种的JMT蛋白构建系统进化树。
1.4 PfJMT的表达分析
根据已克隆获得的紫苏PfJMT的ORF序列,设计qRT-PCR引物(PfJMT-RT-F:5′-CAACGTGGCGAA ATGCATGA-3′,PfJMT-RT-R:5′-TCTCCTGGTCAA CGAAACGG-3′),扩增产物大小为166 bp。分别以紫苏各组织cDNA为模版,以紫苏18S为内参(18S-F:5′-CGGCGACGCATTCAAA-3′,18S-R:5′-GCTGCCT TCCTTGGATGTGG-3′)。qRT-PCR检测PfJMT在不同组织器官中的表达水平,重复 3次。试验结果用SPSS 13软件进行统计分析,当P<0.05时,统计结果具有统计学意义。柱形图用Origin7.0进行绘制。
2 结果
2.1 PfJMT的克隆和生物信息学分析
在紫苏种子转录组测序结果中发现一个紫苏JMT,经分析发现该序列具有完整的ORF。根据紫苏JMT序列设计引物,分别以紫苏DNA和种子cDNA为模板,克隆获得紫苏JMT序列,将其命名为PfJMT(图1-A)。PfJMT具有3个外显子和2个内含子(图1-B),ORF为1 050 bp,编码349个氨基酸。PfJMT预测蛋白分子量为39.4 kD,pI为5.79,带负电荷的氨基酸(Asp+Glu)为 43个,带正电荷的氨基酸(Arg+Lys)为 36个,不稳定系数为 53.95,属于不稳定蛋白。平均亲水性(GRAVY)为-0.137,属于亲水性蛋白。预测PfJMT蛋白无信号肽,无跨膜域,定位于细胞质。PfJMT含有一个甲基转移酶-7(Methyltransf-7)结构域(图1-C)。
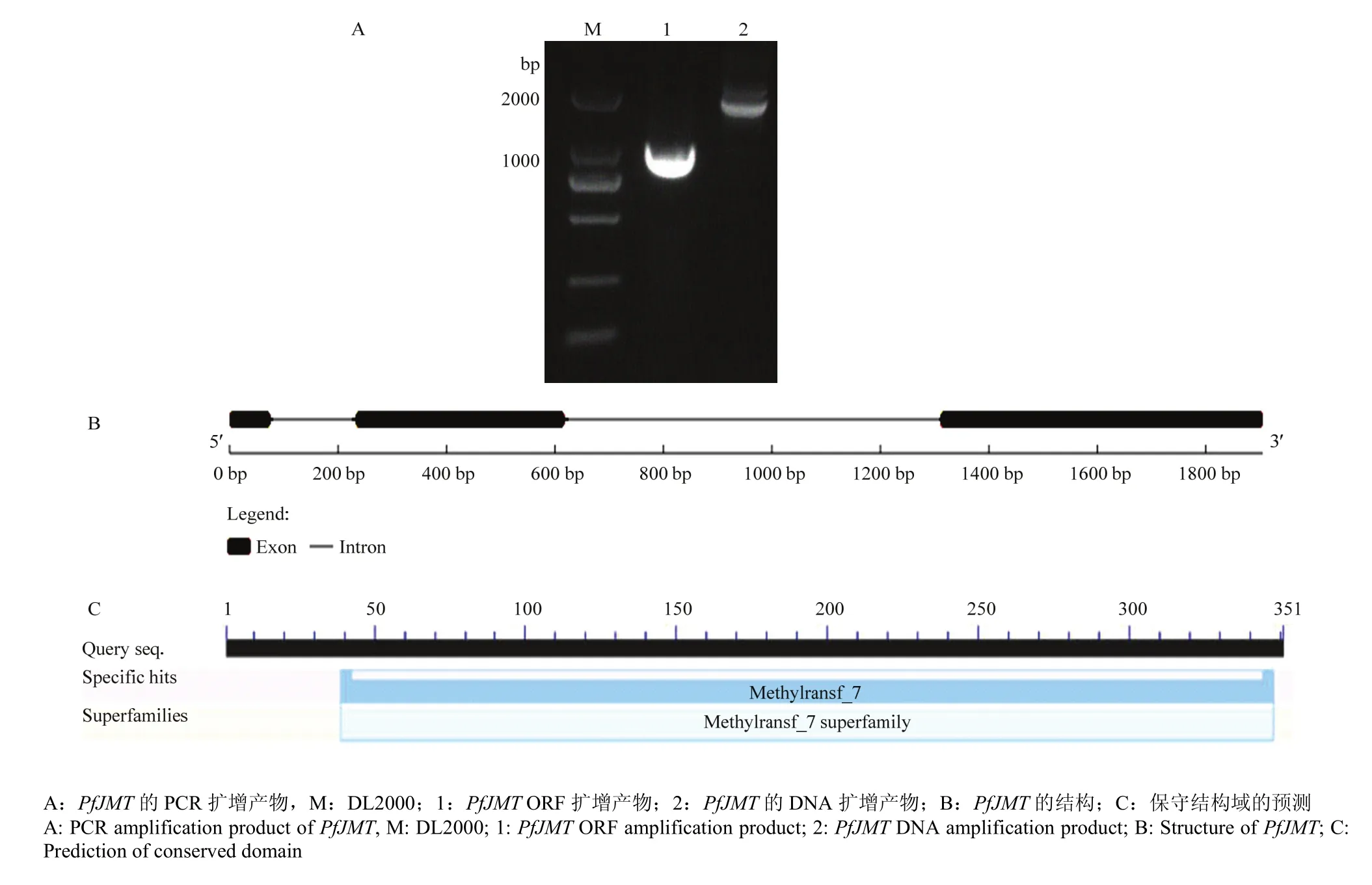
图1 PfJMT的克隆与分析Fig. 1 Cloning and analysis of the PfJMT
2.2 PfJMT的聚类分析
通过比对紫苏、棉花Gossypium hirsutum(AJQ31847.1)、可可Theobroma cacao(EOY14822.1)、蓖麻Ricinus communis(XP 002510424.1)、拟南芥Arabidopsis thaliana(AEE29876.1)、向日葵Helianthus annuus(OTG00826.1)、青蒿Artemisia annua(AIN76708.1)、建兰Cymbidium ensifolium(AFH89623.1)、丹参Salvia miltiorrhiza(APC65704.1)、蒺藜苜蓿Medicago truncatula(XP 003638267.1)和水稻Oryza sativa Japonica Group(XP_015639512.1)的JMT序列。发现PfJMT与丹参的氨基酸序列相似度最高,为80.5%;与水稻的序列相似度最低,为36.8%(表1)。使用DNAMAN对其中5个物种的JMT进行多序列比对,发现1个保守基序的部分位置用方框标注(图2),这段基序存在于甲基转移酶-7结构域中,可能与JMT的功能密切相关。
使用DNAMAN对其中5个物种的JMT进行多序列比对,发现1个保守基序的部分位置用方框标注(图2),这段基序存在于甲基转移酶-7结构域中,可能与JMT的功能密切相关。
2.3 PfJMT与其他物种的系统进化树分析
使用MEGA7.0对这11个物种的JMT构建进化树(图 3),发现紫苏和丹参亲缘关系最近,其次与棉花、可可、蓖麻、拟南芥等双子叶植物亲缘关系较近,与建兰和水稻2个单子叶植物的亲缘关系较远。表明 JMT在单子叶和双子叶植物的进化过程中可能存在较大的差异。
2.4 PfJMT的实时荧光定量分析
通过对紫苏不同组织和不同处理中PfJMT的qRT-PCR分析,结果表明PfJMT在紫苏各组织中均有表达。其中,根和茎中的相对表达量最低,叶和花中的表达量比根和茎中略高,幼嫩种子中的表达量最高。在不同发育时期的种子中,开花后5 d的种子表达量最高,且随着种子的发育,PfJMT的表达量逐渐下调(图4)。在用外源MeJA、SA处理后的紫苏根、叶中,PfJMT的表达和对照相比,均显著下调(图5)。

图2 不同植物JMT的多序列比对分析Fig. 2 Multiple sequence alignment analysis of different plant JMT

表1 不同植物JMT蛋白一致率Table 1 Protein identities of JMT in different plants (%)

图3 不同植物基于JMT氨基酸序列的系统进化树Fig. 3 Phylogenetic tree of different plants based on amino acid of JMT

图4 PfJMT在不同组织和种子不同发育时期的相对表达量Fig. 4 The relative expression of PfJMT in different tissues and seeds at different developmental stages

图5 MeJA和SA处理对PfJMT表达的影响Fig. 5 Effect of MeJA and SA treatment on PfJMT expression
3 讨论
3.1 JMT在不同植物中的保守性较低
本试验根据紫苏种子转录组测序结果设计引物克隆获得PfJMT。生物信息学分析表明,PfJMT蛋白由349个氨基酸组成,pI为5.79,属于不稳定的亲水蛋白,定位于细胞质,与水稻、棉花JMT的亚细胞定位一致[14,25]。保守功能结构域分析发现,PfJMT含有一个甲基转移酶-7结构域,是一种依赖S-腺苷-蛋氨酸(S-adenosyladenyl-L-methionine,SAM)的甲基转移酶,属于SABATH甲基转移酶家族[26-27]。序列比对分析发现,JMT在不同植物中序列差异较大(表 1)。系统进化树分析发现,来自单子叶植物和双子叶植物的JMT亲缘关系较远。因此,来自不同植物的JMT在功能上保守,在序列上不保守。
3.2 JTM主要在植物发育而非防御反应中发挥作用
组织特异性表达分析发现,PfJMT在紫苏开花期各组织中均有表达,在花和叶中的相对表达量高于根和茎,在开花后5 d的种子中具有最高的表达量,并且随着种子的发育表达量逐渐降低,这与转录组测序的结果相一致[24]。而在拟南芥中,AtJMT只在莲座叶、茎生叶和花中表达,而在根、茎、角果中不表达[4]。
茉莉酸途径和水杨酸途径在植物防御反应中发挥着重要的作用,通常JA途径主要介导对食草动物以及坏死性病原体的抗性,SA途径主要介导对生物营养型病原体的抗性[28-30]。JA途径和SA途径存在拮抗作用,这是植物长期在各种生物和非生物胁迫中,为了生存而精确分配有限的资源来适应环境的结果[31]。先前研究证明了 MeJA处理引起的抗性不是由MeJA直接引起的,而是由其去甲基化产物JA引起的[12]。本研究在使用外源MeJA和SA处理后的紫苏叶和根中,发现JMT表达均显著下调,该结果与 MeJA不直接参与防御反应的理论相符,但不同于使用SA处理导致水稻OsJMT表达既有上调又有下调的结果,这可能是由于我们使用过量的 MeJA和SA处理所致。MeJA处理后JMT表达下调可能是一种反馈调节,也可能是MeJA作为一种信号分子,在接受到这种信号后,植物为了响应JA途径而下调JMT的表达,并将MeJA去甲基化形成JA参与到后续的防御反应中。而SA处理,抑制了JA途径,JMT的表达也随之降低。以上结果表明,JMT主要在植物发育(如种子发育)中发挥重要作用,而非防御反应。
3.3 JMT在基因工程中的应用
有研究表明,过表达JMT通常会使植物的抗性有所提高,这是由于过表达JMT会导致茉莉酮酸酯水平上升而不影响茉莉酮酸水平的结果[4]。虽然过表达JMT会使块茎类作物的产量提升,但会造成种子类作物产量的降低。在水稻中,过表达AtJMT导致MeJA积累水平增加,介导了胁迫信号导致ABA水平上升,影响了水稻穗的分化,最终导致产量降低[16]。并且,利用水稻自身的JMT在水稻中过表达,也出现了类似情况[14]。本研究发现,PfJMT在种子发育过程中呈现出逐渐降低的表达模式,因此过表达JMT除了会对穗分化产生不良影响,还可能对种子的发育本身带来不利的结果,要将JMT用于改良种子类作物具有较高的难度,但由于过表达JMT会使块茎类作物增加,因此将JMT用于改良块茎类作物将会是简单有效的。
4 结论
从紫苏中克隆得到PfJMT的ORF,编码349个氨基酸,该氨基酸序列具有一个甲基转移酶-7结构域,与拟南芥、丹参等双子叶植物亲缘关系较近,而与建兰、水稻等单子叶植物亲缘关系较远。PfJMT在开花后5d的种子中表达量最高,并随着种子的发育表达量逐渐降低。外源MeJA和SA处理,均导致PfJMT的表达量显著下调。
