食品动物源耐甲氧西林金黄色葡萄球菌MLSB类抗生素耐药性调查
2019-05-28李淑敏方亮星李亮赵孟陆肖古伟琪廖晓萍孙坚熊雁琼刘雅红
李淑敏,方亮星,李亮,赵孟,陆肖,古伟琪,廖晓萍,孙坚,熊雁琼,刘雅红
(1华南农业大学兽医学院,中国广州 510642;2美国加州大学洛杉矶分校医学院海湾医学中心,美国托兰斯 CA 90502)
0 引言
【研究意义】抗生素是一种很重要并且被广泛使用的药物,它能够杀灭或是抑制细菌生长,从而避免或克服了许多由于细菌感染疾病的发生;然而随着抗生素的大量使用以及滥用导致各种各样细菌对抗生素产生了严重的耐药性问题,威胁到全球的公共卫生,最终产生的多重耐药细菌成为了病人死亡率增高的一个因素[1]。比如本文讨论的耐甲氧西林金黄色葡萄球菌(methicillin-resistantstaphylococcus aureus,MRSA)菌株,它在人医临床上相比艾滋病、帕金森病或是他杀引起更多人的死亡[2]。因此,细菌对抗生素的耐药性成为当今世界的研究热点,由于细菌的快速繁殖以及食物链的考虑,科研工作者不仅仅研究医院内分离得到的MRSA菌株,还开始研究社区内以及动物源上分离得到的MRSA菌株的耐药性。因而,细菌的耐药性机制研究是降低生物死亡率的一个重要研究途径。【前人研究进展】金黄色葡萄球菌是人医和兽医临床上重要病原菌,它是导致皮肤和皮肤组织感染、血管感染、肺部、脓毒性关节炎、心内膜炎、骨髓炎等疾病的感染以及败血症的条件致病菌[3];随着抗生素-青霉素制剂开始应用于人类疾病治疗,越来越多的抗生素被发现和应用于抗疾病感染。由于抗生素广泛使用、甚至滥用,开始出现了如甲氧西林耐药金黄色葡萄球菌(MRSA)、万古霉素耐药/中介耐药金葡菌(VRSA/VISA)等“超级细菌”,这些“超级细菌”在世界各地的不同医院、社区甚至动物养殖场内广泛传播,对公共卫生构成巨大威胁[4]。1961年,JEVONS在英国医院内首次发现MRSA菌株[5],在 1960年代到1970年代期间,欧洲许多国家中也纷纷报道MRSA菌株,大部分局限在医院内的菌株爆发,至80年代后期,MRSA菌株已经成为一种世界普遍传播的病原菌[6]。随着MRSA在人医临床的出现越来越普遍,对人类健康的危害也渐渐引起关注。因此人们对MRSA的研究也越来越多,不仅针对人医临床,也开始从环境源,动物源等入手[4]:上世纪70年代,科学家DEVRIESE等人首次在牛乳房炎中检测出MRSA,其被称为与家畜有关的耐甲氧西林的金黄色葡萄球菌(livestock-associated MRSA,LA-MRSA)[7-8]。由于养殖业中抗生素的大量广泛使用,甚至滥用,LA-MRSA逐渐在世界范围内的许多动物种类中被发现,遍及猪、鸡、牛等动物身上[8-11],并且呈现多重耐药的情况。大环内酯类-林可胺类-链阳菌素 B 类(macrolides,lincosamides and type B streptogramin,MLSB)药物最开始是应用于葡萄球菌的感染治疗,随着其大量的使用和滥用导致耐药率不断的增高,该现象在人医临床上普遍的存在[12];在动物源上,MRSA菌株中的耐药现象也越来越普遍,其耐药程度越来越高[13-14]。MLSB这三类药物在化学结构上是不同的,但是,通过核糖体靶位修饰可导致这三类抗菌药物同时耐药[15-16]。erm是典型的介导MRSA菌株对MLSB耐药的基因,主要是通过编码rRNA甲基转移酶进而修饰23S rRNA的甲基化来介导耐药[17-18]。【本研究切入点】目前,以erm基因介导的LA-MRSA的耐药调查是比较少的,并且大都是在意大利、瑞典以及德国等地[19-21],而erm在我国食品动物源 MRSA菌株中的流行率及其与MLSB耐药关系还未见系统和全面的研究报道。【拟解决的关键问题】通过对猪、鸡以及鸭源MRSA菌株中的MLSB的耐药性调查以及耐药基因的检测,分析动物源MRSA菌株对MLSB的耐药表型及基因型之间的相关性,从而为MLSB抗生素的合理使用提供理论基础。
1 材料与方法
1.1 实验材料
1.1.1 培养基及试剂 甘露醇氯化钠琼脂培养基、金黄色葡萄球菌显色培养基、胰蛋白胨大豆肉汤(tryptical soy broth,TSB)、胰蛋白胨大豆琼脂(tryptical soy agar,TSA)、脑心浸出液肉汤、脑心浸出液琼脂培养基、水解酪蛋白琼脂(MH 琼脂)、水解酪蛋白肉汤(MH 肉汤),均购自广州环凯微生物科技有限公司,CAMH肉汤购自青岛海博生物技术有限公司。
DNA maker DL2000(50 ng·μL-1)、dNTP Mixture(2.5 mmol·L-1)、TaKaRarTaq购自宝生物工程(大连)有限公司。红霉素(erythromycin,ERY)、阿奇霉素(azithromycin,AZM)、泰乐菌素(tylosin,TYL)、克林霉素(Clindamycin,CLDM)、庆大霉素(Gentamicin,GEN)、头孢噻肟(cefotaxime,CTX)、氨苄西林(ampicillin,AMP)盐酸四环素(tetracycline,TET)、氟苯尼考(florfenicol,FFL)、环丙沙星(ciprofloxacin,CIP)、磺胺甲噁唑/甲氧苄啶(sulfamethoxazole,SMZ/trimethoprim,TMP)、利福平(rifampicin,RIF)、利奈唑胺(linezolid,LIN)、万古霉素(vancomycin,VAN)以及达托霉素(daptomycin,DAP)等均购自广州翔博生物科技有限公司。
1.1.2 引物的合成 参考相关文献报道的介导MLSB耐药的主要5种耐药基因的DNA序列,送往北京六合华大基因科技有限公司进行引物合成,引物序列及PCR条件如表1所示。
1.2 试验方法
1.2.1 样品的采集 2011—2016年间从中国广东、河北、福建、山东、江西及河南等6个省份的养殖场中采集约6 500份样品,采集动物为猪、鸡和鸭,采集部位包括动物粪便、鼻拭子、盲肠和肝脏。其中猪是采集活体猪的粪便和鼻拭子,鸡和鸭是通过解剖死亡的鸡鸭取肝脏和盲肠,用无菌棉签在相应部位表面蘸取为样品,再将接触过相应部位的棉签拭子放在提前准备好的 0.90%的生理盐水中进行稀释保存,用于分离菌株金黄色葡萄球菌。

表1 PCR引物序列Table 1 Primer sequences of the detection of MLSB resistant genes
1.2.2 菌株的分离与鉴定 菌株分离与鉴定方法如下:2011—2016年将从动物源放有采集样品的生理盐水中吸取大约100 μL的液体接种于3—5 mL含6.50%NaCl的脑心浸出液肉汤(BHI)中 37℃摇床培养 16—18 h;再用接种环挑取增菌液在高盐甘露醇固体培养基上划线,置于37℃恒温培养箱培养24 h;接着再从甘露醇培养基上生长良好的金黄色单菌落中挑出一个于金黄色葡萄球菌显色板上划线,置于37℃恒温培养箱中培养16—24 h,观察菌落形态;金黄色葡萄球菌的菌落形态为粉紫色初步认为是疑似金黄色葡萄球菌;然后将该疑似金黄色葡萄球菌在细菌生化自动鉴定仪进行鉴定;接着将确定为金黄色葡萄球菌的菌株进行苯唑西林药物的敏感性测试,将 MIC值>4µg·mL-1的菌株初步鉴定为LA-MRSA。参考相关文献报道的关于LA-MRSA基因mecA,mecC 基因的双重确定[22-23]。最后将确定好的LA-MRSA菌株置于终浓度为30.00%的甘油BHI肉汤中,于-80℃保存备用。
1.2.3 药敏试验 根据美国临床实验室标准委员会(Clinical and Laboratory Standards Institute,CLSI)推荐的琼脂稀释法的执行标准及原则进行,对分离的101株动物源MRSA菌株进行14种抗菌药物最小抑菌浓度(minimal inhibitory concentration,MICs)值测定。测定的抗生素包括氨基糖苷类:硫酸庆大霉素(gentamicin,GEN);四环素类:四环素(tetracycline,TET);酰胺醇类:氟苯尼考(florfenicol,FFC);安莎霉素类:利福平(rifampicin,RIF);β-内酰胺类:苯唑西林(oxacillin,OXA)、头孢噻肟(cefotaxime,CTX)、氨苄西林(ampicillin,AMP);林可胺类:克林霉素(clindamycin,CLDM);大环内酯类:红霉素(erythromycin,ERY)、阿奇霉素(azithromycin,AZM)、泰乐菌素(tylosin,TYL);噁唑烷酮类:利奈唑胺(linezolid,LIN);万古霉素类:万古霉素(vancomycin,VAN);脂蛋白抗生素:达托霉素(daptomycin,DAP)均购自广州翔博生物科技有限公司。
根据二倍琼脂稀释法用稀释液将药物储备液稀释到所需浓度,再分别相应比例量加入已经高压灭菌过的MH琼脂在平皿中进行混合均匀琼脂和抗菌药物溶液,接着进行冷却凝固,制成所需药液浓度的琼脂平板,再倒一个不加药液的平皿作为空白对照。按药物浓度从低到高的顺序,把稀释至含菌量为 1.0×106CFU/mL的菌液用多点接种仪(每针直径3 mm)蘸取稀释好的菌液接种到琼脂平板表面,37℃培养16—24 h 后读取结果。结果判定:以完全不见细菌生长的最低药物浓度为该药物对细菌的MIC,参照CLSI药敏标准:质控菌符合 CLSI标准中的药敏范围时,判读待测菌株的最小抑菌浓度。
1.2.4 MLSB耐药基因的检测 将 LA-MRSA 菌株挑选单菌落接种于5—10 mL TSB 肉汤中,37℃摇床中培养24 h;再将5—10 mL 的增菌液于离心机12 000 r/min离心 5 min,弃掉上清液进行集菌;接着根据promega基因组提取试剂盒的步骤进行提取DNA,最后将提取的 DNA置于-20℃冰箱保存备用。针对LA-MRSA菌株的模板,主要检测了MLSB的耐药基因:ermA-C、ereA-B基因。PCR扩增体系:上、下游引物(10 μmol·mL-1)0.5 μL,10×rTaq Buffer(Mg2+Plus)2.5 μL,dNTP Mixture(各 2.5 mmol·L-1)2 μL,rTaq(5 U·μL-1)0.125 μL,总体积 25 μL。扩增循环条件:94℃预变性5 min,94℃变性30 s,退火温度如表1所示,延伸72℃45 s,总共循环30个,接着再72℃延伸10 min。取适量PCR扩增产物经1.00%琼脂糖凝胶电泳,以DL2000 DNA Marker分子量标准做参考,缓冲液为0.5×TBE,在6 v/cm电压下电泳15—30 min,结束后用凝胶成像系统观察拍照分析。
1.3 试验的时间和地点
本试验是 2015—2017年期间在华南农业大学兽医学院502室进行,主要是在无菌室和超净台进行。
2 结果
2.1 LA-MRSA菌株的分离与鉴定
从我国六省养殖场采集约6 500份样品都是来源于食品动物源,从中分离到全国各地采集分离480株动物源金黄色葡萄球菌,进一步筛选与鉴定,其中101株为耐甲氧西林金黄色葡萄球菌(MRSA),这 101株MRSA菌株均为LA-MRSA,包括76株猪源,20份鸡源以及5株鸭源,总的样品中MRSA分离率约为1.54%(101/6500),金黄色葡萄球菌中 MRSA检出率为21.04%(101/480),不同动物来源的MRSA检出率详见表 2。结果表明,不同来源的样品中金黄色葡萄球菌的检出率在0.63%—2.17%之间,不同动物源金黄色葡萄球菌的MRSA菌株的分离率在11.90%—27.50%范围之间,其中猪源中的检出率最大(27.05%),其次是鸡源(12.74%)。

表2 动物源耐甲氧西林金黄色葡萄球菌的分离情况Table 2 Isolation of LA-MRSA
2.2 LA-MRSA菌株对 MLSB及其他抗菌药物的耐药情况
由于MRSA菌株是重要人畜共患病原菌,其耐药性问题也愈来愈受到关注。笔者采集的样品均为食品动物源,故只对食品动物源MRSA菌株(LA-MRSA)中MLSB类抗生素的耐药性进行研究。药敏结果显示,不同来源对克林霉素和红霉素的MIC50和MIC90均达到256 mg·L-1以上,呈现出高度耐药的情况。 101株LA-MRSA菌株对克林霉素和红霉素的耐药率均为100.00%,且MIC50和MIC90均达到256 mg·L-1以上,呈现出高度耐药的情况;其次是对泰乐菌素(99.01%)、阿奇霉素(99.01%)、庆大霉素(94.05%)、头孢噻肟(96.39%)、四环素(96.39%)和氨苄西林(91.90%)的耐药率均达到90.00%以上,而对磺胺甲噁唑/甲氧苄啶(53.46%)和利福平(25.74%)的耐药率较低,所有的LA-MRSA菌株对万古霉素、利奈唑胺以及达托霉素菌均敏感。
动物源MRSA菌株共有17种耐药谱型,主要谱型为GEN-TYL-AZM-ERY-FFC-CLDM-TET- S/T-AMPCTX,有37株,占36.63%,其次为GEN-TYL-AZMERY-FFC-CLDM-TET-AMP-CTX,有26株,占11.88%;接着为GEN-TYL-AZM-ERY-FFC-RIF-CLDM-TET-S/T-AMP-CTX有11株,占1.89%。动物源MRSA多重耐药情况如表3所示,101株LA-MRSA菌株中,除1株外,其余均表现为对三类及三类以上抗菌药物耐药,且以11耐(48/101,47.52%)和 10耐(35/101,34.65%)为主,其次为12耐(11/101,10.89%)。

图1 101株LA-MRSA菌株对14种抗生素的耐药率Fig. 1 Resistant rates to 14 antibiotics in 101 LA-MRSA strains

表3 动物源MRSA菌株的多重耐药情况Table 3 The result of multiple drug resistance of MRSA from animals
2.3 LA-MRSA菌株对MLSB耐药基因的检出情况
101株LA-MRSA菌株中,均携带有mecA,mecC基因,MLSB耐药基因检出率最高为ermC,为100.0%;其次是ereB,检出80株,检出率为79.20%,接着是ermA和ereA检出率分别为 45.54% (46/101)和40.69%(41/101),而ermB检出率最低为 11.89%(12/101)。
2.4 MLSB耐药的 LA-MRSA菌株对其他耐药基因的检出情况
进一步调查了携带 MLSB耐药基因的动物源MRSA菌株中其它耐药基因携带情况。结果如图2所示,携带MLSB耐药基因阳性的动物源MRSA菌株中,fexA、tetL、aadA1、aph(4’)-Ia的检出率较高,分别是92.10%、97.02%、97.29%和83.17%;其次是tet(M),检出率为 71.29%;而aac(6’)-Ib、aac(3’)-Ic、aph(3’)-II、aph(3’)-IV、optrA、tet(A)、tet(C)的检出率相对较低,分别是49.50%、46.53%、39.60%、37.62%、33.67%、29.70%和20.79%;接着检出率更低的是cfr、tet(K)、lnuA以及lnuF,分别为17.82%、14.85%、5.94%和3.96%。从图 1和图 2结果可以看出,除了 MLSB的耐药率大于90%,氟苯尼考,四环素,庆大霉素,头孢噻肟,氨苄西林的耐药率也大于90%,介导这些抗菌药物耐药的耐药基因分别是fexA、tetL、aadA1、aph(4’)-Ia,检出率也大于 90%,基因型与表型保持一致。
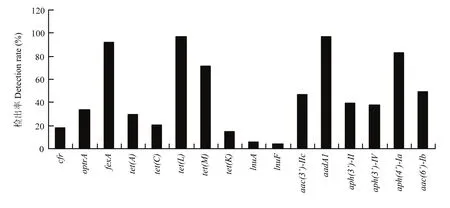
图2 MLSB耐药LA-MRSA菌株对其他耐药基因的检出率Fig. 2 The detection rates of other drug resistance genes among MLSB resistant LA-MRSA
2.5 LA-MRSA菌株中 MLSB耐药基因检出个数与多重耐药情况之间的关系分析
为探讨动物源 MRSA菌株中多重耐药的程度与其携带的MLSB耐药基因检出个数是否存在联系,进一步分析了LA-MRSA菌株中MLSB耐药基因检出个数与对受试抗菌药物的耐药数目之间的关系,结果如表 4所示。对受试抗菌药物表现为 12耐的 11株LA-MRSA菌株中,共检出6种不同的MLSB耐药基因组合,其中以4种和3种MLSB耐药基因组合为主导,分别占45.45%(5/11)和36.36%(4/11),还有一株菌中检出5种MLSB耐药基因。对受试菌株为11耐的48株LA-MRSA菌株中,共检出9种不同的MLSB耐药基因组合,其中以2种和3种MLSB耐药基因组合为主导,分别占39.58%(19/48)和35.42%(17/48),其次为4种MLSB耐药基因组合,占22.92%(11/48)。对受试菌株为10耐的35株LA-MRSA菌株中,共检出9种不同的MLSB耐药基因组合,其中以3种和2种MLSB耐药基因组合为主导,分别占42.86%(15/35)和25.71%(9/35),其次为4种MLSB耐药基因组合,占19.44%(7/36)。而对受试菌株为2、6、7和9耐的7株菌中,检出9种不同的MLSB耐药基因组合,主要是以两个 MLSB耐药基因组合为主,占 57.14%(4/7)。对动物源MRSA菌株MLSB耐药基因检出个数与受试抗菌药物的耐药数目之间的关系分析结果表明,伴随着菌株对受试抗菌药物的耐药数目增加时,菌株中MLSB耐药基因检出个数也在增加。
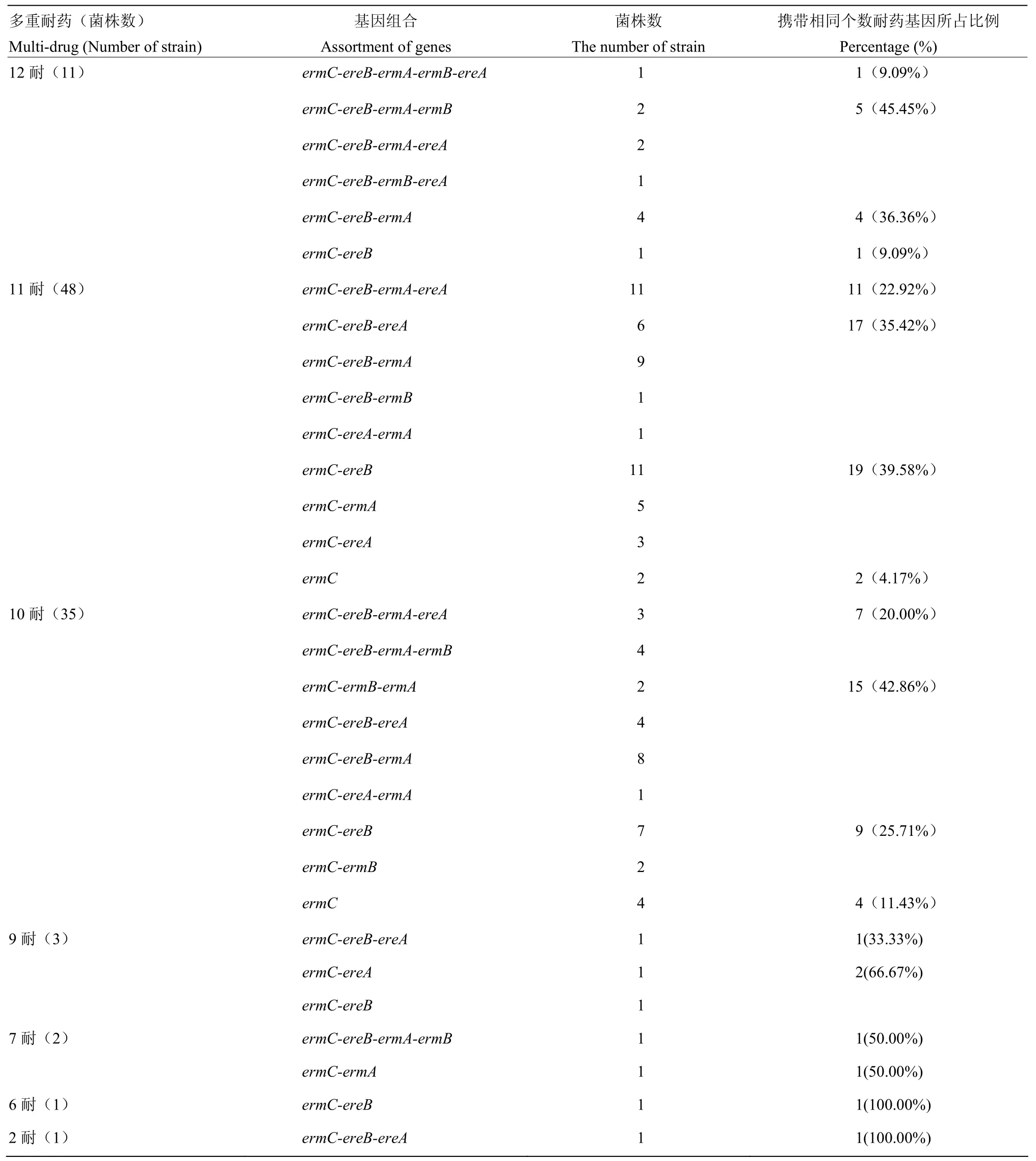
表4 LA-MRSA中MLSB耐药基因的基因组合与多重耐药谱型之间的关系Table 4 The relationship between genetic combination of MLSB and multiple drug resistance of LA-MRSA
3 讨论
本研究中的 101株动物源的 MRSA 菌株分离于猪源、鸡源以及鸭源,分离率均在 0.60%以上,2017年,LI等[27]报道在2014年从中国许多省份地区采集分离的2 420份猪源样品中分离出了270株LA-MRSA菌株,分离率达到11.20%,相比本文研究结果较高。MLSB在全球范围内MRSA菌株中的耐药情况已经有较多报道,这些报道出现在人源、动物源的MRSA菌株中,也出现在其他葡萄菌属中[20,28-30]。目前,我国对MLSB的耐药性调查主要在人医临床上比较多,并且研究的菌种各有不同。2016年,我国一家医院从62位病人身上分离出的18株MRSA菌株中,有10株的MRSA对MLSB耐药,耐药率达到55.60%[31];在其他菌种中,2013年研究报道,在我国7家不同的医院病人身上分离出的肺炎双链球菌对红霉素的耐药率为89.70%[32];2014年,我国上海的一家医院的病人身上分离出的94株艰难梭菌对MLSB呈现出高水平的耐药[28];我国在动物源上对MLSB的耐药性调查较晚,报道也相对较少,2012年,HO等[33]报道从我国香港地区的屠宰猪身上采集的400份鼻拭子中分离出157株LA-MRSA其中对克林霉素的耐药率为99.00%,红霉素的耐药率为 89.00%;2017年,LIU等[34]报道,在我国北部地区牛群中未加工的牛奶中分离出的 16株LA-MRSA中,有46.3%的LA-MRSA菌株对红霉素耐药;在其他菌种中,2015年,ZHANG等[30]研究报道在62只健康母猪和34只病猪身上采集分离的37株猪链球菌中,有35株菌对MLSB产生耐药,分离率达到94.60%。本研究通过对动物源MRSA菌株的敏感性检测结果显示,101株动物源的 MRSA菌株对MLSB的 MIC50和 MIC90都大于 256 mg·L-1,耐药率达到99.00%以上。由此可见,MLSB在动物源上的耐药率相比人源分离的菌株高,而本研究中的 LA-MRSA对MLSB的耐药率又略高于其他在人源或是动物源上分离的菌株。结果提示,LA-MRSA中MLSB菌株中呈现高水平的耐药,给临床上治疗细菌感染疾病带来困扰,因而合理的使用抗生素在养殖生产中非常的有必要。
除MLSB药物外,本研究还对其他11种抗菌药物如四环素、庆大霉素、氟苯尼考等进行MIC检测,基本上呈现出高度耐药的情况,对四环素、庆大霉素、头孢噻肟、氨苄西林、氟苯尼考等5种抗菌药物的耐药率均达到91.00%以上,而对其他受试药物如复方新诺明和利福平耐药水平相对较低。2015年,WANG等[35]报道中分离的20株葡萄球菌的MIC结果显示其对四环素、克林霉素以及红霉素均产生耐药,而对氯霉素、泰妙菌素和沃尼妙林高水平耐药,对复方新诺明呈现低水平耐药,本研究结果与其一致。欧洲、澳大利亚等地区分离的LA-MRSA的敏感测试结果显示对四环素的耐药率为 50.00%,红霉素的耐药率为35.70%,只有1株对利福平耐药[36-37],低于本研究结果。本研究发现动物源MRSA菌株对MLSB及其他抗菌药物耐药严重,存在的耐药谱型较多,主要集中在10耐、11耐以及12耐谱型,原因可能在于养殖场人员对抗生素的大量不合理的应用,造成一定的药物选择型压力,导致耐药;还有原因在于一些人医临床上的药物在动物身上的应用,用药主体的不适用也是耐药的原因。因此,在养殖生产过程中应合理规范使用抗菌药物,不使用高度耐药的抗菌药物,应用敏感性较强的抗菌药物如复方新诺明、利福平等来治疗MRSA菌株的感染,交替使用,避免交叉耐药和防止耐药细菌的产生和传播。
本研究发现,101株MRSA菌株对 MLSB抗菌药物表现出较高水平耐药,同时,发现典型的介导MRSA菌株对MLSB产生耐药的基因erm和ere存在较高的流行率,尤其是ermC基因检出率达100.00%,另外,ereB检出率将近80.00%,此外ermA和ereA检出率也超过40.00%。2005年,孔海深等[38]报道中erm的检出率是100.00%;2013年,SHEN等[39]在动物源上的相关报道erm基因在分离的葡萄球菌中基本上都检出,本研究结果与之类似。由此可见,耐药基因ermA-C和ereA-B是介导MLSB产生耐药的主要成因之一,其在人源或是动物源上的MRSA菌株中都能够检测到[40-42]。本研究还进一步探讨了动物源 MRSA菌株中多重耐药的程度与其携带的MLSB耐药基因检出个数之间的关联性,发现伴随着菌株对受试抗菌药物的耐药数目增加时,菌株中MLSB耐药基因检出个数也在增加,暗示动物源MRSA菌株 MLSB耐药基因的携带情况可能与菌株的多重耐药情况关系密切,从而有利于多种抗生素压力下细菌的存活能力。
进一步分析携带MLSB耐药基因的LA-MRSA菌株中其它耐药基因检出情况,发现多种非MLSB耐药基因也存在较高检出率。这表明LA-MRSA菌株中的MLSB耐药基因与某些非 MLSB抗生素的耐药表型存在的密切关系很可能是由于菌株中同时存在其他耐药基因。耐药基因经常出现两种或多种协同传播现象,即介导同一类或不同类抗菌药物的耐药基因可存在于同一个移动元件上,例如质粒,转座子,整合子等,这些元件可介导它们共同传播,从而导致多重耐药菌株的扩散[43]。
4 结论
本研究发现耐甲氧西林金黄色葡萄球菌菌株对大环内酯类-林可酰胺类-链阳菌素B类呈现高度耐药且多重耐药情况严重,介导大环内酯类-林可酰胺类-链阳菌素B类耐药的ermC检出率高,大环内酯类-林可酰胺类-链阳菌素 B类耐药基因个数与菌株的多重耐药情况密切相关,同时还发现其他抗菌药物耐药的耐药基因检出率也相对较高,可能是本研究中菌株呈现多重耐药现象的主要原因。值得注意的是,食品动物源耐甲氧西林金黄色葡萄球菌耐药菌可通过食物链以及环境污染等途径传播给人,从而对人的健康造成威胁。因此,需进一步监测食品动物源耐甲氧西林金黄色葡萄球菌菌株对大环内酯类-林可酰胺类-链阳菌素B类抗生素耐药情况及大环内酯类-林可酰胺类-链阳菌素B类耐药基因的流行分布情况。
