PI3K抑制剂在淋巴瘤中的研究进展
2019-05-27张文娟李莉娟赵叶梅张连生
张文娟,李莉娟,赵叶梅,张连生
(兰州大学第二医院血液科,兰州 730030)
淋巴瘤是血液系统恶性肿瘤中最常见的一种,其全球发病率及死亡率呈逐年升高趋势[1]。淋巴瘤为高度异质性疾病,目前主要治疗方式为化疗联合单抗分子靶向治疗、自体造血干细胞移植、应用免疫调节剂等,这使得淋巴瘤患者的预后得到显著改善,但临床仍存在疾病侵袭性强、难治、复发、病情进展等问题。如小淋巴细胞淋巴瘤、滤泡性淋巴瘤等惰性淋巴瘤的主要治疗方案为利妥昔单抗联合低剂量化疗,但疾病不易缓解,无法治愈,且有向侵袭性淋巴瘤转化的风险[2]。近年来,分子靶向治疗的研究与应用成为肿瘤治疗的新途径。磷脂酰肌醇-3-激酶(phosphatidylinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB/Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路控制着众多肿瘤发生发展的必要细胞生物学途径,包括细胞的增殖、代谢、凋亡、血管新生及细胞周期的调控等[3-4],而针对PI3K/Akt/mTOR信号通路的分子靶向抑制剂具有抑制肿瘤细胞增殖、促进肿瘤细胞凋亡的作用。其中,PI3K抑制剂已在淋巴瘤的临床试验中开展。现就PI3K抑制剂在淋巴瘤中的研究进展予以综述。
1 PI3K/Akt/mTOR信号通路与淋巴瘤
1.1PI3K/Akt/mTOR信号通路 PI3K是一类特异性的磷酸化磷脂酰肌醇激酶,根据结构、功能的不同分为Ⅰ、Ⅱ、Ⅲ型,Ⅰ型被认为与肿瘤的发生发展最为密切[5]。PI3KⅠ型分为ⅠA及ⅠB型,其中PI3KⅠA由p110(催化亚基)和p85(调节亚基)组成,催化亚基分为PI3Kα、PI3Kβ和PI3Kδ 3个亚型,其分别由PIK3CA、PIK3CB和PIK3CD 3个基因编码[6]。PI3KⅠB由p110γ(催化亚基)和p101(调节亚基)组成。PI3K可通过与生长因子受体或G蛋白偶联受体结合引起其活化,也可通过p110与Ras结合被活化,且脾酪氨酸激酶在PI3K活化中也有一定作用[7-8]。PI3K活化后磷酸化3,4-二磷酸磷脂酰肌醇为3,4,5-三磷酸磷脂酰肌醇,进而激活下游的效应分子。人第10号染色体缺失的磷酸酶及张力蛋白同源基因(phosphates and tensin homologue deleted on chromosome ten gene,PTEN)是PI3K/Akt/mTOR信号通路的负性调控分子,其能使3,4,5-三磷酸磷脂酰肌醇去磷酸化为3,4-二磷酸磷脂酰肌醇[9];当PTEN基因缺失、突变时,会导致Akt/mTOR通路过度激活[10]。
Akt为PI3K的下游效应分子,是PI3K/Akt/mTOR信号通路的中心,其可以激活并调控众多激酶靶点。Akt可以通过抑制结节性硬化复合物1/2激活mTOR,其他作用靶点包括与癌基因相关的鼠双微体2、核因子κB抑制剂激酶α、p21和p27[11]。其中,鼠双微体2通过抑制p53抑癌基因来促进肿瘤细胞增殖,而抑制PI3K/Akt可逆转鼠双微体2的作用[12]。核因子κB抑制剂激酶α是核因子κB激活所需的关键因子[13],是淋巴瘤的治疗靶点,部分由Akt激活[14]。同时,Akt活化也能抑制细胞周期抑制因子中p21和p27的功能,从而导致肿瘤细胞过度增殖[15-17]。
此外,Akt能直接或间接激活mTOR,mTOR受生长因子、能量、营养、激素等影响,有mTOR复合体1和mTOR复合体2两种结构功能不同的复合体[18]。其中,mTOR复合体1位于Akt下游,能磷酸化激活p70核糖体蛋白S6激酶和真核细胞翻译抑制分子eIF-4E结合蛋白1[19],参与细胞增殖、信使RNA翻译和蛋白质合成,同时核糖体蛋白S6激酶可以负反馈调节Akt。mTOR复合体2位于Akt上游,不仅可磷酸化Akt,调控细胞生存和细胞骨架合成[20-21],还可正向调节Akt[22]。PI3K/Akt/mTOR信号通路传递,见图1。
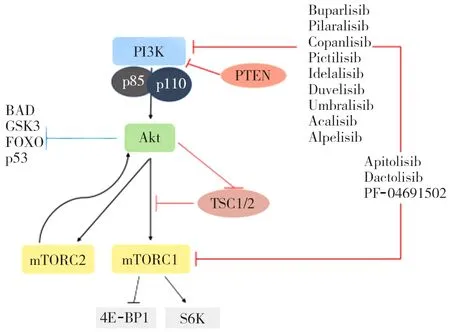
PI3K:磷脂酰肌醇-3-激酶;PTEN:人第10号染色体缺失的磷酸酶及张力蛋白同源基因;BAD:Bcl-2相关死亡启动子;GSK3:糖原合成酶激酶3;FOXO:叉头蛋白O;Akt:蛋白激酶B;TSC1/2:结节性硬化复合物1/2;mTORC:哺乳动物雷帕霉素靶蛋白复合体;4E-BP1:4E结合蛋白1;S6K:核糖体蛋白S6激酶
图1 PI3K/Akt/mTOR信号通路传递及PI3K抑制剂作用靶点
1.2PI3K/Akt/mTOR信号通路在淋巴瘤中的异常活化 PI3K/Akt/mTOR信号通路的异常激活可由参与其中的各种分子的异常导致,且活化状态在不同淋巴瘤中各有不同。在弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)中,PIK3CA的突变率低于10%[23],PIK3CD的突变率为4.1%[24],而在癌症基因组图谱DLBCL项目初步数据中没有发现PIK3突变,但更多的病例正在研究中[25]。在绝大部分生发中心型DLBCL中存在PTEN缺失,但在非生发中心型DLBCL中几乎均存在PTEN表达,提示PTEN缺失可能与GCB-DLBCL有关[26-27]。虽然在DLBCL中PIK3CA的突变率较低,但Akt磷酸化较常见,提示PI3K/Akt/mTOR信号通路激活[28]。在大多数DLBCL细胞株和患者标本中,存在mTOR下游分子p70核糖体蛋白S6激酶过表达[29];Xu等[30]在与DLBCL相关的研究中发现,PI3K/Akt/mTOR信号通路存在异常活化,该通路激活表现为相关分子的磷酸化,其中磷酸化Akt为54.8%、磷酸化p70核糖体蛋白S6激酶为46.6%、磷酸化eIF-4E结合蛋白1为45.2%,且PI3K/Akt/mTOR信号通路异常活化的DLBCL患者,其常规治疗效果差,病情进展快,生存期缩短。在套细胞淋巴瘤(mantle cell lymphoma,MCL)中,几乎不存在PIK3CA基因突变,但大多数患者的PIK3CA基因存在扩增,导致转录和通路激活增加,这与复发难治性MCL的疾病进展有很大相关性,且复发MCL中PI3Kα的表达也增加,较PI3Kβ更有临床意义[31-33];同时,MCL中也存在PTEN蛋白表达缺失。在高侵袭性MCL亚型中,Akt的激活对肿瘤细胞的存活至关重要[34]。一项关于MCL的小样本研究发现,mTOR独立于Akt调节糖原合成酶激酶3β,从而控制细胞周期蛋白D1的调控[35]。在临床前模型中,霍奇金淋巴瘤(Hodgkin lymphoma,HL)的PI3Kβ表达强于PI3Kα,HL细胞系中普遍存在Akt磷酸化[36];在大多数HL中,mTOR的活性升高,其与改善临床预后呈负相关[37]。外周T细胞淋巴瘤在49%的病例中表现为Akt磷酸化,提示临床预后差[38]。同时,慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)中5.6%的病例存在PIK3CA基因扩增[39]。Sander等[40]研究表明,在伯基特淋巴瘤的形成过程中PI3K/Akt信号通路的异常活化也起重要作用。
2 PI3K抑制剂在淋巴瘤中的应用
作为PI3K/Akt/mTOR信号通路的重要环节,PI3K引起了肿瘤领域研究者们的高度关注。PI3K抑制剂分为抑制Ⅰ型PI3K四个亚基的广谱PI3K抑制剂、针对特定亚基的选择性PI3K抑制剂及PI3K/mTOR双重抑制剂。
2.1广谱PI3K抑制剂 Wortmannin和LY294002是临床研究最早的广谱PI3K抑制剂,它们通过抑制PI3K/Akt/mTOR信号通路激活来改善细胞毒性化疗药物对肿瘤细胞株的反应效果,但因其不良反应较大,故仍处于体外实验阶段。目前,多种新的PI3K抑制剂相继被研发,如Younes等[41]、Brown等[42]和Markham[43]均显示出良好的耐受性和较小的不良反应。
2.1.1Buparlisib(BKM120) Buparlisib是一种有效的口服广谱PI3K抑制剂,其对淋巴瘤细胞具有抗肿瘤活性,能诱导DLBCL细胞凋亡[44],同时能减少MCL中原癌基因Myc的依赖性增殖[45],在恶性血液肿瘤中表现出临床前活性[45-46],对实体肿瘤具有一定的临床疗效[47-50]。
在评估Buparlisib疗效的多中心、开放、单臂Ⅱ期临床研究中,纳入72例复发性/难治性非HL(non-Hodgkin lymphoma,NHL)患者,其中DLBCL 26例、MCL 22例、滤泡性淋巴瘤(follicular lymphoma,FL)24例;中位年龄65岁,大多数患者(73.6%)处于NHL Ⅲ/Ⅳ期[41]。结果显示,DLBCL、MCL、FL的总缓解率分别为11.5%、22.7%和25.0%,其中2例(分别为DLBCL、MCL)完全缓解。可见,Buparlisib在复发性/难治性NHL中表现出有效性,部分患者病情稳定,肿瘤负荷持续减轻,毒性反应可耐受。一项骨髓纤维化联合应用Ruxolitinib(Janus激酶抑制剂)和Buparlisib(BKM120)的多中心、开放、双臂、剂量选择的Ⅰb期研究发现,患者普遍具有良好的耐受及临床疗效,包括以往一些接受过Janus激酶抑制剂单药治疗的患者在内有相当多的骨髓纤维化患者脾大完全回缩[51]。在一项利妥昔单抗联合Buparlisib治疗复发性或难治性B细胞NHL的Ⅰ期研究中,虽然接受治疗的患者数量很少但已观察到初步疗效[52]。未来,Buparlisib在恶性血液肿瘤中的临床疗效还需要进一步研究。
2.1.2Pilaralisib (SAR245408) Pilaralisib是一种新型、高选择性、强效的广谱PI3K抑制剂,对Ⅰ型PI3K亚型α、β、γ和δ的半数抑制浓度分别为48、617、10和260 nmol/L[53],其在临床前肿瘤模型和实体肿瘤患者中均显示出抗肿瘤活性[53-55]。
美国一项队列研究评估了Pilaralisib在25例CLL或复发难治性淋巴瘤患者中的安全性、药动学、药效学和初步疗效,其中CLL患者10例,复发/难治性淋巴瘤患者5例[42]。结果显示在CLL患者中,Pilaralisib显著降低了一些B淋巴细胞的细胞因子、趋化因子水平,5例CLL和3例淋巴瘤患者部分缓解,6例CLL患者淋巴结节萎缩50%,14例(7例CLL和7例淋巴瘤)患者无进展生存期为6个月。Pilaralisib在CLL和淋巴瘤患者中显示出可接受的安全指标,与实体肿瘤患者的结果基本一致[54]。可见,单药Pilaralisib在CLL和复发难治性淋巴瘤患者中表现出初步的临床活性,故支持其进一步发展。
2.1.3Copanlisib 2017年9月15日,美国食品药品管理局加速批准Copanlisib上市,用于复发性FL患者(至少接受2次系统治疗后),其为食品药品管理局批准的第一个广谱PI3K抑制剂。Copanlisib对Ⅰ型PI3K亚型α、β、γ和δ的半数抑制浓度分别为0.5、3.7、6.4和0.7 nmol/L,其不仅能抑制PI3Kα和PI3Kδ活性,还能诱导肿瘤细胞凋亡并抑制恶性B细胞增殖[43]。
一项多中心、开放、单臂的Ⅱb期临床研究,纳入142例复发或难治性惰性淋巴瘤患者(曾接受2次及以上的系统治疗),Copanlisib给药剂量为每周60 mg,静脉滴注1 h[56]。结果显示,其客观缓解率为59.2%,完全缓解率为12%,中位缓解持续时间为22.6个月,中位无进展生存期(progression-free survival,PFS)为11.2个月。Copanlisib体现出良好的临床效果,其高应答率与PI3K/B细胞受体信号通路基因的过表达有关[57]。目前,研究者正进行FL、MCL和外周T细胞淋巴瘤患者中Copanlisib亚型的特异性研究。其中,Ⅲ期临床试验正在评估Copanlisib治疗复发/难治性DLBCL的疗效,并联合以利妥昔单抗为基础的化疗治疗复发性惰性B细胞性NHL,同时对复发/难治性外周T细胞或自然杀伤/T细胞淋巴瘤的Ⅰ/Ⅱ期研究也在进行中,期待其进一步的研究结果[43]。
2.1.4Pictilisib(GDC-0941) Pictilisib是一种广谱Ⅰ型PI3K抑制剂,日本一项Ⅰa/Ⅰb临床研究表明,其在晚期实体肿瘤中具有良好的安全性和耐受性[58]。体外研究证明,Pictilisib对MCL细胞系具有抗肿瘤活性[31]。但其在恶性淋巴瘤中的作用有待进一步探索。
2.2选择性PI3K抑制剂 与广谱PI3K抑制剂相比,选择性PI3K抑制剂主要针对特定的靶蛋白,但因肿瘤细胞多表达多种PI3K亚型,故广谱PI3K抑制剂可能更加有效。然而,由于广谱PI3K抑制剂易脱靶并导致明显的细胞毒性,且抑制多种亚型需大剂量导致患者无法耐受,而选择性PI3K抑制剂不易脱靶且药物相关不良反应发生率低[22],故针对选择性PI3K抑制剂的研究也非常重要。
2.2.1Idelalisib(CAL-101和GS-1101) Idelalisib为首个上市的口服选择性PI3K抑制剂,靶向p110δ。一项多中心、单臂、开放标签的Ⅱ期临床研究,纳入125例复发性的惰性NHL患者,包括FL(72例)、小淋巴细胞淋巴瘤(small lymphocytic lymphoma,SLL)(28例)、边缘区淋巴瘤(15例)和淋巴浆细胞淋巴瘤/华氏巨球蛋白血症(10例)[59]。结果显示,其总缓解率为57%,完全缓解率为6%,中位缓解持续时间为12.5个月,其中FL和SLL的总缓解率分别为54%和61%。在这一单药研究中,Idelalisib显示出了抗肿瘤活性,且其安全性可接受。另外在一项评估Idelalisib联合利妥昔单抗对复发性CLL患者疗效及安全性的Ⅲ期临床研究中,Idelalisib也体现出显著的临床效果;在第一次试验预期分析中,与对照组相比,治疗组的总缓解率和12个月总生存率提高,且对照组的中位PFS为5.5个月,而治疗组因疗效显著使得这项研究被提前终止[60]。
美国食品药品管理局于2014年7月23日批准Idelalisib上市,主要用于治疗复发性FL和复发性SLL(之前至少接受过两次系统治疗),以及联合利妥昔单抗治疗复发的CLL。Idelalisib单药常见不良事件(≥20%)包括:腹泻、恶心、疲乏等;联合用药常见不良事件(≥30%)包括:腹泻、肺炎、发热等。
2.2.2Duvelisib(IPI-145) Duvelisib是Ⅰ类PI3Kδ/γ小分子选择性双重抑制剂。2018年9月,Duvelisib在美国首次获得全球批准,用于治疗至少两次治疗后复发或难治性CLL/SLL的成人患者;同时Duvelisib在美国也被加速批准,用于治疗至少两次系统治疗后复发或难治性FL的成人患者[61]。
一项单臂、开放标记、Ⅱ期DYNAMO试验证实了口服单药Duvelisib治疗复发/难治性惰性NHL的疗效[62]。所有患者均接受Duvelisib治疗(剂量25 mg,口服,每日2次),28 d为1个周期,直到无法耐受或疾病进展为止。结果显示,其总缓解率为46%,均为部分缓解;中位缓解时间为1.9个月,中位缓解持续时间为9.9个月,中位PFS为8.4个月,总生存期为18.4个月。
Duvelisib单药治疗复发/难治性CLL/SLL的疗效在一项随机、开放标记、多中心、Ⅲ期临床试验中得到证实[63]。患者随机分为两组,分别接受Duvelisib单药治疗(n=160)或奥法木单抗(靶向抗CD20单克隆抗体)单药治疗(n=159)。结果表明,与奥法木单抗相比,Duvelisib显著延长PFS,总缓解率更高;其中,Duvelisib 6个月和12个月疾病无进展率分别为78%和60%,而奥法木单抗分别为72%和39%。目前,Duvelisib单药治疗复发/难治性外周T细胞淋巴瘤的Ⅱ期初步试验正在进行中。
2.2.3Umbralisib(TGR-1202) Umbralisib是靶向PI3Kδ的新一代选择性抑制剂,其在结构上有别于其他PI3Kδ抑制剂,具有较好的异构体选择性。同时,Umbralisib还能抑制酪蛋白激酶1ε,是蛋白翻译的主要调节因子。
一项评估Umbralisib治疗复发或难治性CLL和淋巴瘤的开放标记、剂量递增、Ⅰ期临床研究,纳入CLL患者24例、B-NHL患者49例、HL患者11例、其他血液恶性肿瘤患者6例[64]。其研究终点为评估所有患者的安全性、最大耐受剂量和药动学。结果显示,其客观缓解率为37%,最大耐受剂量为1 200 mg,其中800 mg为推荐的Ⅱ期临床试验剂量[64]。目前,Umbralisib联合Ublituximab(CD20单抗)、依鲁替尼(布鲁顿酪氨酸激酶抑制剂)治疗CLL/SLL、NHL的临床试验正在进行中。
2.2.4Acalisib(GS-9820) Acalisib为靶向PI3Kδ的选择性抑制剂。一项纳入38例成人复发难治性CLL或淋巴瘤患者的Ⅰ期临床试验,其中CLL22例、NHL15例、HL1例[65]。结果表明,Acalisib单药治疗的总缓解率为42.1%,且CLL组与NHL/HL组的总缓解率分别为53.3%和28.6%,淋巴结反应率分别为85.7%和36.4%,最常见的不良事件为腹泻、皮疹、转氨酶升高和感染。Alpelisib(BYL719)为新一代选择性PI3K抑制剂,其能特异性靶向野生型PIK3CA和突变PI3Kα,在实体肿瘤的临床试验中有良好的安全性和疗效。但Alpelisib(BYL719)在淋巴瘤中的效果有待进一步评估。
2.3PI3K/mTOR双重抑制剂 PI3K和mTOR均属于PI3K相关激酶超家族的成员,具有相同的结构域,因此PI3K/mTOR双重抑制剂可以作用于两种激酶,抑制信号通路中Akt的上游和下游,阻滞mTOR抑制所导致的激活核糖体蛋白S6激酶-PI3K负反馈通路[66]。Apitolisib(GDC-0980)是PI3K和mTOR的强效双重抑制剂,对以PI3K-突变体、PTEN-null和KRAS-突变细胞系为研究对象的多种异种移植瘤模型显示了抑制肿瘤生长的作用[67-68]。目前,Apitolisib、Dactolisib(BEZ235)等PI3K/mTOR双重抑制剂已进入晚期实体肿瘤临床试验阶段[69-70]。研究发现,PI3K/mTOR抑制剂PF-04691502能够抑制DLBCL、MCL体外细胞系增殖,诱导细胞周期阻滞和凋亡,减少Akt及S6核糖体蛋白磷酸化[71]。但PI3K/mTOR双重抑制剂在淋巴瘤中的应用还有待于进一步研究。
3 小 结
由于已证明在淋巴瘤中存在PI3K/Akt/mTOR信号通路的异常活化,故其成为淋巴瘤治疗的新方向。同时,由于PI3K抑制剂在淋巴瘤的临床试验中取得突破性进展,且越来越多的PI3K抑制剂已进入临床试验阶段,故其被认为是充满前景的淋巴瘤治疗靶点。此外,肿瘤的发生进展是涉及多基因、多条信号通路的复杂过程,单靶点的疗效可能有限,故需要联合化疗或其他分子靶向药物等。未来,需探索合理的联合治疗方案及联合治疗相互作用的机制,寻找可用于预测疗效的生物标志物,并确定敏感人群,针对性地选择靶向药物,以提供更有效、经济的个体化治疗方案。
