NF-κB寡核苷酸诱骗策略构建胶原诱导性关节炎大鼠耐受性DC①
2019-05-27田娅玲宁丽常蒋红梅
田娅玲 宁丽常 岳 萍 蒋红梅
(贵州医科大学,贵阳550004)
类风湿关节炎(Rheumatoid arthritis,RA)是一种致残率较高的自身免疫性疾病。抗原递呈细胞(Antigen presenting cell,APC)对自身抗原的异常递呈,使自身反应性T细胞活化,主要由Th1细胞介导,这是导致RA发生的主要原因之一[1,2]。 DC是在T细胞活化过程中起关键作用的APC,是目前唯一已知能激活初始型T(naive T)细胞的APC。在自身免疫过程中,DC的生物学功能具有双重性:成熟DC可以激活T细胞,具有免疫激活功能;而未成熟DC(immature dendritic cells,iDCs )可以使T细胞对自身抗原耐受,具有免疫抑制能力。由于未成熟DC表面低表达或不表达CD80、CD86等共刺激分子,使抗原特异性T细胞失活、无反应和调节性T细胞(Treg)形成,因而被认为是“耐受性DC”。近年来DC在器官移植领域引起了广泛的关注,其诱导免疫耐受的特性成为研究热点[3,4]。目前国内外已有方法抑制DC成熟,增强其免疫耐受的作用。例如用一些免疫抑制剂或通过转基因技术在DC内导入免疫抑制分子等方法,但这些方法均有不同程度的弊端[5,6]。NF-κB ODN Decoy策略是一项新的反义技术。利用与 NF-κB靶基因的κB位点(cis元件)相一致的ODN序列,竞争性地占据NF-κB上靶基因启动区结合部位,从而使转录因子无法有效调节靶基因的表达[5]。应用 NF-κB特异性的ODN Decoy可有效阻断DC细胞内NF-κB活性,使DC呈现出不成熟的表型和功能,且这种抑制作用具有很高的稳定性[6]。因此,与其他抑制DC成熟的方法相对比,ODN抑制DC成熟具有一定的优势。CIA模型是模拟人类RA最经典的动物模型之一,本实验将从病程中CIA大鼠脾脏提取单核细胞并在体外诱导成DC,利用 Decoy策略,将NF-κB ODN Decoy导入细胞,阻断细胞内NF-κB活化从而抑制DC成熟,并综合评价其形态特征、表面表达共刺激分子情况和刺激混合淋巴细胞反应的能力等。本研究拟探讨将CIA大鼠脾脏来源的DC构建成稳定的耐受性DC,为此耐受性DC应用于CIA模型大鼠体内干预试验提供实验基础。
1 材料与方法
1.1材料
1.1.1实验动物 雌性SD大鼠,约250 g,7~8月龄,雄性Wistar大鼠(约320 g),SPF级,来自于贵州医科大学实验动物中心。
1.1.2主要试剂及仪器 PE conjugated anti-rat CD80(B7-1)批号12-0800、FITC conjugated anti-rat CD86(B7-2)批号11-0860、PE conjugated anti-rat CD103(αE2,DC marker)又称抗大鼠OX-62,批号 12-1030(eBioscience);牛Ⅱ型胶原(BⅡC)批号 038K3798(Sigma);Recombinant Rat GM-CSF 批号96-400-23、Recombinant Rat IL-4 批号 400-04-069111(Peprotech);NF-κB诱骗剂(NF-κB ODN Decoy)参考Xu等[7]以及Bonham等[8]的方法并根据实验需要进行改进。正义序列是:AGGGACTTTCCGCTGGGGACTTTCC,下划线标记的为与NF-κB特异性结合位点,用硫代磷酸酯修饰碱基全部(上海生工); 流式细胞仪:BD FACSAriaTM等。
1.2方法
1.2.1CIA大鼠脾脏单核细胞诱导成DC 方法见文献[9]:取大鼠脾脏于含5%双抗的1640培养基中4℃保存备用;2 mg/ml Ⅳ型胶原酶消化组织;置200目滤网研磨,收集悬液,1 500 r/min离心10 min;分离单个核细胞2 000 r/min离心20 min;PBS重悬600 r/min离心10 min,洗2 次;台盼蓝计数细胞总数和活力。调整细胞密度(3~5)×106个/ml,2 ml/孔于6孔板,37℃孵育90 min, PBS液洗涤2~3 次。加全培2 ml/孔,细胞因子GM-CSF 30 ng/ml和IL-4 20 ng/ml。隔天半量换液并补充全培及细胞因子,第8 天收获细胞。
1.2.2实验分组及处理 ①单纯DC组(Control-DC):加细胞因子直接诱导培养;②Decoy诱导DC组(Decoy-DC):在培养初,加细胞因子的同时,加入终浓度为10 μmol/L的NF-κB ODN Decoy培养;③LPS刺激DC组(LPS-DC):加细胞因子培养后第7 天加LPS,终浓度为10 μg/L;④LPS刺激Decoy-DC组(LPS-Decoy-DC):加NF-κB ODN Decoy 培养后第7 天,加LPS继续培养24 h,终浓度为10 μg/L。
1.2.3构建大鼠CIA模型 10 mg BⅡC溶解于5 ml 0.1 mol/L乙酸溶液中,4℃过夜。次日将胶原和弗氏完全佐剂按1∶1比例混匀,制成BⅡC乳剂,浓度为1 mg/ml,4℃保存。于大鼠的左足跖部皮内注射200 μl BⅡC乳剂,第14 天后于大鼠尾根部皮下以相同剂量BⅡC乳剂进行加强免疫。用相同剂量的生理盐水注射正常对照组。
1.2.4形态学观察 每天用光学倒置相差显微镜观察DC的形态学变化。
1.2.5流式细胞术检测DC表面标志 收集各组培养至第8 天的DC,细胞数调到约1×106个/ml。PBS洗涤,100 μl PBS重悬。各组加流式抗体后避光孵育40 min:PE-OX-62抗体1.25 μl/106细胞,PE-CD80抗体2.5 μl/106细胞,FITC-CD86抗体1 μl/106细胞。PBS洗2次,100 μl PBS重悬,分别培养三批次细胞进行流式检测。
1.2.6DC体外混合淋巴细胞反应 反应细胞:无菌取雄性Wistar大鼠脾脏,200目细胞筛研磨并收集悬液,1 500 r/min离心5 min,PBS洗2 次;裂解红细胞;5 ml PBS 1 500 r/min离心5 min,洗涤3 次,全培重悬,细胞调整为1×106个/ml。刺激细胞:将各组DC诱导培养第8 天后,加终浓度为25 μg/ml的丝裂霉素C,37℃孵育30 min。1 000 r/min离心10 min,PBS洗3 次。调整为2×105个/ml。5组DC均以上述方法处理。混合淋巴细胞反应:按表1中顺序加刺激细胞和反应细胞于56孔板中。共5组,每组分别设8 个复孔。37℃培养68 h。参考文献[10]确定刺激细胞和反应细胞的混合比例,最敏感比例1∶5。培养68 h后,600 r/min离心10 min,每孔取培养上清50 μl于EP管,-20℃保存。加MTT 20 μl/孔,37℃孵育4 h。2 000 r/min离心10 min,弃上清,加DMSO 100 μl/孔。酶标仪490 nm 处测定OD值。
1.2.7混合淋巴细胞反应培养基上清液细胞因子检测 将所收集标本从-20℃取出解冻并平衡至室温,采用双抗体夹心法酶联免疫吸附技术(ELISA)原理检测混合淋巴细胞反应培养基上清液中IFN-γ和IL-10的含量,具体方法参照试剂商提供的说明书进行。
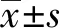
2 结果
2.1体外培养DC的形态特征 第0 天,呈单核细胞形态,各组细胞经台盼蓝染色,未染色细胞均>90%;第2 天,部分细胞悬浮,少量集落;第4~5天,形态明显不同;第6~8天,少量悬浮细胞及集落边缘见毛发样突起。贴壁细胞较多集落,细胞见细长伪足。单纯DC组加LPS后,细胞从集落中散开,细胞周边毛发样突起明显多于其他组。而Decoy-DC组和LPS的Decoy-DC组形态类似,周边毛发样突起较少。见图1。
2.2细胞表面OX-62标志检测 本实验从大鼠脾脏中提取并诱导培养成DC的OX-62表达率为56.7%。见图2。
2.3DC细胞表面CD80和CD86分子的表达情况 Decoy-DC组CD80和CD86阳性率和平均荧光强度显著低于Control-DC组(P<0.05);LPS刺激Decoy-DC组CD80和CD86阳性率和平均荧光强度显著低于LPS-DC组(P<0.05);LPS-Decoy-DC组CD80和CD86阳性率和平均荧光强度与Decoy-DC比无显著性差异(P>0.05)。见表2、图3~5。
表1 各实验组混合淋巴细胞反应处理方法
Tab.1 Treatment of mixed lymphocyte reaction in various experimental groups

GroupsReaction systemBlank control groupReaction cell 100 μl+complete 1640 medium 100 μlControl-DC groupControl-DC group stimulate cell 100 μl+reaction cell 100 μlLPS-DC groupLPS-DC group stimulate cell 100 μl+reaction cell 100 μlDecoy-DC groupDecoy-DC group stimulate cell 100 μl+reaction cell 100 μlLPS-Decoy-DC groupLPS-Decoy-DC group stimulate cell 100 μl+reaction cell 100 μl

图1 DC培养不同阶段的形态学观察Fig.1 Morphological observation of different stages of DC cultureNote:A.Day 0(×200);B.Day 2(×100);C.Day 4(×100);D.Day 5(×200);E.CIA control-DC(×200);F.CIA decoy-DC(×200);G.CIA-LPS-DC(×200);H.CIA LPS-Decoy-DC(×200).



GroupsCD80Positive rate Mean fluorescence intensityCD86Positive rate Mean fluorescence intensityControl-DC group60.87±4.35758.00±137.5840.57±7.15932.67±309.60Decoy-DC group 24.04±8.111)352.33±83.101)16.63±3.181) 375.33±15.501)LPS-DC group63.70±7.741 145.00±198.64 54.58±11.331 202.33±218.98Decoy-LPS-DC group36.83±8.502)622.00±105.262)19.66±4.862) 497.00±182.042)
Note:1)P<0.01 vs Control-DC group;2)P<0.05 vs LPS-DC group.
2.4不同组DC细胞对同种异体淋巴细胞刺激的反应 Decoy-DC组刺激淋巴细胞的能力显著低于Control-DC组(P<0.05)。LPS-Decoy-DC组刺激淋巴细胞增殖的能力明显低于LPS-DC组(P<0.05)。LPS-Decoy-DC组刺激淋巴细胞增殖能力与Decoy-DC组比,无显著性差异(P>0.05)。见表3。
2.5同种异体淋巴细胞反应中培养液上清IFN-γ和IL-10的测定结果 Decoy-DC组IFN-γ分泌能力显著低于Control-DC组(P<0.05),而IL-10分泌能力显著高于Control-DC组(P<0.05)。LPS刺激Decoy-DC组IFN-γ分泌能力显著低于LPS-DC组(P<0.05),而IL-10分泌能力显著高于LPS-DC组(P<0.05)。见表4。
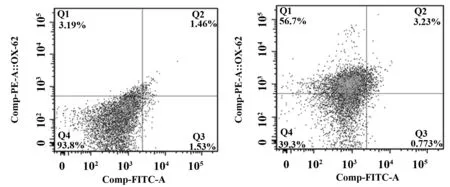
图2 DC表面OX-62标志的流式细胞术检测散点图Fig.2 Detection data of OX-62 on DC stained with PE by FCM
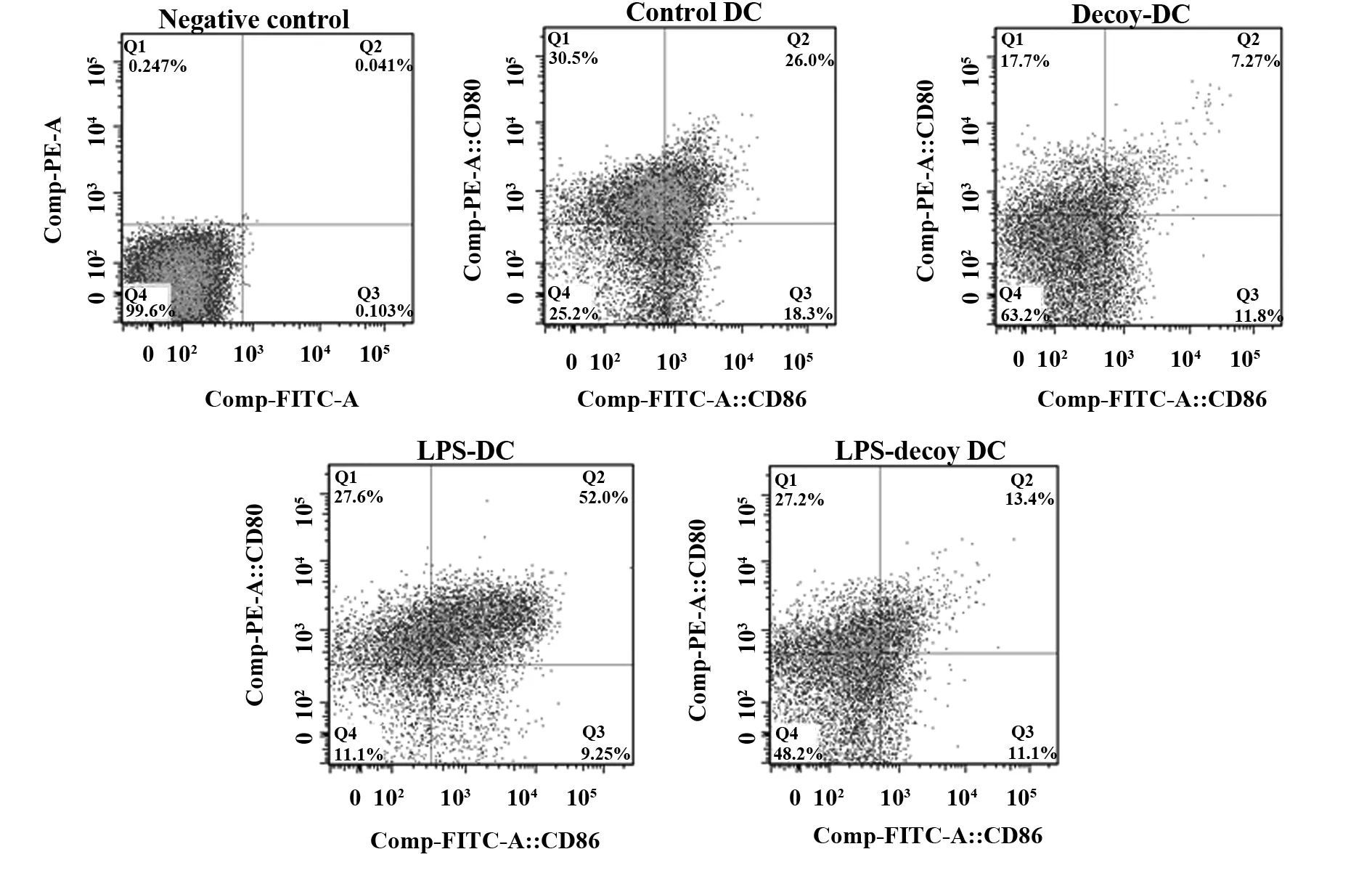
图3 各组DC细胞表面CD80、CD86表达情况的流式细胞术散点图Fig.3 Detection data of CD80 and CD86 on DC stained with PE and FITC by FCM

图4 DC表面CD80表达的流式细胞术检测直方图Fig.4 Detection data of CD80 on DC stained with PE by FCM
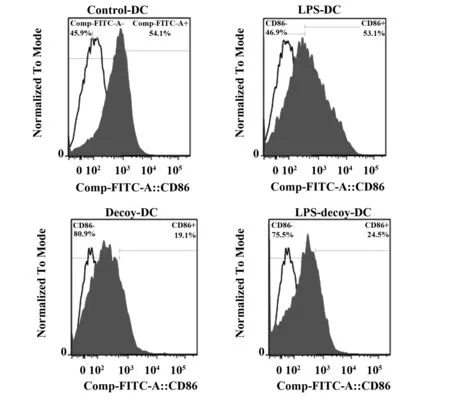
图5 DC表面CD86表达的流式细胞术检测直方图Fig.5 Detection data of CD86 on DC stained with PE by FCM



GroupsnOD valueControl-DC group80.205±0.056Decoy-DC group80.141±0.0191)LPS-DC group80.214±0.076LPS-Decoy-DC group80.170±0.0342)
Note:1)P<0.05 vs Control-DC group;2)P<0.05 vs LPS-DC group.



GroupsnIL-10(ng/ml)IFN-γ(ng/L)Control-DC group50.949±0.06743.07±13.70Decoy-DC group51.152±0.1501)24.74±0.931)LPS-DC group50.922±0.03262.31±23.44Decoy-LPS-DC group51.112±0.1812)27.77±2.332)
Note:1)P<0.05 vs Control-DC group;2)P<0.05 vs LPS-DC group.
3 讨论
类风湿关节炎是一种涉及全身多因素的自身免疫性疾病。近年来研究发现,T淋巴细胞的异常活化、增殖和细胞因子分泌失衡在RA中充当非常重要的角色。DC是一种在体内不同于巨噬细胞、B淋巴细胞的抗原递呈细胞,能唯一活化静息型T淋巴细胞,引发初次免疫应答,并能点状放大刺激,从而刺激T淋巴细胞增殖[11]。DC成熟状态的不同意味着激活T淋巴细胞的程度和反应类型不同[12]。因此在诱导T淋巴细胞活化或耐受方面,DC的成熟状态显得尤为重要。成熟DC经抗原递呈作用将共刺激分子递呈给初始T淋巴细胞,活化T淋巴细胞,激活免疫反应;未成熟DC表面低表达或缺乏B7等共刺激分子,不能有效激活T淋巴细胞,使T淋巴细胞失活或无反应,从而诱导T淋巴细胞的免疫耐受。本实验利用NF-κB ODN Decoy策略抑制CIA大鼠脾脏来源的DC成熟,最终使其成为“耐受性DC”。
通过参考文献[9]并结合本实验室情况进行改良,取CIA大鼠脾脏,经研磨及胶原酶消化法获得脾脏细胞悬液,密度梯度离心法分离单个核细胞,利用单核细胞短暂贴壁的特性去除不贴壁淋巴细胞获得单核细胞,加细胞因子GM-CSF和IL-4诱导培养成DC。检测DC表面OX62的表达率,目前虽然有一些其他细胞也表达OX-62,但因为其含量极少,故OX-62目前仍被认为是大鼠DC最特异的标志[13];并结合其特异的形态学特征和表面共刺激分子CD80、CD86等,从而鉴定所诱导培养的细胞为DC。未成熟DC具有能将ODN摄取到DC细胞内的功能,在单核细胞开始培养时和细胞因子一起加入ODN,使细胞因子诱导的DC在生长过程中便可以自动摄取ODN[7,8,14]。镜下观察,单纯培养DC组细胞形态不规则,周边毛发样突起较多,流式检测DC表面共刺激分子CD80、CD86呈高表达,呈现出相对成熟的特征。在Decoy-DC组实验中将NF-κB ODN Decoy导入DC中,细胞周边毛发样突起较少,流式检测与Control-DC组相比,DC细胞表面共刺激分子 CD80、CD86低表达,呈现出一种相对未成熟DC特征。用LPS分别对Control-DC组DC和Decoy-DC组DC进行刺激,结果显示Control-DC组DC经LPS刺激后细胞毛刺样突起增多,生长旺盛,较多DC从集落周边脱落,流式检测其共刺激分子CD80和CD86表达量增高;与Control-DC加LPS相比,Decoy-DC组加LPS后,其细胞毛刺样突起增加不明显,并且CD80和CD86表达量无明显增加。此结果与前期Jiang等[15]通过NF-κB ODN Decoy处理正常大鼠脾脏来源DC的研究结果类似。以上结果表明,ODN策略能够使其构建的耐受性DC表型稳定,不易经外界条件刺激变得成熟。进一步用培养至第8天的各组DC分别与Wistar大鼠脾脏来源的淋巴细胞混合培养,结果显示Decoy-DC组刺激混合淋巴细胞增殖能力低于Control-DC组,加LPS后其刺激能力并无明显增加。通过检测混合淋巴细胞反应中各组细胞培养基上清中细胞因子发现,Decoy-DC组混合淋巴反应中高分泌IL-10,低分泌IFN-γ,LPS刺激后结果无明显差异,而Control-DC组与之正好相反,进一步说明NF-κB ODN Decoy诱导的耐受性DC其耐受功能具有较好的稳定性。
本实验将病程中CIA大鼠脾脏细胞诱导成DC,用NF-κB特异性的ODN Decoy诱导其耐受性,发现诱导的DC表面共刺激分子同样表达低下,用LPS作用后并未明显升高。这说明虽然正常大鼠用胶原诱导成CIA模型,具有典型的类风湿关节炎症状如关节中滑膜组织炎性细胞浸润,成纤维细胞过度增生,新生血管翳形成,骨和软骨被破坏等,但并没有影响到脾脏细胞诱导成耐受性DC。
综上所述,用病程中CIA大鼠脾脏细胞经NF-κB特异性的ODN decoy诱导成功培养出耐受性DC,说明病程中CIA大鼠来源的DC和正常大鼠来源的DC特性类似,均可用NF-κB ODN Decoy策略构建稳定的耐受DC。并有望在后续CIA模型大鼠的体内实验中进一步研究该DC的治疗效果和相关机制。
