早期宫颈腺癌及腺鳞癌病人术后临床预后分析
2019-05-24冯冠男陆维仙胡群超顾科
冯冠男,陆维仙,胡群超,顾科
宫颈癌是威胁女性健康的十大恶性肿瘤之一。得益于高危型人乳头瘤病毒(HPV)疫苗及宫颈癌早期筛查的普及,作为主要病理亚型的宫颈鳞癌发病率才有所下降,但宫颈腺癌的发病率相对增加[1]。近年来,由于预防、筛查及治疗条件的限制,宫颈癌的病死率和发病率比值在我国经济欠发达地区仍有不断上升趋势[2]。
宫颈腺癌及腺鳞癌的发病率约占宫颈恶性肿瘤总体的15%~20%,其治疗参照宫颈鳞癌实施[3]。有研究认为,相对于宫颈鳞癌而言,腺癌及腺鳞癌具有不同生物学行为特征,侵袭转移性更高[4]。早期可切除宫颈癌的病人,其手术方案仍以子宫及附件切除联合盆腔淋巴结切除为主,可选择性腹主动脉旁淋巴结取样活检或切除。与同步放化疗相比,根治性手术治疗可准确获取病人病理特征信息,明确复发高危因素,有利于指导辅助治疗方案的选择[5]。本研究回顾性收集早期可手术宫颈腺癌或腺鳞癌病人资料,旨在探讨早期病人术后复发的特征、辅助治疗选择及其预后相关因素。
1 资料与方法
1.1 一般资料收集南京医科大学附属苏州医院2009年4月至2017年10月期间收治的宫颈腺癌及腺鳞癌病人资料,查阅既往病历及相关影像学、病理等检查结果。根据术前影像学及体格检查,确认术前国际妇产科联盟(FIGO)分期为ⅠA~ⅡA期早期可手术病人56例,均接受根治性手术。研究纳入的病人需有明确病理诊断,其活检或术后病理组织经两名专科病理医生诊断为宫颈腺癌或腺鳞癌(其中腺癌部分>50%)。本研究符合《世界医学协会赫尔辛基宣言》相关要求,征得病人或其近亲属同意并签署知情同意书。
1.2 观察随访指标结合门诊复查信息及电话随访结果记录病人临床预后,最后随访时间截至2018年4月28日,中位随访时间为33个月(5.3~108个月)。肿瘤复发进展需有影像学或转移灶病理活检的客观依据证实。肿瘤无病生存率(Disease-free-survival,DFS)定义为手术切除至首次复发/远处转移发生或死亡发生的随访时间;总生存率(Overall survival,OS)定义为手术切除至肿瘤进展原因引起的病人死亡。至最后一次随访结束时,病人仍未发生肿瘤局部区域复发、远处转移或死亡等定义事件,则设为截尾数据。
1.3 统计学方法本研究采用SPSS 17.0软件进行临床数据统计分析。生存率分析及比较采用Kaplan-Meier乘积限法及log-rank检验。将首诊年龄、原发肿瘤大小、FIGO临床分期、神经脉管侵犯等通常被认为可能影响病人疾病预后的临床病理学特征纳入单因素预后分析,并将其中差异有统计学意义的变量(即FIGO分期、脉管侵犯)进一步纳入Cox比例风险回归模型,以分析影响预后的独立临床及病理学特征因素。P<0.05为差异有统计学意义。
2 结果
2.1 基本临床病理特征宫颈腺癌及腺鳞癌病人56例中腺癌35例,腺鳞癌21例。病人中位年龄44岁,年龄范围为27~66岁。根据FIGO分期,病人术前分期ⅠA期8例,ⅠB1期23例,ⅠB2期9例,ⅡA期16例。临床上病人多以非经期或绝经后异常阴道出血为首发症状,仅有5例因筛查发现不典型宫颈上皮细胞增生行手术治疗而意外发现宫颈肿瘤。9例病人术前行HPV检测,其中6例为高危型阳性(1例HPV 16+,4例HPV18+,1例HPV 16/18+),由于受检病人数量尚不足总体样本量的50%,故未将HPV感染状态及分型纳入预后分析中。病人基本临床病理特征及治疗方法对预后影响的单因素分析(log-rank检验)结果如表1所示。
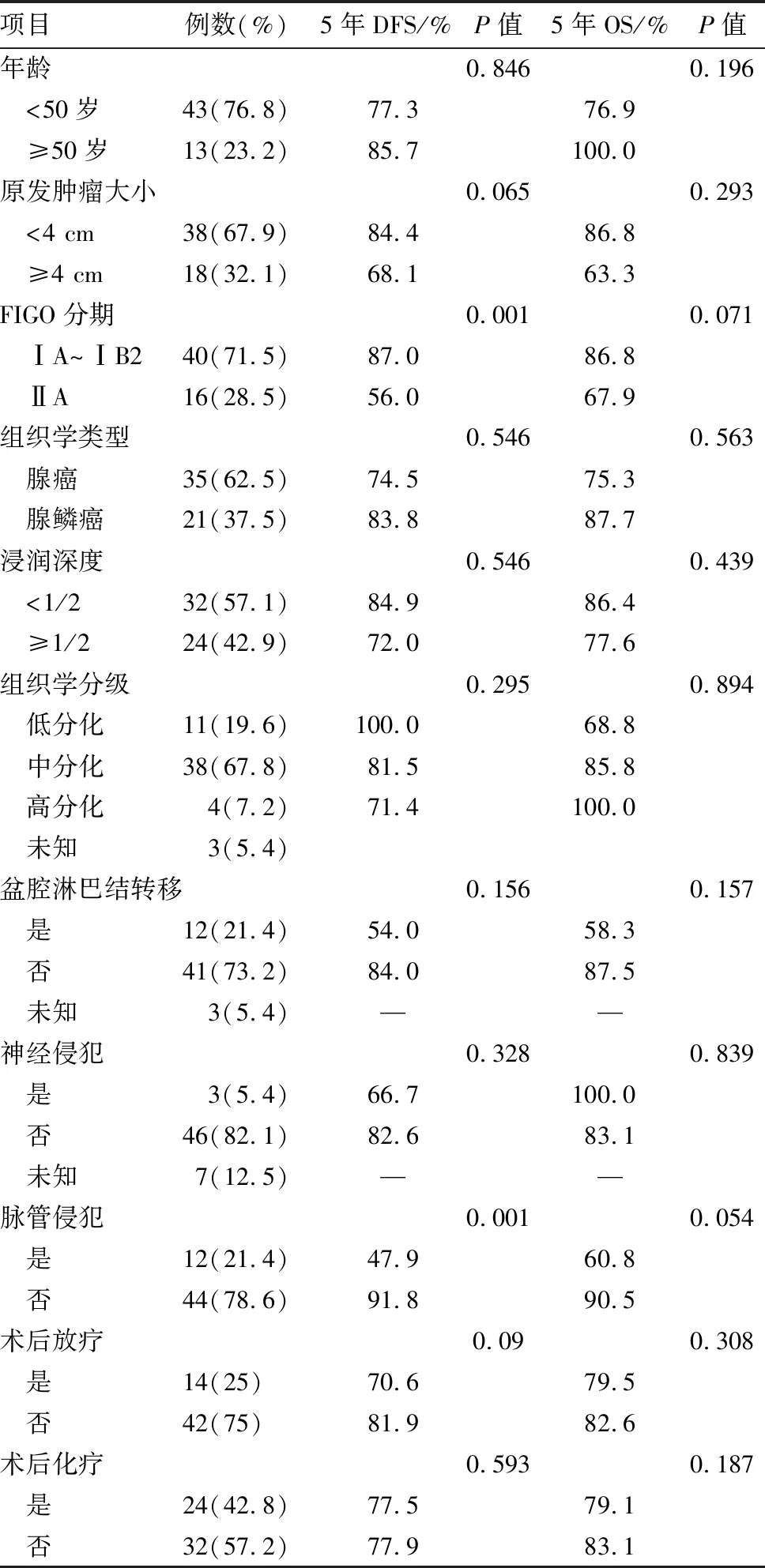
表1 宫颈腺癌及腺鳞癌病人56例病理特征及治疗方法单因素预后相关性分析
注:采用log-rank检验
3例ⅡA期病人术后病理提示仅伴有单个盆腔淋巴结转移,其中1例为原发灶腺鳞癌,转移淋巴结仅见腺癌成分。5例ⅡA期病人同时伴有2个以上复发高危因素,包括原发肿块直径>4 cm、转移盆腔淋巴结阳性、脉管癌栓阳性及神经侵犯。
2.2 治疗情况全组中共有3例FIGO分期ⅠA1早期病人未行盆腔淋巴结清扫术:1例行宫颈锥切术,另2例行筋膜外全子宫切除术。其余病人均接受广泛子宫+双侧附件切除+盆腔淋巴切除术,术后病理提示切缘阴性。术后病理提示伴有以下复发高危因素,即浸润深度≥1/2、转移淋巴结、脉管癌栓、神经侵犯或原发肿瘤直径≥4 cm等,辅助治疗阶段推荐病人行盆腔放射治疗,6MV-X线照射45~50 Gy,同期采用顺铂(35 mg/m2)或卡铂[药时曲线下面积(AUC)=2]单药每周方案化疗方案,共计4~6周期。此外,12例病人因具有多个复发高危因素(阳性盆腔淋巴结+大肿块+浸润肌肌壁全层,阳性盆腔淋巴结+脉管癌栓+神经侵犯),在同步放化疗后进一步接受了巩固化疗,化疗采用紫杉醇、铂类两药联合方案4~6个周期。随访期间,3例病人出现淋巴结及肺多灶转移,给予纳米紫杉醇(或吉西他滨)联合顺铂一线化疗,化疗期间根据病人意愿及其经济状况,加用贝伐单抗靶向药物。对于术后未接受放疗或术后放射野外的淋巴结复发灶及孤立性骨转移病灶,采用局部放疗行挽救性治疗。骨转移灶病人同时给予骨保护剂,以减少骨相关不良事件。
2.3 病人复发及生存情况(1)生存分析: 56例病人中共有6例(14.3%)出现腹盆腔淋巴结复发,1例(7.1%)出现左侧髂骨转移,3例(7.1%)出现肺转移及多发淋巴结转移;随访期间仅有6例病人出现肿瘤相关死亡。如图1所示,经计算5年DFS及OS分别为78.4%和81.6%,平均无病生存期及总生存期分别为(87.6±5.7)个月(95%CI:76.5~98.8个月),(95.3±4.8)个月(95%CI:86.0~104.7个月)。其按临床病理特征分层的生存资料可见表1。
(2)转移对生存的影响: 共10例发生淋巴结转移和(或)远处器官转移,其中8例为术前诊断ⅡA期病人,2例为ⅠB期。因此,进一步将病人分为FIGO ⅠA1~ⅠB2期与ⅡA期两组,生存分析结果提示,ⅠA1~ⅠB2期病人的DFS明显优于ⅡA期,两组5年DFS分别为87%、56%(P=0.001),如图2A所示。
(3)Cox多因素分析: 进一步建立Cox回归模型,并采用后退法(α退出=0.05)进行自变量的选择和剔除。回归结果显示:ⅡA期病人术后疾病进展风险明显增高,是ⅠA~ⅠB期的4.79倍[风险比(HR)=4.79,95%CI:1.26~18.14,P=0.021],见表2。但全组分析中,早期可手术病人的不同FIGO分期(ⅠA1、ⅠA2、ⅠB1、ⅠB2及ⅡA)对总生存并未发现显著性影响(P=0.292)。此外,术后病理提示无脉管侵犯(LVSI)的病人其5年DFS同样优于LVSI阳性的病人(91.8% 比 47.9%,P=0.001),如图2B所示。单因素分析结果如表1所示,原发肿瘤大小及其浸润深度、盆腔淋巴结转移状态及神经侵犯等复发高危因素,以及辅助放化疗的选择对于肿瘤复发均未见显著性影响。6例复发病人均在术后12个月以内出现进展,同时具有2个以上高危因素时,病人术后无复发生存间期更短(2~7个月),且表现为远处或多病灶转移。
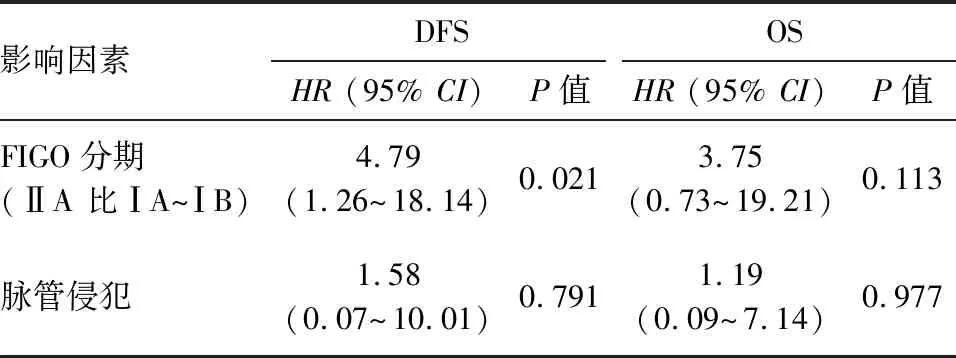
表2 早期宫颈腺癌及腺鳞癌术后病人预后影响因素的Cox多因素分析
注:DFS为无病生存率;OS为总生存率
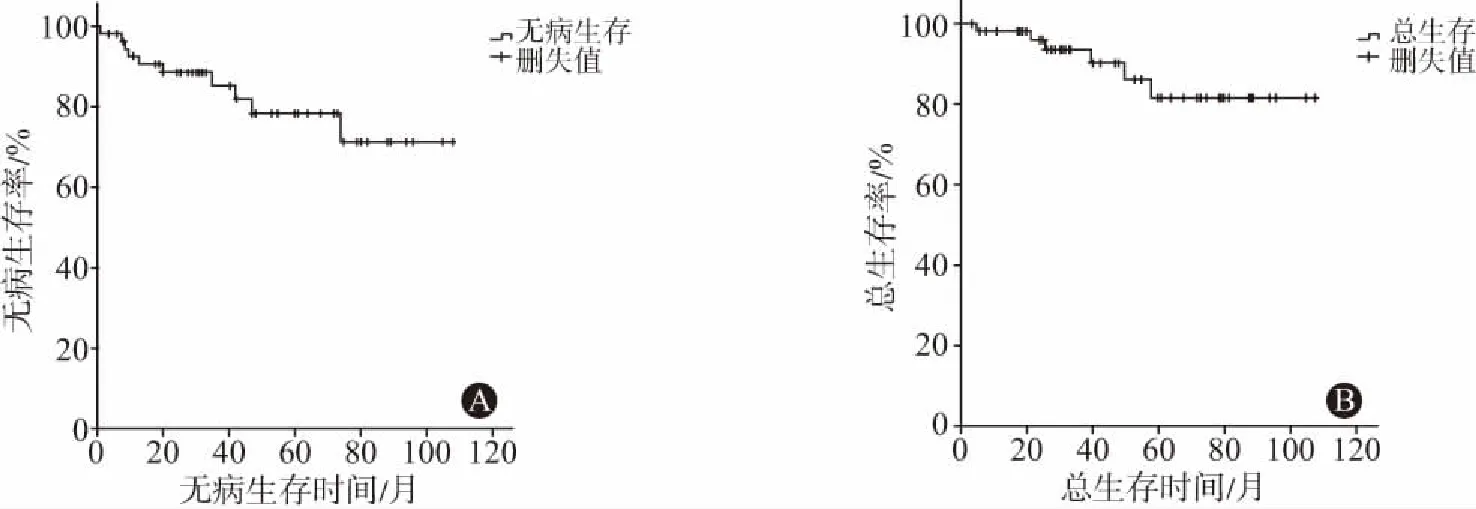
注:A图中5年DFS为78.4%;B图中OS为81.6%图1 早期宫颈腺癌及腺鳞癌病人DFS(A图)及OS(B图)曲线图
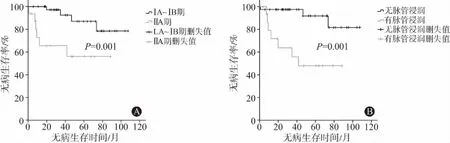
图2 早期宫颈腺癌及腺鳞癌病人不同国际妇产科联盟(FIGO)分期(A)和脉管浸润状态(B)的无病生存率图
3 讨论
近年来,宫颈腺癌整体发病率以及该亚型年轻病人的发病比例呈逐年增高的趋势,约占宫颈恶性肿瘤10%~15%,这可能与HPV感染、外源性雌激素应用及环境改变等因素有关。但技术手段改善及宫颈疾病普查的开展,有助于提高疾病检出率及30~69岁病人的早期诊断率,显著降低FIGO Ⅱ期以上宫颈腺癌的发生率[6]。然而,由于散发宫颈腺癌/腺鳞癌病人绝对数、整体发病率低,目前缺乏大样本随机临床研究为此类病人的治疗优化及疾病预后提供高级别循证医学数据支持。临床实践依旧参照宫颈鳞癌,建议早期宫颈腺癌/腺鳞癌病人行根治性手术治疗,术后根据其是否存在复发高危因素推荐术后辅助放/化疗。
总体而言,FIGO分期仍是目前较为公认的影响宫颈腺癌/腺鳞癌疾病预后的重要因素。Chargui等[7]回顾性分析了79例宫颈癌病人,其中一半以上为早期宫颈腺癌。研究结果提示,5年OS及DFS分别为68.0%、72.4%。年龄>50岁、原发肿块直径>4 cm、肿瘤FIGO分期、组织学分级及淋巴结转移状态、淋巴脉管浸润均是复发进展的高危因素,其中FIGO分期和淋巴结转移状态是影响生存的独立预后因子。Lai等[8]也证实年龄大、肿瘤临床分期及HPV阴性是导致宫颈腺癌/腺鳞癌预后不良的因素。对于HPV16阴性的早期腺癌/腺鳞癌(FIGO分期Ⅰ~Ⅱ期),彻底的手术切除可改善疾病控制及生存预后。本研究纳入分析的病人中半数以上为小于50岁的未绝经女性,临床分期Ⅰ期病人比例较高,总体治疗耐受性良好。就FIGO分期对病人生存预后的影响而言,本研究得到了与既往研究一致的结果:术前临床分期是影响DFS的重要因素,出现盆腔区域复发及远处转移的10例病人中,8例术前诊断均为ⅡA期。多因素分析结果提示,可手术ⅡA期病人在肿瘤完全切除后仍可能有更高的疾病复发风险,进一步分析发生疾病进展的案例时发现,随着临床分期的提高,病人往往有更高概率伴随其他复发高危因素。本研究16例ⅡA期病人中,仅1例病人不伴有复发高危因素。而具有原发大肿块、淋巴结转移或淋巴脉管侵犯等危险因素时,3例病人在术后半年内即出现腹盆腔多发淋巴结转移或远处多器官转移。因而推测,原发大肿块、术后病理提示具有多个危险因素的病人或有早期复发倾向,其淋巴结及远处转移的风险相对更高。因此,我们认为若术前采取PET-CT检查评估有助于提高腹主动脉旁淋巴结的检出率,提高临床分期诊断的准确性,可早期判断高危因素状况,有利于术后及时采取积极的辅助治疗以提高疾病控制率[9]。
理论上,宫颈腺癌细胞相对于鳞癌有更高的转移倾向。腺鳞癌定义为同时具有腺癌及浸润性鳞癌成分的混合性亚型,以腺癌成分为主的腺鳞癌与腺癌均被认为具有肿瘤侵袭力强、转移发生率高的特性,两者的临床预后具有相似性。Mabuchi等[10]回顾性分析了163例ⅠA2~ⅡB期宫颈腺癌/腺鳞癌,结果证实早期术后病人两种病理亚型其无进展生存期(PFS)相似,但若伴有盆腔淋巴结转移或宫旁侵犯,PFS明显降低。由此认为,淋巴结转移可能是影响宫颈腺癌及腺鳞癌的重要预后因素。本研究中,淋巴结转移状态并未显示出对生存预后的显著性影响(DFS:P=0.156,OS:P=0.157),但单因素分析结果提示,淋巴脉管侵犯状态对病人的无病生存具有重要意义,脉管侵犯阴性的病人5年DFS更优(91.8% 比 47.9%,P=0.001)。从疾病复发的模式来看,10例复发转移病人,除1例复发灶为孤立性骨转移,余复发灶均为淋巴结或伴有淋巴结转移的多灶复发。这与Twu等[11]的结果相似,脉管侵犯常与原发大肿块、间质深度浸润及淋巴结转移伴随形成多个高危因素,进而可影响宫颈腺癌的疾病相关生存率。同时,伴有淋巴脉管浸润的病人其淋巴结转移发生的风险明显增加(47% 比 7%)[7]。由此推测,淋巴脉管侵犯状态可影响淋巴结转移发生率,或为影响宫颈腺癌/腺鳞癌疾病进展的重要因素。
本研究中5年DFS为78.4%,且DFS间期较短(2~20个月)。与既往文献相比,本研究中病人的疾病控制率略偏低,这可能与术后辅助治疗的覆盖率偏低有关。术后盆腔辅助放疗的应用率尚不足1/3,同期化疗仅为20%左右,这对盆腔淋巴结区域复发存在潜在影响[9]。但就总生存率而言,本研究随访结果与既往报道结果相似。这与研究涉及的疾病复发(7/10)多以单一区域淋巴结或孤立转移灶为进展表现有关。无盆腔侧壁固定的中心性复发,有利于局部区域的挽救性治疗实施;同时,无病间期大于6个月,复发灶最大直径不大于3 cm,复发灶局部区域的可及性有助于提高解救治疗的可治愈性,改善病人OS率[12]。
由于宫颈腺癌/腺鳞癌的发病率相对较低,临床实践尚缺乏统一的诊疗共识。来自SEER数据库近万例的研究结果表明,对于早期可手术宫颈鳞癌或腺癌病人(FIGO Ⅰ~Ⅱ期),手术完全切除且排除淋巴结转移等危险因素前提下,两种病理分型的疾病局部及区域控制率,乃至生存预后均相似,10年OS分别为89.6%和92.2%[13]。但因流行病学数据对肿瘤治疗、复发高危因素等特征性数据采集不足,该研究未能对肿瘤浸润深度、脉管侵犯等重要因素进行严格评价。而受限于宫颈腺癌发病率及单中心集中收治病例数等制约因素,倾向配比评分法也难以对多个复发风险因素同时进行有效基线校准。因而,除FIGO分期以外,临床实践中对于其他影响早期宫颈腺癌/腺鳞癌的确切预后因素仍存在争议[14-15]。
尽管本研究单中心收集的宫颈腺癌/腺鳞癌数量有限,HPV筛检及随访时间等方面确实存在些许不足,但复发案例的疾病进展模式依旧验证了初诊时肿瘤分期对预后的重要影响。而对于发病率较低的宫颈腺癌/腺鳞癌亚型,我们更需要多中心共同参与的真实世界的研究,进一步扩展病例收集,延长随访观察时间,积累完整的疾病复发、生存事件数,建立各复发高危因素的风险统计模型,方有助于全面评价同一临床分期下临床病理特征对早期术后病人预后的影响。
综上所述,宫颈腺癌及腺鳞癌的发病率相对较低,而腺癌成分高于50%的腺鳞癌其生物学行为接近腺癌,具有较高的复发转移风险。对于早期可手术宫颈腺癌/腺鳞癌,FIGO分期及肿瘤的脉管侵犯状态是影响疾病复发进展的重要因素,同一临床分期条件下需重视伴随的复发风险因素。
