LINC00152 在胰腺癌中的表达及临床意义
2019-05-24雷珊曾智锐薛燕兰金芝孙远梅陈腾祥
雷珊 曾智锐 薛燕 兰金芝 孙远梅 陈腾祥,
贵州医科大学1基础医学院生理学教研室,2贵州省再生医学重点实验室(贵阳550004)
胰腺癌是消化系统常见的恶性肿瘤,因早期极易发生侵袭转移且缺乏特异性的诊断指标,大多数患者发现时已属晚期[1],手术是目前治疗胰腺癌有效的手段之一,但复发率极高。至今,胰腺癌的病因及发展机制尚不清楚,仍缺少有效的靶向治疗靶点及分子标志物[2]。有研究表明,胰腺癌的发展是一个多步骤、多因素参与的过程,因此从分子水平阐明胰腺癌发生、转移的分子机制,寻找特定有效的靶向治疗分子靶点可能是早期诊断和治疗胰腺癌的重要手段之一[3-4]。
长链非编码RNA(long non-coding RNA,lncRNA)是转录本的长度超过200 个碱基序列且自身没有编码蛋白能力的RNA,主要是通过基因的转录、翻译以及染色体重构等多种途径参与基因表达,具有调节各种生物过程的潜力[5]。研究表明,LncRNA 的表达与多种疾病发生发展相关,例如LncRNA ROR 在胰腺癌组织中高表达且促进胰腺癌细胞增殖[6],LncRNA PVT1 促进鼻咽癌细胞的增殖转移[7]等。然而在最新研究报道中,LINC00152 在多种恶性肿瘤中异常表达,促进肿瘤的发展[8-9]。且在本课题前期筛选基因时发现LINC00152 在胰腺癌组织中异常高表达。基于此,本研究进一步通过qRT-PCR 法检测6 株人胰腺癌细胞系和人胰腺导管上皮细胞、胰腺癌组织和癌旁组织中LINC00152 的表达情况,并进一步探讨其与患者临床病理特征及其预后的关系,为胰腺癌的治疗和预后分析提供新的标志物。
1 材料与方法
1.1 细胞及组织人胰腺癌细胞系PANC-1,MIA PaCa-2,Panc 03.27,AsPC-1,SW1990,CFPAC-1 和人胰腺导管上皮细胞HPDE 均购自美国模式培养物集存库,细胞均采用在10% 胎牛血清、高糖DMEM 培养基、5%CO2、37 ℃的条件下培养,每2 天更换一次新鲜培养基,融合度达85%左右进行传代。状态好的细胞用于后续实验。组织标本从华中科技大学同济医学院和贵州医科大学附属医院临床样本库中获得胰腺癌组织及其癌旁组织共100 例,所有患者在手术前均未进行放疗、化疗及生物免疫治疗等任何抗肿瘤治疗,并且未合并其他器官的恶性肿瘤。全部标本均由组织学确诊。100 例组织中,男63 例,女37 例;年龄<60 岁有47 例,≥60 岁有53 例;肿瘤直径<3 cm 有53 例,肿瘤直径≥3 cm 有47 例;TNM 分期:Ⅰ+Ⅱ期有68例,Ⅲ+Ⅳ期有32例;发生淋巴结转移的有49例,未发生淋巴结转移的有51 例,实验标本的使用均获得了患者本人及其家属的同意,实验过程均由伦理委员会证实符合伦理学规范。
1.2 试剂及仪器高糖DMEM 培养基、胎牛血清(FBS)均购自Gibco 生物公司(美国),TRIzol 试剂购自Invitrogen 生物公司(美国);PCR 相关试剂及逆转录试剂盒均购自TaKaRa 生物公司(日本);LINC00152 和内参GAPDH 引物设计及合成皆由武汉天一辉远有限公司完成。荧光PCR 检测系统购自BIO-RAD(美国)。
1.3 检测组织和细胞中LINC00152 的表达用TRIzol 法提取组织及细胞中的总RNA,总RNA 经过70%乙醇洗涤后用无酶水稀释,取1 μL 稀释后的RNA 滴加在用分光光度计中,检测提取的总RNA 的浓度及纯度,测得的RNA 的吸光度(A)值,其中RNA的A260 nm/A280 nm 在1.8~2.0范围内的为合格样品,用于逆转录和PCR 反应。取1 000 ng的总RNA,按照TaKaRa 试剂盒的说明书进行逆转录;以逆转录好的cDNA 为模板,qRT-PCR 试剂盒和引物为试剂,按照公司提供的PCR 的反应步骤,进行实时荧光定量PCR 反应。结果以GAPDH 作为内参,采用2-ΔΔCt法计算LINC00152 的相对表达量。LINC00152 上游引物序列:aaaatcacgactcagccccc,LINC00152 下游引物序列:aatgggaaaccgaccagacc;GAPDH 上游引物序列:ggagcgagatccctccaaaat,GAPDH 下游引物序列:ggctgttgtcatacttctcatgg。
1.4 统计学方法实验数据均采用SPSS 18.0 软件进行统计学分析。实验结果以± s 表示,组间比较用t 检验表示,不同处理组间采用单因素方差分析,LINC00152 的表达与患者的临床性状关系采用卡方分析;生存分析采用Kaplan-Meier 生存曲线描绘及分析。P<0.05 表示差异有统计学意义。
2 结果
2.1 LINC00152 在人胰腺癌细胞系和人胰腺导管上皮细胞系中的表达实时荧光定量PCR 结果显示:以HPDE 细胞中的LINC00152 表达水平(1.01±0.02)作为对比,PANC-1、MIA PaCa-2、Panc 03.27、AsPC-1、SW1990、CFPAC-1 的LINC00152 相对表达水平分别为:(3.01 ± 0.12)、(2.84 ± 0.03)、(2.56 ±0.16)、(2.36 ± 0.21)、(2.24 ± 0.06)、(2.16 ± 0.14)。6 种人胰腺癌细胞系PANC-1,MIAPaCa-2、Panc 03.27、AsPC-1、SW1990、CFPAC-1 中LINC00152 的表达水平显著高于人胰腺导管上皮细胞系HPDE,差异结果有统计学意义(P<0.01)。见图1。
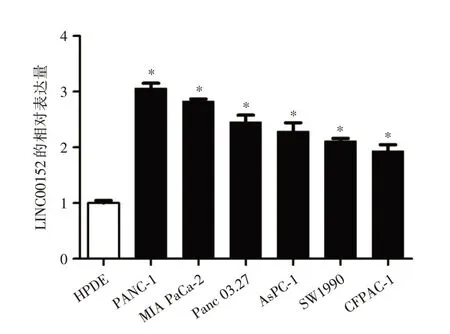
图1 LINC00152 在人胰腺癌细胞系和人胰腺导管上皮细胞系中的表达Fig.1 Expression of LINC00152 in human pancreatic cancer cells and human pancreatic ductal cell
2.2 LINC00152 在胰腺癌组织和癌旁组织中的表达采用实时荧光定量PCR 检测LINC00152 在胰腺癌组织和临近的癌旁组织中的表达。结果显示,LINC00152 在人胰腺癌组织和相对应的癌旁组织中相对表达水平分别为(1.02±0.14)、(8.48±0.46)。与癌旁组织相比,胰腺癌组织中LINC00152的表达水平显著升高差异有统计学意义(P<0.01)。见图2。

图2 人胰腺癌组织和癌旁组织中的LINC00152 表达水平Fig.2 Expression of LINC00152 in human pancreatic cancer tissuse and adjacent pancreatic tissuse
2.3 LINC00152 表达与胰腺癌患者临床病理参数的关系以LINC00152 的表达水平均值为界值,将患者分为LINC00152 高表达(≥7.55)组(n=50)和LINC00152低表达(<7.55)组(n=50),用卡方检验分析LINC00152 的表达与胰腺癌患者在临床上的病理特征之间的关系。结果显示,LINC00152的表达与肿瘤淋巴结是否发生转移及临床分期密切相关(均P<0.05),而与患者的肿瘤直径的大小、性别及年龄无关(均P>0.05),见表1。
2.4 胰腺癌组织中LINC00152 表达水平与胰腺癌患者预后的关系将100 例胰腺癌患者分为LINC00152 高表达组和LINC00152 低表达组,进行Kaplan-Meier分析,结果显示,相对于LINC00152低表达组,高表达组患者的生存率明显下降,差异具有统计学意义(P<0.05),表明癌组织中LINC00152表达水平可影响患者预后。见图3。
3 讨论
作为消化系统的恶性肿瘤,胰腺癌已跃居恶性肿瘤死亡的第4 位,全世界胰腺癌的发病率与死亡率逐年增长,到2030年胰腺癌预计成为第二大癌症死亡原因[10-11],80% 的癌症患者在确诊时已经发现有局部转移[12]。手术是主要治疗方式,虽然胰腺癌的手术及化疗取得了一定进展,然而目前胰腺癌治愈性切除率仅5% ,且术后并发症多,导致手术疗效不尽如人意[13]。转移复发是其治愈率低的主要原因,这个问题无法通过手术解决,而早期诊断和靶向治疗可以成为综合治疗的手段弥补手术治疗的不足。分子靶点包括了DNA和蛋白质,而今年来非编码的RNA 也发现参与了基因和蛋白质的表达调控,和肿瘤的发生发展息息相关。
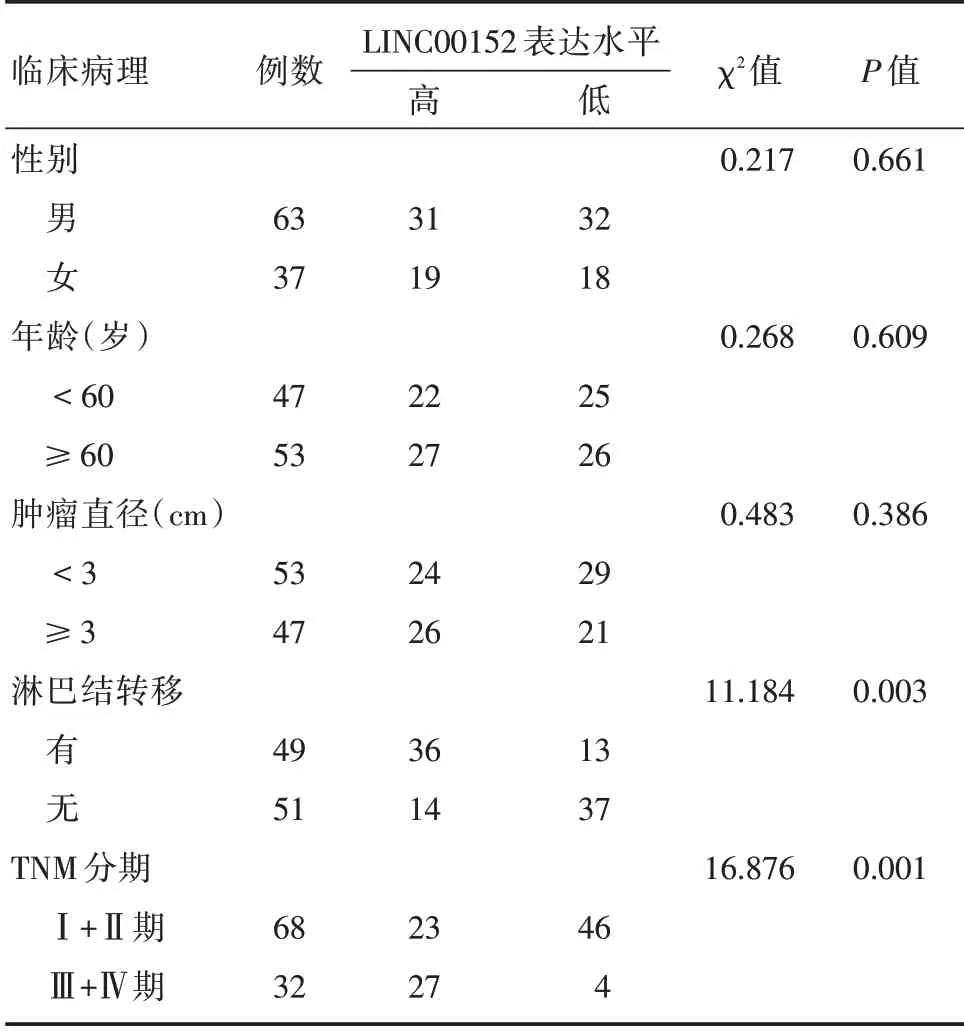
表1 胰腺癌组织中LINC00152 的表达水平与胰腺癌患者临床病理参数的关系Tab.1 The expression of LINC00152 in pantients with pancreatic cancer and corresponding clinical data 例
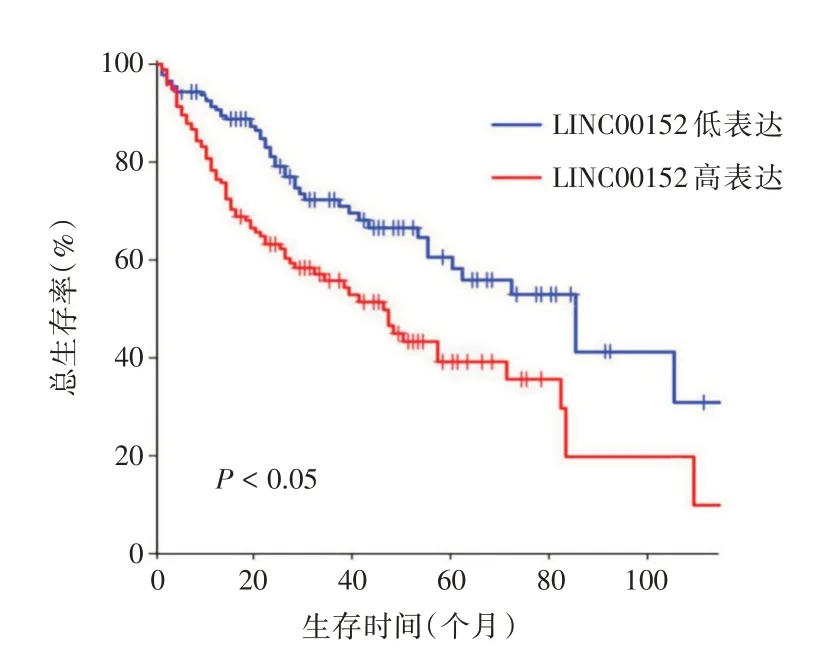
图3 胰腺癌组织中的不同LINC00152 的表达水平患者的Kaplan-Meier 生存曲线Fig.3 Kaplan-Meier survival curve was performed to detect the effect of LINC00152 on pancreatic cancer patient outcome
在非编码的RNA中,长链非编码RNA(lncRNA)也参与的基因的表达调控,是表观遗传学中的重要内容。已经发现,lncRNA 在多种癌症中表达异常,通过基因表达调控,参与了肿瘤细胞的增殖、凋亡、侵袭及迁移生物学和病理生理学过程,是目前的研究热点之一[14]。有研究表明,LINC00152 在多种恶性肿瘤组织的表达水平出现异常,如SUN等[15]报道LINC00152 作为miR-497 的竞争性内源RNA 下调其下游靶脑源性神经营养因子BDNF,从而促进如乳头状甲状腺癌的侵袭和转移;CHEN等[16]发现,LINC00152 在卵巢癌组织和细胞系中表达显著上调,LINC00152 的基因沉默可以抑制癌细胞增殖,诱导癌细胞凋亡,从而抑制肿瘤生长。目前,有关LINC00152 在胰腺癌中表达情况的研究甚少。
本研究检测了人胰腺癌细胞系PANC-1,MIA PaCa-2,Panc 03.27,AsPC-1,SW1990,CFPAC-1 和人胰腺导管上皮细胞系HPDE 中LINC00152 的表达水平,结果发现相对于人胰腺导管上皮细胞系HPDE,LINC00152 在其它6 株胰腺癌细胞系均有不同程度的表达上调。本研究还检测了100例胰腺癌临床病例的癌组织及癌旁组织中LINC00152 的表达水平,结果发现相对于癌旁组织,LINC00152在癌组织中表达显著增高;进一步统计分析发现,LINC00152 的表达与患者的淋巴结是否发生转移及TNM 分期密切相关,与患者的肿瘤直径的大小、性别及年龄等因素没有相关性,提示LINC00152表达的上调与胰腺癌转移有着密切的相关性。
然而,LINC00152 在胰腺癌中的表达上调是否影响胰腺癌的预后,目前还没有报道。本研究选取了100 例胰腺癌患者,根据表达水平,将患者分为LINC00152 高表达组和LINC00152 低表达组,通过病人后期的随访信息,绘制了生存曲线。结果发现,LINC00152 高表达组的患者存活时间较短,预后较差,而LINC00152 低表达组患者存活时间较长,预后相对较好。这个结果与其他课题组在胃癌、宫颈癌和肝癌中的发现相一致[17-19],提示LINC00152 可以作为判断胰腺癌预后的分子生物学标志物。
综上所述,胰腺癌中LINC00152 表达异常增高,是影响患者预后的危险因素,本研究为胰腺癌的靶向治疗以及预后分析提供了新的方向。
