高铝硼硅酸盐玻璃的介电特性及机理
2019-05-24郭宏伟LongxingChi李明阳赵聪聪党梦阳
郭宏伟, 童 强, Longxing Chi, 李明阳, 赵聪聪, 党梦阳
(1.陕西科技大学 材料科学与工程学院, 陕西 西安 710021; 2.Department of Materials Science and Engineering, McMaster University, Canada Hamilton, L8S4L8)
0 引言
薄膜晶体管液晶显示器通常被简称为TFT-LCD.TFT-LCD基板玻璃已成为TFT-LCD发展的关键原材料之一,其在显示器中的作用主要有两个:其一是能够使液晶保持一定的厚度;其二是承载驱动所必须的透明电极以及开关元件[1],因此TFT-LCD基板玻璃是显示器面板的结构基础也是重要组成部分,它属于高铝的硼硅酸盐玻璃系统.TFT-LCD又被称为AM-LCD(Active Matrix Liquid Crystal Display,有源矩阵型液晶显示器),它是把微电子技术和液晶显示技术结合在一起的高新产品.因其有效显示尺寸大、清晰度高、重量轻、低能耗、环保性能好等优势而受到广大消费者的认可,被广泛应用于可视电话、数显手表、数字播放器、数码照相机、手机、游戏机、摄像机等小型终端显示设备以及液晶电视、掌上电脑、笔记本电脑、多媒体显示器、计算机显示器和监视器等大型设备及各类数字多媒体产品等[2].
近十年来,半导体工业界对低介电常数材料的研究日益增多,而关于玻璃介电性能的研究源于玻璃纤维在集成电路工艺的应用.玻璃的介电性能已成为决定其在电子领域应用的指标之一.随着手机、平板电脑等电子产品的迅速普及,对高性能显示材料的需求和功能要求也日益增长.目前对于玻璃纤维的介电性能有较多的研究报道,但是关于电子基板玻璃的介电性能研究少有报道.电子基板玻璃作为显示器的基础材料,同样要求较低的介电常数.目前电子基板玻璃市场,主要由美国康宁、日本旭硝子、电气硝子和Avanstrate所垄断[3],国内的电子基板玻璃研究起步较晚但也在不断发展.电子基板玻璃是铝硼硅酸盐系统,另外为了满足性能要求用碱土金属氧化物完全取代了碱金属氧化物.电子基板玻璃大尺寸、轻薄化以及节能是未来的发展方向,对于电子基板玻璃的介电性能要求也会越来越高.
1 实验部分
1.1 样品制备
在实验室条件下,SiO2、Al2O3、B2O3分别采用高纯石英砂、硼酐和高纯氧化铝引入,所需的碱土金属氧化物CaO、SrO、MgO和BaO则通过相应的碳酸盐原料引入.SnO2由实验室用分析纯化学原料引入,SnO2在玻璃化学组成中作为氧化还原型澄清剂,在温度降低时吸收玻璃液中残留的O2,再次形成SnO2,使玻璃液中的气泡缺陷减少.
实验主要步骤如下:实验前,预先将氧化铝坩埚放入熔炉中,然后随熔炉升温到1 400 ℃预热;加入配合料,升温到1 680 ℃,保温4 h.熔制结束后,取出玻璃样品,移入退火炉中,在760 ℃下进行退火,冷却至室温.取出玻璃样品,按照各项性能测试要求对玻璃样品进行切割、研磨抛光以备测试.按照添加量的不同,实验设计如表1所示.
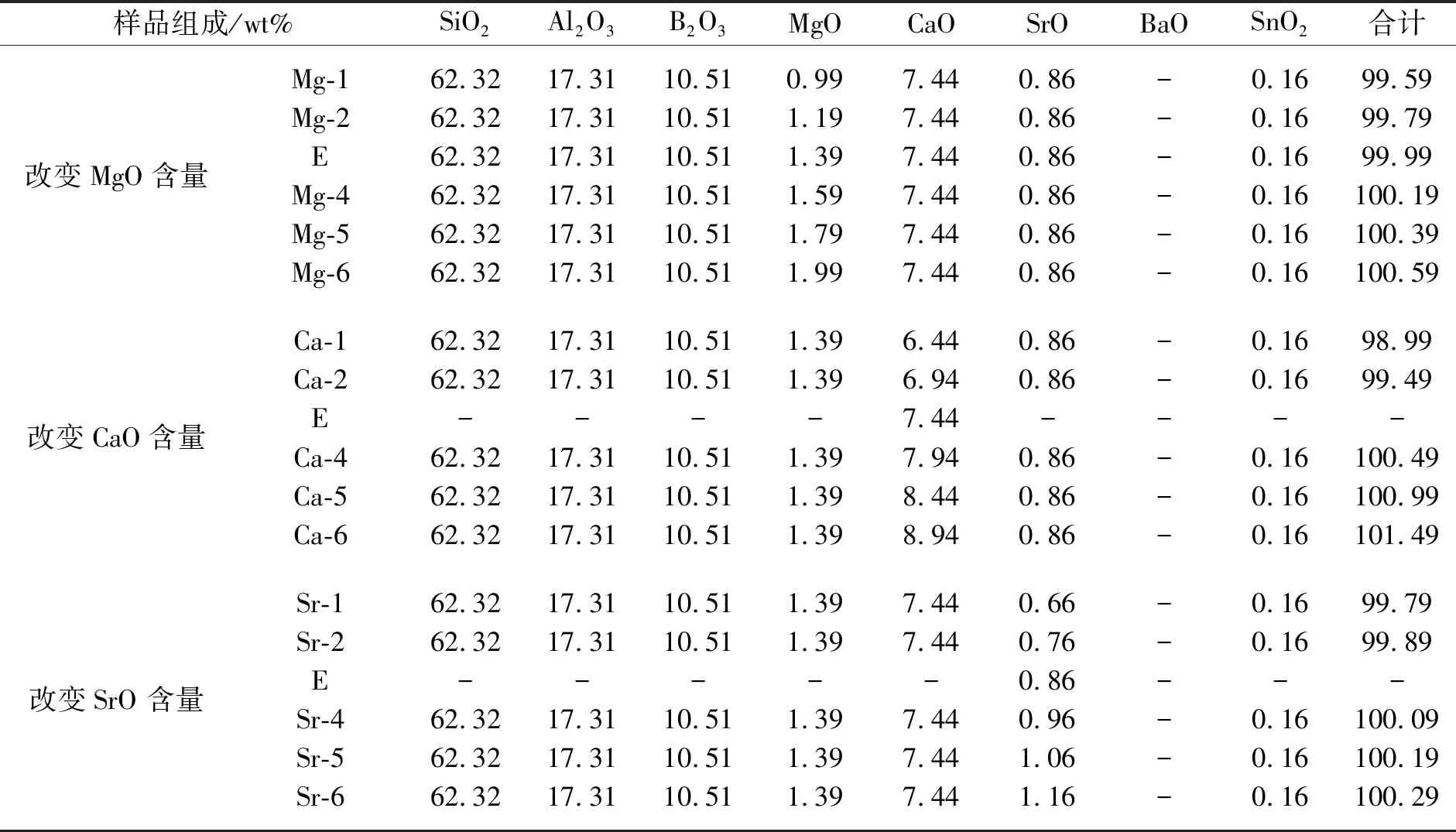
表1 掺入不同含量碱土金属氧化物的样品实验配方
续表1

样品组成/wt%SiO2Al2O3B2O3MgOCaOSrOBaOSnO2合计改变BaO含量EBa-2Ba-3Ba-4Ba-5Ba-6-62.3262.3262.3262.3262.32-17.3117.3117.3117.3117.31-10.5110.5110.5110.5110.51-1.391.391.391.391.39-7.447.447.447.447.44-0.860.860.860.860.8600.200.400.600.801.00-0.160.160.160.160.16-100.19100.39100.59100.79100.99
1.2 样品表征
本实验利用阿基米德法[4]来测定所制得的高铝硼硅玻璃的密度.随后根据公式(1)来计算玻璃的密度.在室温t下,玻璃样品的密度的计算公式如式(1)所示:
(1)
式(1)中:ρt—在室温下玻璃样品的密度,g/cm3;m1—样品在空气中的质量,g;m2—样品和金属丝在蒸馏水中的质量,g;m3—金属丝在蒸馏水中的质量,g;ρ1—空气密度,g/cm3;ρ2—蒸馏水密度,g/cm3.
将高铝硼硅玻璃切割成15×10 mm,高度约为1~2 mm的薄片,之后将样品用超声波清洗仪清洗后,在样品两面镀上低温银浆,构成平行板电容器,在550 ℃下保温0.5 h后随炉降温.采用E4980A的精密阻抗分析仪来测量样品的电容,根据公式(2)来计算样品的介电常数.在室温下,玻璃样品的介电常数的计算公式如式(2)所示:
(2)
式(2)中:εr—玻璃样品的介电常数,F/m;c—实际测量出来的电容,F;d—玻璃厚度,m;ε0—真空介电常数为8.85×10-12F/m;S—镀银的面积,m2.
2 结果与讨论
2.1 密度
图1是掺入不同含量MgO、CaO、SrO和BaO的密度变化规律.图1(a)、(b)分别为随着MgO和CaO含量的增加,其密度呈现出增大的趋势;图1(c)为随掺入SrO含量的增加,密度呈现出先增加后减小的趋势,在SrO含量为0.96wt%处出现极大值ρ=2.394 3 g/cm3;图1(d)为随BaO含量的增加,密度呈现出先减少后增加的趋势,在BaO含量为0.8 wt%处出现了极小值为ρ=2.381 5 g/cm3.
碱土金属氧化物(MgO、CaO、SrO、BaO)是网络外体,在玻璃结构中起到填充网络空隙的作用.加入半径较小的阳离子如Mg2+、Ca2+、Sr2+等填充了网络的空隙,虽然导致硅氧四面体连接的断裂,但是并不会引起网络结构的扩大,使得结构紧、密度增大[5],因此图1(a)、(b)和(c)都呈现出增加的趋势.图1(d)是随着BaO含量的增加,密度呈现出先增大后减小的趋势,其原因为加入半径较大的阳离子如Ba2+等,由于它们半径和网络空隙相比,其半径比较大,因此使网络结构扩张,导致密度下降.同时,由于碱土金属氧化物的不断加入,提供的游离氧增多,[BO3]逐渐转化为[BO4],把结构中由于碱土金属氧化物加入而断裂的键连接起来,且[BO4]的体积比[SiO4]的体积小,密度增加,因此图1(d)后半段密度呈现增加的趋势.
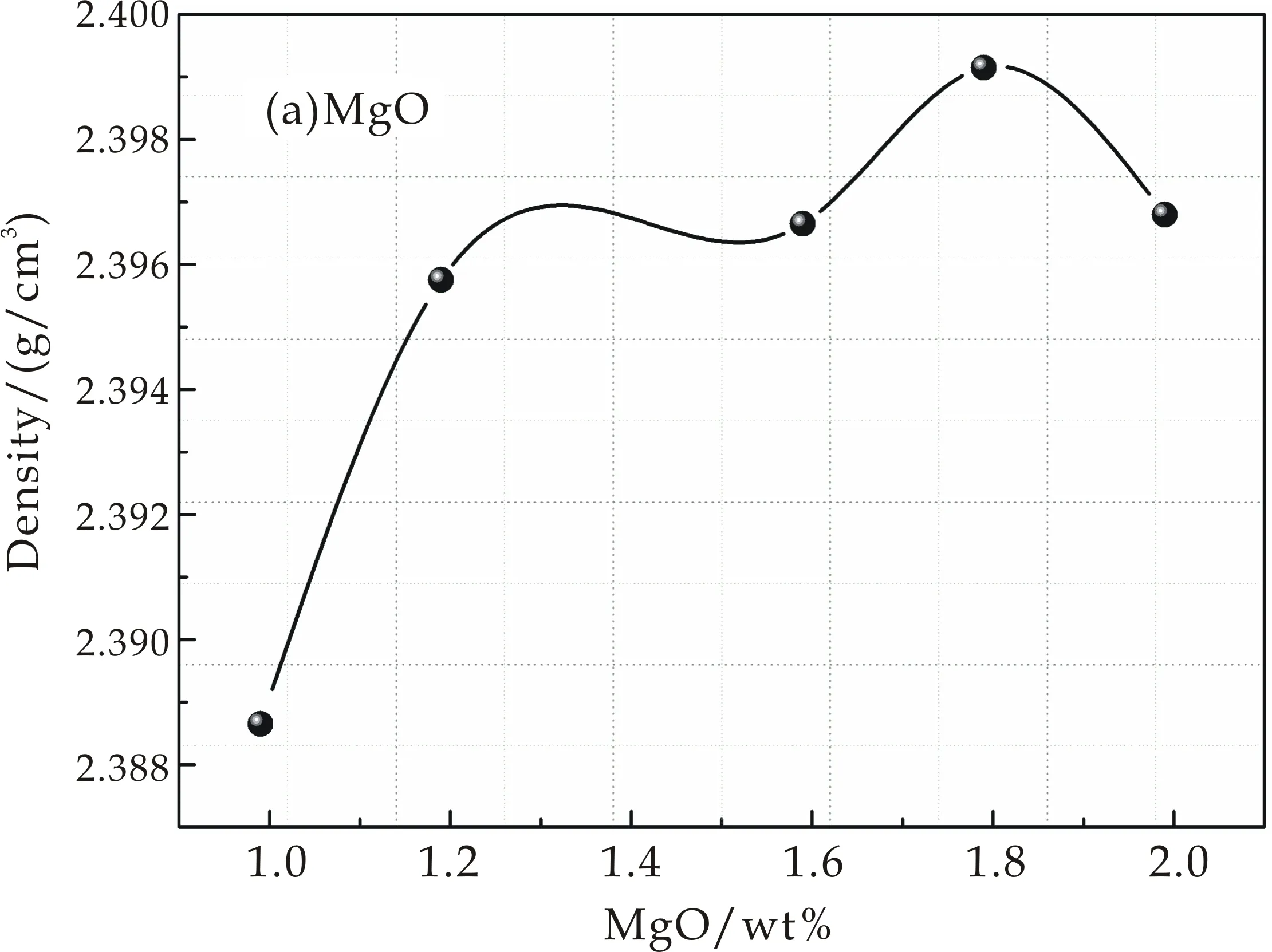
(a)添加MgO的密度变化规律

(b)添加CaO的密度变化规律

(c)添加SrO的密度变化规律
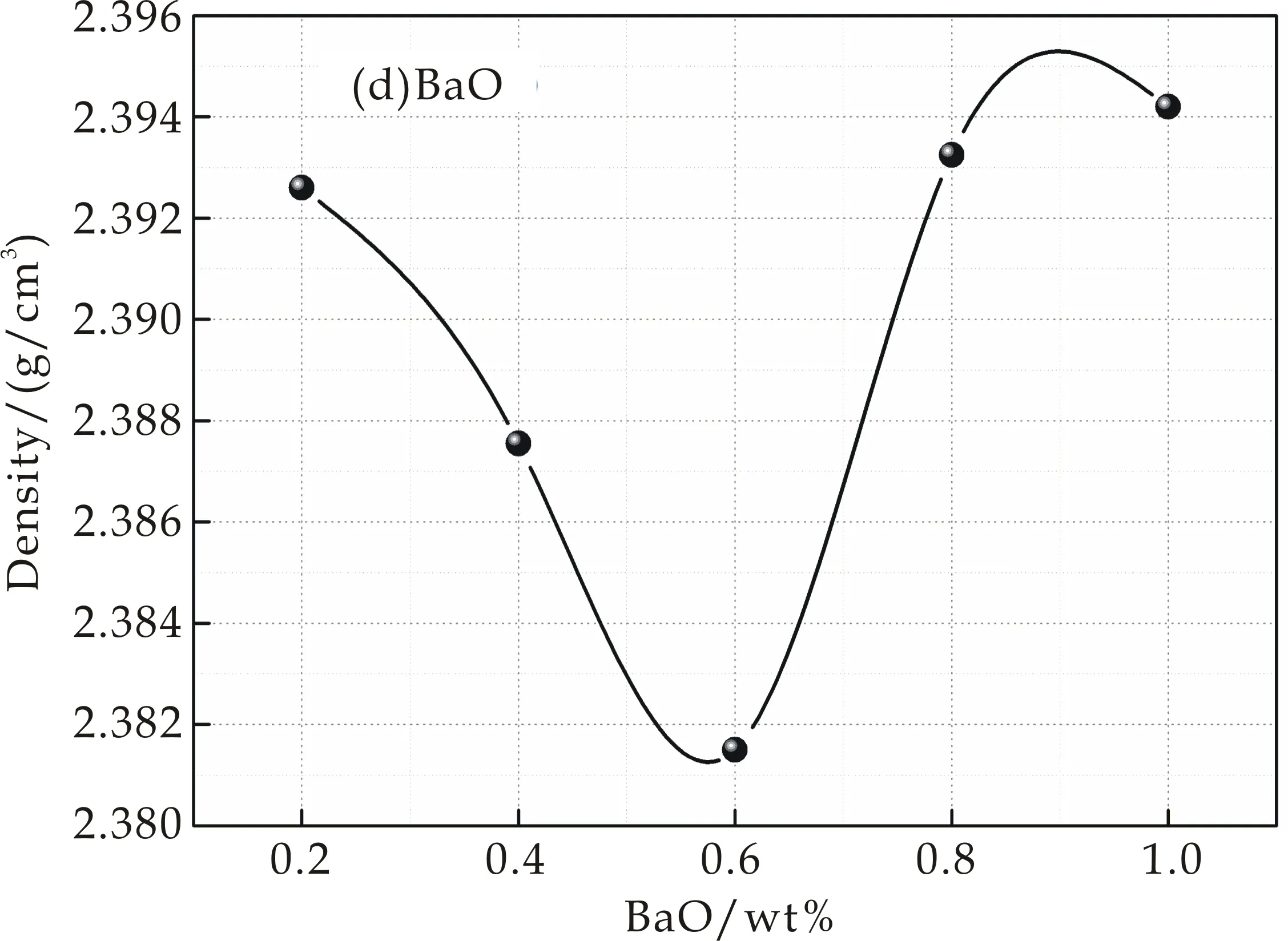
(d)添加BaO的密度变化规律图1 掺入不同含量MgO、CaO、SrO、BaO密度的变化规律
2.2 介电性能
玻璃的电性能与其化学成分有很大的联系.这是因为不同的成分使玻璃网络空间布局以及内部空隙发生了变化,从而改变了内部离子在不同位置之间的迁移难易程度.一般情况下,介电常数与其化学组成的关系可以从离子极化和迁移率的大小来考虑.离子极化的实质为离子在其附近离子的电场(外电场)作用下相对位移,使电子云产生了变形,也可以说是离子外层的电子云和原子核发生了相对位移[6],如图2所示.
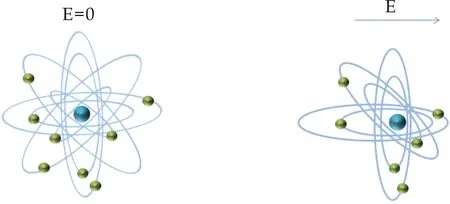
(a) 电子云的畸变
(b) 离子的位移图2 极化机理示意图
实验得到样品的介电常数变化情况如图3所示.图3(a)是掺入不同MgO含量样品介电常数的变化情况,介电常数εmax=5.84 F/m,εmin=5.69 F/m,最大偏差为0.15 F/m,可以看出其介电常数变化不大,在ε=5.74 F/m附近上下波动;图3(b)是掺入不同CaO含量样品介电常数的变化情况,从图中可以看出其介电常数εmax=5.80 F/m,εmin=5.50 F/m,偏差为0.3 F/m,变化幅度不大,但是呈现出先增大后减小的趋势,在7.94 wt%出现极大值;图3(c)和图3(d)分别为掺入不同SrO和BaO含量的样品介电常数的变化情况,其介电常数变化较大,偏差分别为εSr=0.77 F/M,εBa=0.87 F/M.从图中可以看出,介电常数有较明显的先增大再减小的趋势,分别在1.06 wt%和0.4 wt%处出现极大值.
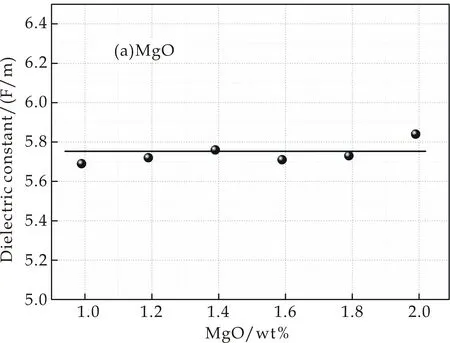
(a)添加MgO的介电常数
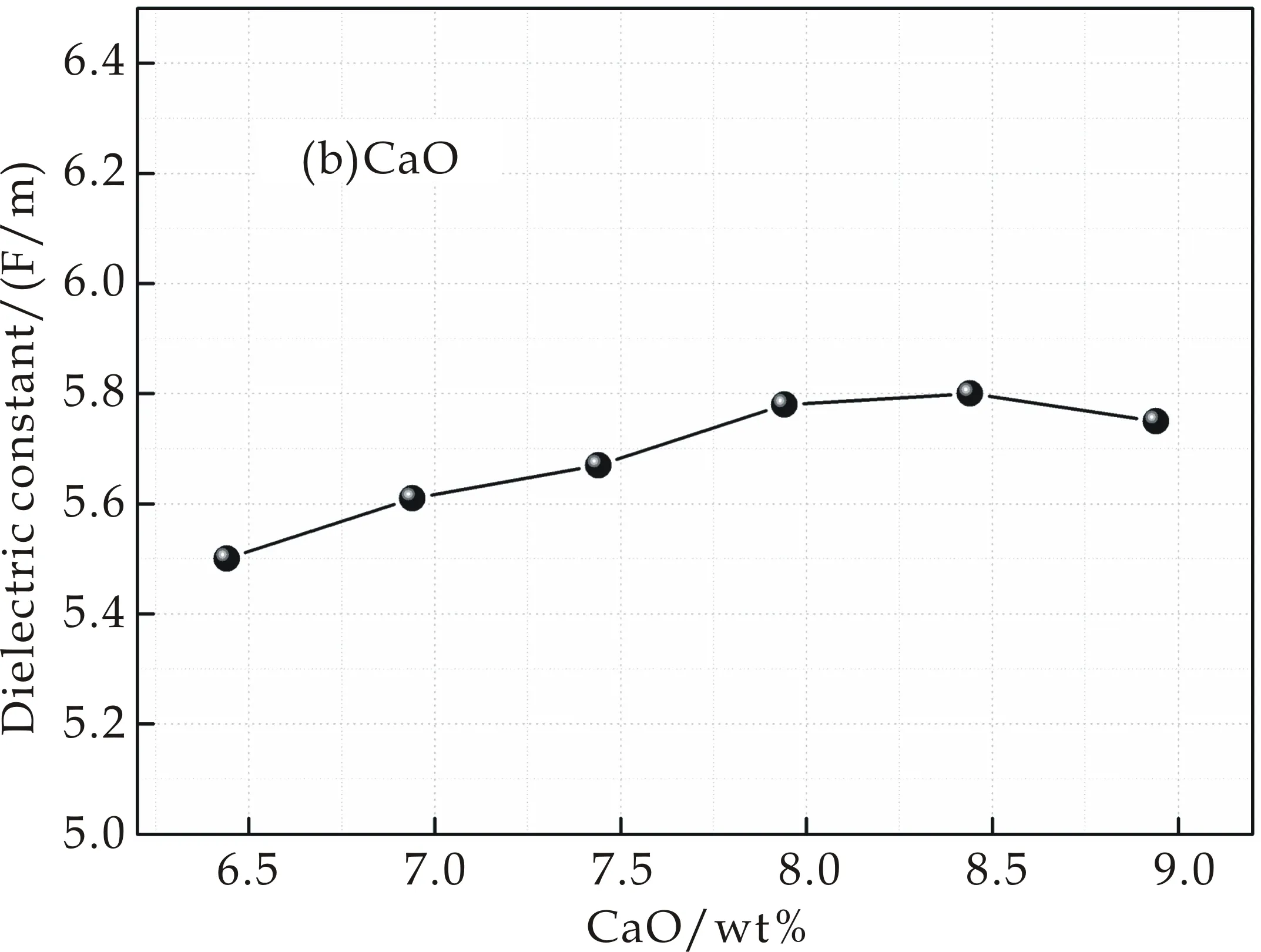
(b)添加CaO的介电常数
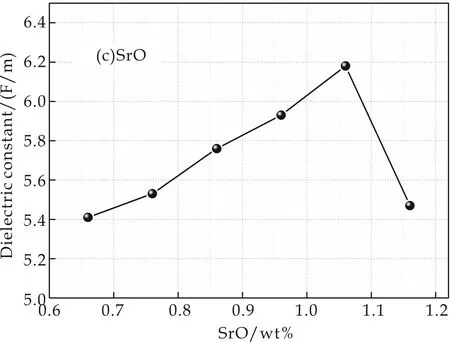
(c)添加SrO的介电常数
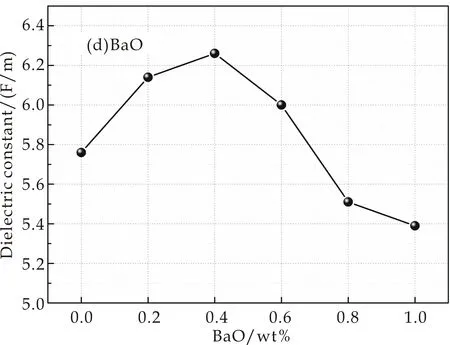
(d)添加BaO的介电常数图3 掺入不同含量MgO、CaO、SrO、BaO在1 MHz下介电常数的变化规律
式(3)所表示的方程将介电性能和材料中不同结构单元的极化度、密度联系起来[7].
(3)
式(3)中:N—单位体积内极化质点数;α—极化率.
单位体积内的质点数可以通过密度反应出来,密度越大,则单位体积内的质点数也就越多.碱土金属氧化物是网络外体氧化物,在玻璃结构中起到填充网络空隙的作用,随着碱土金属氧化物含量的增加,增加了空隙的填充率,添加MgO、CaO、SrO的样品密度都有着增大的趋势,如图1所示.通过公式(3)可以得到,随着单位体积内质点数的不断增加,介电常数越来越大.
理论上BaO样品的介电常数应与密度成正比,但是玻璃中的介电常数主要与离子极化和离子迁移率有关.由于Ba2+的半径大,O2-对Ba2+的外层电子云影响较大,使其极化率变大,介电常数也随之增加,且增加的幅度大,弥补了因为密度下降而导致介电常数的下降.因此,添加BaO样品的介电常数与密度不成正比关系.
在玻璃中加入碱土金属氧化物时,玻璃中出现了极易氧化的非桥氧,从而增加了介电常数[8].但是不断添加MgO,介电常数变化不明显,其原因为:如表2所示,Mg2+的极化力较小且离子半径比其他阳离子小很多.在本样品的玻璃中阴离子只有O2-,因此,O2-的电子云排斥Mg2+的电子云,但是由于Mg2+半径较小,电子与核联系紧密,电子云不易发生变形.同时,Mg2+的极化力较小,Mg2+的电子核上过剩的正电荷对O2-的电子云的吸引能力较小,不能使O2-最外层电子云发生较大变化,导致其极化率较低,因此介电常数变化不明显,在5.74 F/m附近上下浮动.
氧离子的极化率与玻璃的光学碱度有着很大的关系.公式(4)[9,10]和(5)[11]将O2-和玻璃的光学碱度紧密的结合起来.
Λglass=ΣχiΛi
(4)
α0=1.431Λglass+0.873
(5)
式(4)、(5)中:Λglass—玻璃的光学碱度,a.u.;χi—各氧化物的摩尔百分比,mol%;Λi—各氧化物理论的光学碱度值,a.u.;α0—氧离子的极化率.
根据式(4)和(5),随着样品中分别加入CaO、SrO和BaO时,玻璃的光学碱度不断增加,则氧的极化率也不断增加,导致O2-电子云排斥阳离子电子云的能力增加,使阳离子的电子云变形加剧;阳离子(Ca2+、Sr2+、Ba2+)对O2-的电子云的吸引能力相较于Mg2+大,因此可以使O2-最外层电子云发生较大变化,使其极化率较高,导致介电常数出现了增加的情况.但随着碱土金属氧化物地不断加入,介电常数出现了下降的情况,其原因是:随着碱土金属离子含量的增加,总移动离子浓度增加,碱土-碱土距离减小,从而增加了它们之间的相互作用.这种移动离子间相互作用的增加可能会减少偶极-偶极相互作用,从而导致介电常数的降低[12,13].其中,图3(d)介电常数下降的更为明显,原因是在系统中又引入了一种新的碱土金属氧化物发生了类似于混合碱效应的“混合碱土效应”.
从图4可以明显看出,添加相同含量的RO(R=Mg、Ca、Sr和Ba),介电常数按Mg、Ca、Sr的顺序不断增加,但是添加BaO却出现了明显的下降.在1 MHz的高频条件下,只考虑电子极化和离子极化.Mg2+、Ca2+、Sr2+和Ba2+拥有相同的电子层构型,均为惰性气体构型.元素周期表中Mg、Ca、Sr和Ba从上到下,核外电子层增多,离子半径增大,电子与核联系变弱,在电场作用下,O2-的电子云排斥阳离子的电子云能力不断增加,导致电子云易于变形.同时Ca2+、Sr2+和Ba2+的极化能力增强,其原子核过剩的正电荷对O2-的最外层电子云吸引能力不断增强,使O2-的电子云变形程度不断增大,所以极化力增大.
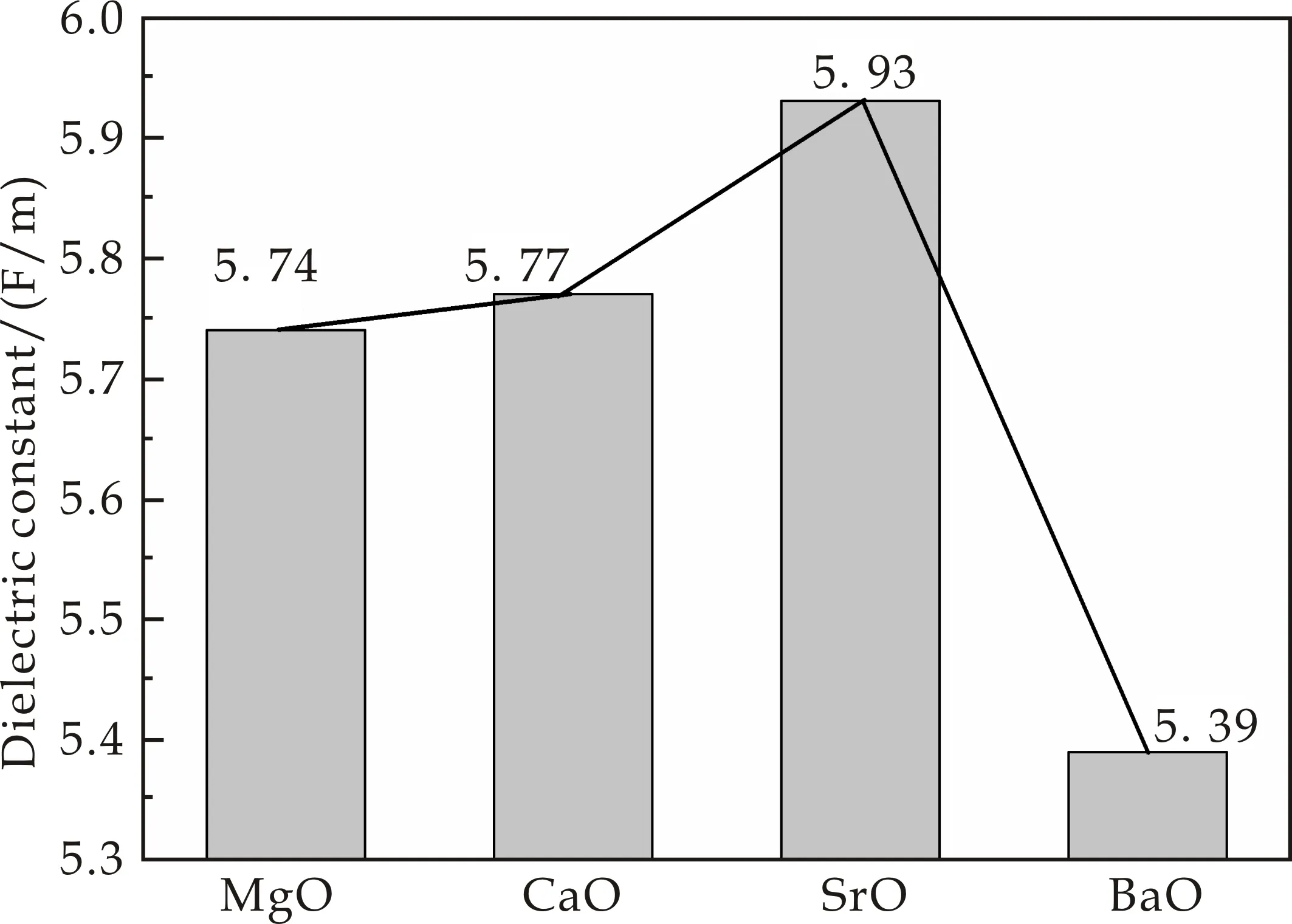
图4 在1 MHz下,掺入相同含量RO(R=Mg、Ca、Sr和Ba)样品的介电常数的变化规律
对于这四种碱土金属氧化物,当碱土金属含量相同时(如表2所示),它们的场强按Mg、Ca、Sr、Ba的顺序不断减小;其阳离子的半径按Mg、Ca、Sr、Ba的顺序不断增加,使碱土金属离子与非桥氧的结合能力降低,导致介电常数按Mg、Ca、Sr的顺序不断增大.但是添加相同含量Ba的情况下,介电常数却出现了明显的下降,其原因可能是当引入新的二价碱土金属离子时,出现了类似于混合碱效应的阻塞效应,使其介电常数出现了下降的情况.当引入新的混合碱土金属离子时,它们各自占据特定的位置,占据不同的通道.在进行迁移时,由于含有的碱土金属离子种类较多,使其多条通道之间产生了阻断,妨碍了迁移,从而降低迁移速率[14-16].而介电常数与阳离子的迁移速率成正比,阳离子迁移率越慢,介电常数越低.

表2 Mg 、Ca 、Sr、 Ba离子的半径和场强对比
3 结论
采用高温熔融法制得高铝硼硅玻璃,通过阿基米德原理和E4980A的精密阻抗分析仪对样品的密度和介电性能进行分析,获得以下结论:
(1)通过阿基米德原理测量玻璃的密度发现,随着碱土金属氧化物的掺入,掺入MgO、CaO和SrO的样品密度都呈现出增加的趋势,掺入BaO样品的密度则呈现出先减小后增大的趋势.
(2)介电性能测试分析表明,分别改变RO的掺入量发现:MgO含量不同的样品,由于Mg2+和O2-的电子云变化较小,其介电常数在5.74 F/m上下波动;掺入不同量CaO、SrO和BaO使样品由于非桥氧的增加和O2-、阳离子的电子云变化大等影响,介电常数出现先增大后减小的趋势,分别在7.94 wt%、1.06 wt%和0.4 wt%处出现极大值.同时,掺入BaO的样品发生了明显的混合碱土效应,玻璃结构中离子的迁移速率降低,使玻璃介电常数出现下降的趋势.
