基于静纺技术制备金属有机抗菌薄膜材料及抗菌性能研究
2019-05-24张亚男
张亚男, 张 昱, 成 晶, 李 磊
(陕西科技大学 化学与化工学院, 陕西 西安 710021)
0 引言
银抗菌材料与其他金属或金属氧化物相比,对细菌[1]、真菌[2]以及一些耐药菌种[3]具有广泛而有效的抗菌活性,因此,吸引了许多研究者的关注,近年来,也有大量的文章进行报道[4-11].随着对银抗菌材料研究的深入,发现其具有很多弊端.银抗菌材料起到抗菌作用的作用源是银离子,但是由于无法控制银离子的释放,容易使其在人体各个器官进行累积,最终产生神经毒性,危害人体健康,因此,限制了银抗菌材料的应用与发展[12].
金属有机骨架 (MOFs) 作为一种新型功能材料,具有高比表面积、开放的活性金属位点、高稳定性等优点,使得MOFs在传感[13,14]、气体分离[15]、气体与能量存储[16,17]、催化[18]和发光材料[19]等领域有着广泛应用.但是,在近几年来,MOFs由于可调节的孔径及其结构使其具备可以控制药物释放的能力,进而实现降低毒性的目的,所以MOFs在生物医学领域具有很大的发展空间.
1997年,Nomiya等[20]用含氮、磷、硫的配体合成了系列银金属有机骨架,[Ag(imd)](a)、[Ag(Himd)2](NO3)(b)、[Ag(imd)(PPh3)3](c)、{Na[Ag(tsa)]·H2O}(d)并证明上述金属有机骨架具有抑菌活性,而且其性能明显优于有机配体与硝酸银的抗菌活性.2004年,Nomiya等[21]合成了以银、铝、钒、锌、铜、钴为中心离子的金属有机骨架材料,并对其抑菌活性进行对比分析得出银金属有机骨架材料的抗菌活性优于其他金属有机骨架材料.
但是,目前所得到的金属有机骨架材料大多是粉体材料,疏水疏油导致其不易加工,这在很大程度上限制了其应用,故而开发合适的加工工艺,拓展其应用领域是现阶段金属有机骨架材料研究所必须解决的问题.为了解决这一难题,将MOFs材料成膜化已成为现在的研究热点,由于MOFs为颗粒状或者为粉体,其成膜需要载体材料,所以将其与聚偏氟乙烯(PVDF)、聚乙烯(PE)、聚乙烯醇(PVA)等工业高分子聚合物结合,将其用于抑菌、生物医学、发光材料、气体分离、增强疏水性、液相分子筛分、染料和污染物的分离等领域[22,23].近几年来,静电纺丝技术以其操作简单、纺丝成本低廉、可纺种类繁多、工艺可控等优点已成为有效制备纳米薄膜材料的主要途径之一.Tang J等[24]利用静电纺丝技术,制备出具有良好抗菌活性的Ag/PVP纳米纤维.
本文利用硝酸银与D-天门冬氨酸(图1)合成Ag-MOF(图2),并将其与聚乙烯吡咯烷酮(图3)结合利用静电纺丝技术制备出纺丝纤维薄膜,使用PXRD、荧光光谱分析、TGA、SEM、紫外-可见分光光谱仪对其结构与基本性质进行表征,表明该薄膜具有良好的荧光性能、热稳定性、光稳定性及其时间稳定性.选取铜绿假单胞杆菌与大肠杆菌为研究对象,利用抑菌圈法与生长曲线法对Ag-MOF、纯PVP、Ag-MOF@PVP纤维薄膜的抗菌活性进行研究,得出Ag-MOF@PVP纤维薄膜分别对铜绿假单胞杆菌与大肠杆菌均有良好的抗菌活性.
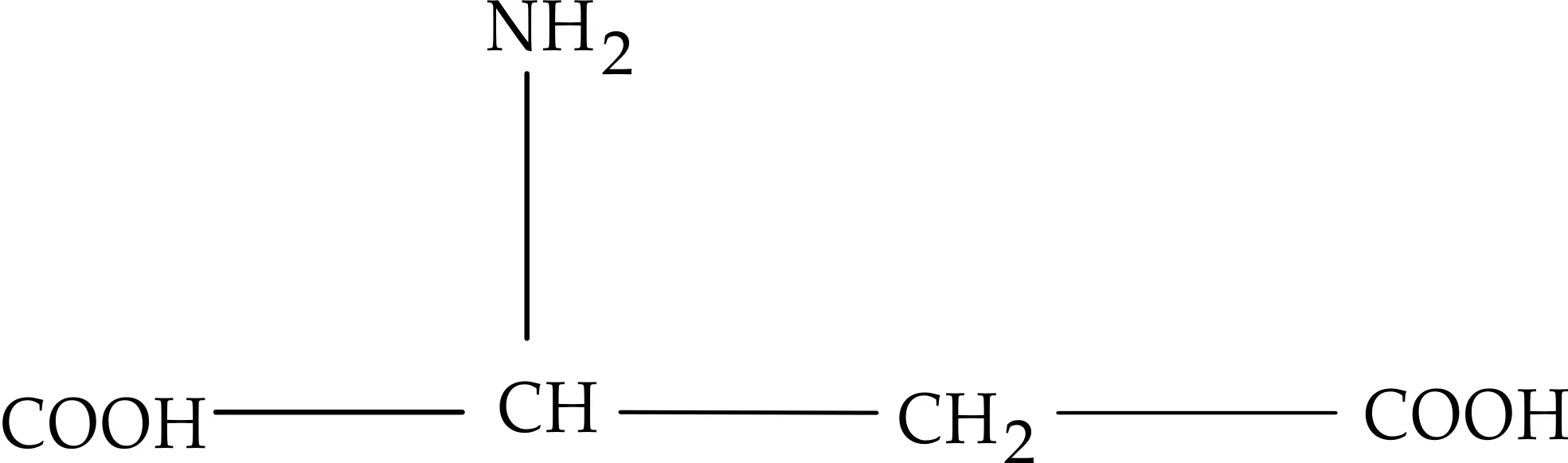
图1 D-天门冬氨酸结构式
图2 Ag-MOF的填充模式图
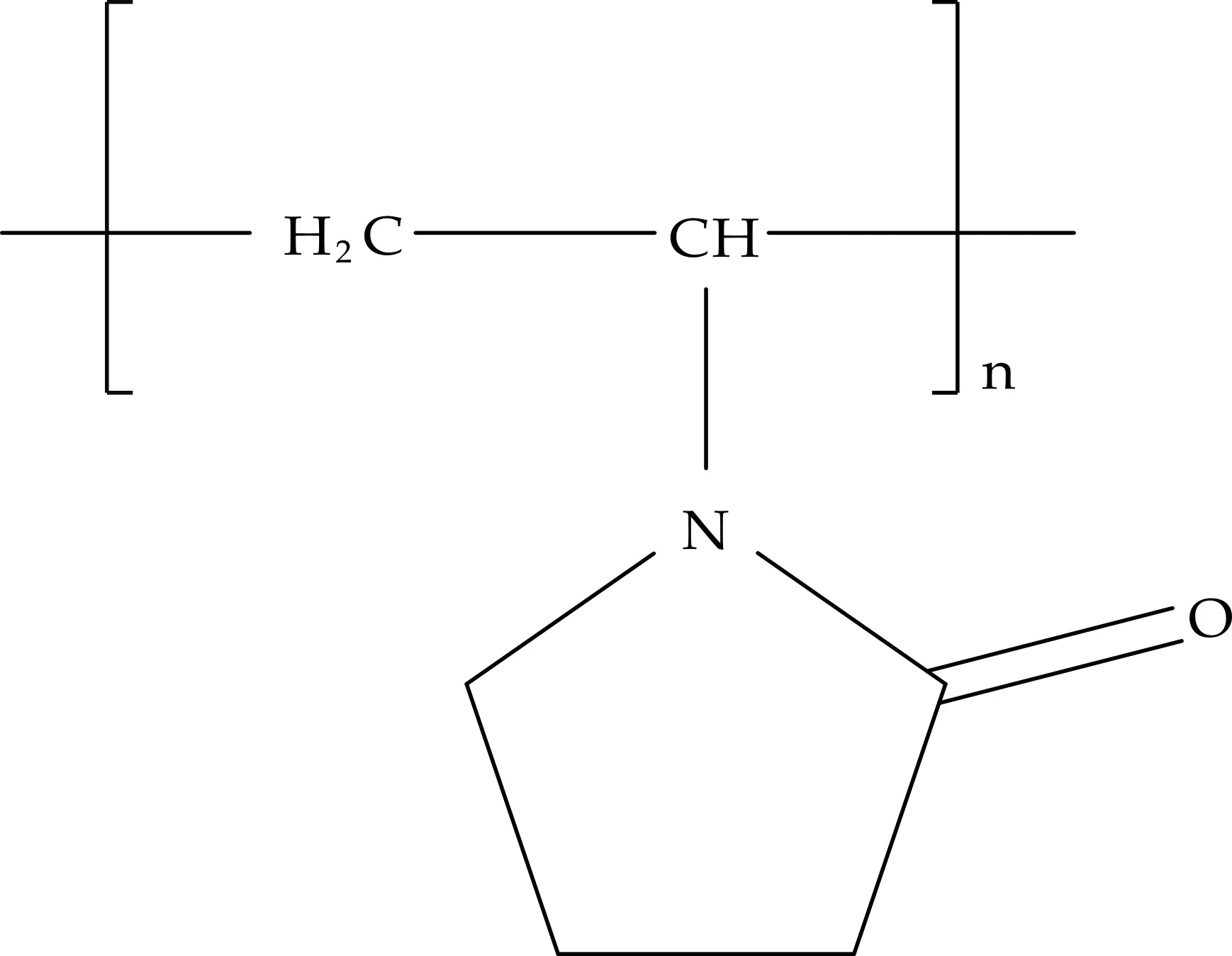
图3 聚乙烯吡咯烷酮的结构式
1 实验部分
1.1 主要试剂与仪器
1.1.1 主要试剂
D-天门冬氨酸,分析纯,上海麦克林生化科技有限公司;氢氧化钠,分析纯,天津市河东区红岩试剂厂;蒸馏水,分析纯,自制;硝酸银,分析纯,上海化学试剂有限公司;聚乙烯吡咯烷酮,医药级,山东优索化工科技有限公司.
1.1.2 主要仪器
Bruker Smart APEX-II CCDX-射线单晶衍射仪(德国布鲁克公司,Mo-Kα射线);Rigaku RU200 X-射线粉末衍射仪(日本理学公司,Cu-Kα射线,λ=1.541 8 Å,测试角度3~60 °);静电纺丝机(东文高压电源股份有限公司,JDF05);傅立叶红外光谱仪(德国布鲁克公司);VarioEL III 元素分析仪(德国艾尔曼公司);德国布鲁热重分析仪(STA449F3-1053-M德国耐驰有限公司);荧光磷光热释光谱仪(FluoroMax-4P日本HORIBA公司);紫外-可见分光光谱仪(Cary100 UV-Vis 美国安捷伦公司).
1.2 配合物[Ag3(D-asp)2(NO3)]n·nH2O的合成
室温下,用分析天平称取AgNO3(3 mmol,0.51 g) 和D-asp (2 mmol,0.266 g)置于25 mL的烧杯中,加入10.0 mL的蒸馏水,逐滴加入NaOH(0.5 mmol)并搅拌,直至pH为6.将该溶液置于磁力搅拌器恒温80 ℃ 搅拌1 h,过滤掉灰色沉淀,将滤液在室温下静置2天,则有无色透明细棒状晶体析出.重复单元为Ag3C8H14N3O12(667.83),元素分析(%),理论值:C为14.39;H为2.11;N为6.29;实验值:C为14.48;H为2.06;N为6.36.
1.3 金属有机薄膜的制备
1.3.1 配制铸膜液
利用分析天平称取0.1 g配合物[Ag3(D-asp)2(NO3)]n·nH2O于烧杯中,加入8 mL甲醇,利用保鲜膜密封,超声10 min后,加热至50 ℃左右 ,在磁力搅拌下,缓慢加入1 g PVP(聚乙烯吡咯烷酮K90),用保鲜膜密封在50 ℃下搅拌20 min.
1.3.2 纺丝
医用注射器取8 mL铸膜液,装上纺丝喷头后,装载到进样泵上,设置进样速度为1.0 mL/h,将高压电源输出端口接到喷丝头上,启动高压电源,设置电压为12 kV,开始纺丝.
1.4 Ag-MOF@PVP纤维薄膜抗菌性能检测
1.4.1 抑菌圈实验
利用抑菌圈实验对Ag-MOF晶体粉末、PVP纤维薄膜、Ag-MOF@PVP纤维薄膜的抗菌性能进行分析.首先,针对Ag-MOF晶体,制备其悬浮液,并将悬浮液滴加于直径为6 mm的中性滤纸圆片上,针对纤维薄膜材料,将薄膜材料剪裁成直径为6 mm的圆片,然后配制固体培养基并进行灭菌,将大肠杆菌和铜绿假单胞杆菌分别接种到已制备好的固体培养基中,最后,将中性滤纸圆片或纤维膜薄片放置于培养皿中央,在37 ℃的条件下于细胞恒温培养箱中培养24 h后测量其抑菌圈的直径,以抑菌圈的直径大小判断材料的抑菌性能.
1.4.2 生长曲线
分别将OD值为0.8的菌液以及0.1 g Ag-MOF@PVP纤维薄膜加入到盛有液体培养基的试管中并设置空白对照组,在恒温摇床中培养,间隔数小时利用紫外可见分光光度计测量波长为600 nm处的吸光度.
2 结果与讨论
2.1 负载Ag-MOF前后纺丝薄膜形貌观测
图4是Ag-MOF负载前后纺丝薄膜的SEM对比图.图4(a)为放大25 000倍未负载Ag-MOF纺丝薄膜的SEM图,图4(b)为放大20 000倍负载Ag-MOF纺丝薄膜的SEM图.通过对比可以看出,未负载Ag-MOF纺丝薄膜的纤维是光滑均匀的,负载Ag-MOF后的纺丝纤维表面变粗糙且可清晰的观察到有固体颗粒附着于纺丝纤维上,由此可以证明Ag-MOF成功负载于纤维上.

(a)未负载MOF纺丝薄膜的SEM图

(b)负载MOF纺丝薄膜的SEM图图4 Ag-MOF及负载MOF前后纺丝薄膜的SEM图
2.2 X-射线粉末衍射分析
在室温下,利用X-射线粉末衍射对样品的纯度进行了研究,其结果如图5所示.将本文中合成的Ag-MOF晶体的粉末衍射数据与由X-射线单晶衍射仪所测结构模拟出的理论数据进行对比分析发现,两者的主要峰相吻合,说明所合成的Ag-MOF具有单一的晶相且纯度较高,可用于后续研究.由纯PVP纺丝薄膜的衍射数据可知在2θ= 5.7 °出现的主衍射峰.PVP@Ag-MOF纤维薄膜也同样在2θ= 5.7 °出现PVP的特征峰,但是其他主峰与Ag-MOF晶体粉末单晶数据基本对应,说明Ag-MOF晶体通过静电纺丝技术与聚乙烯吡咯烷酮(PVP)成功混合并纺制成纤维薄膜后,并没有改变其晶体结构.由此,可推断出Ag-MOF晶体已成功负载于PVP纺丝纤维上,此结论与图4的SEM图所得结论相符.
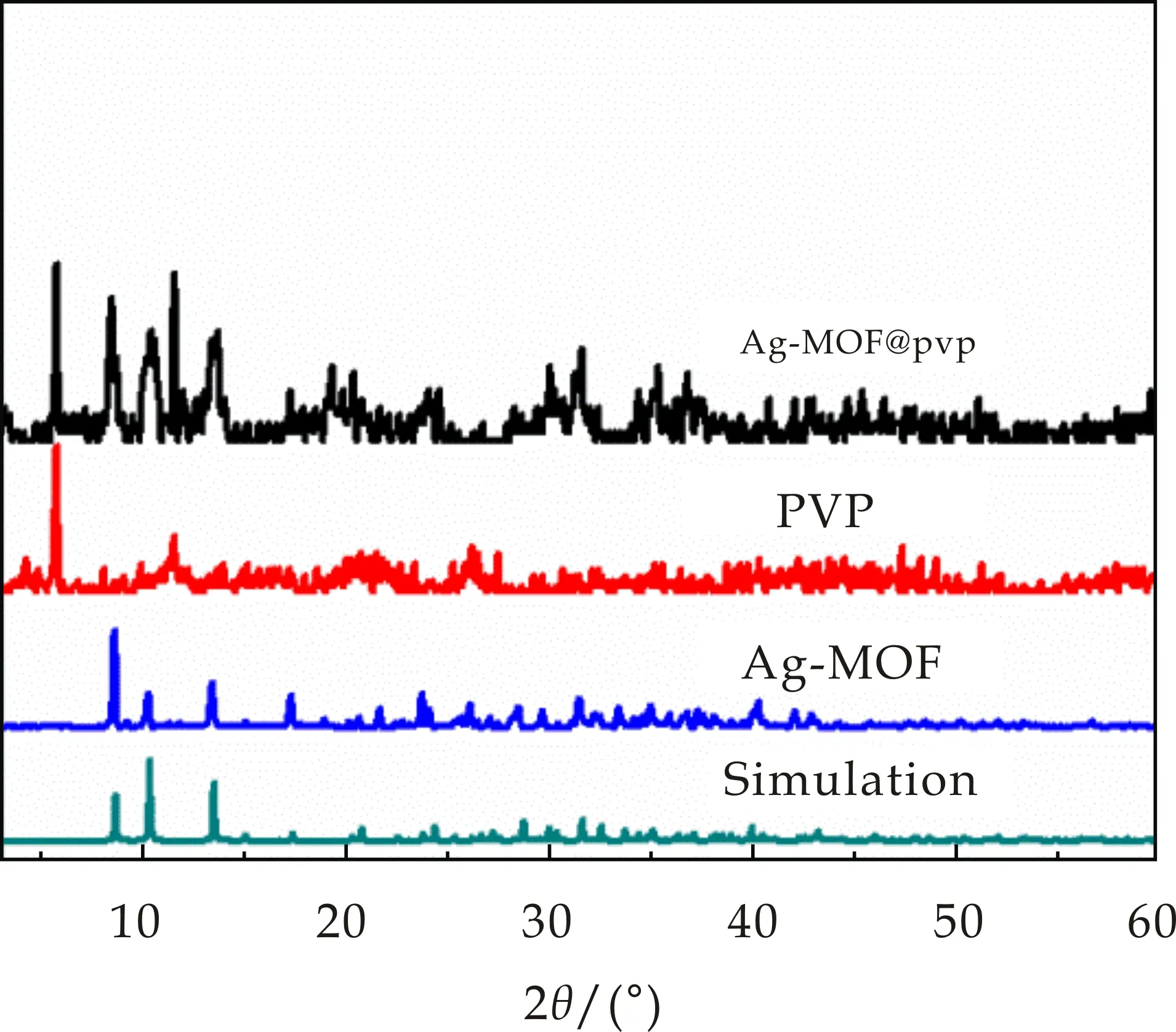
图5 配合物与纺丝薄膜的PXRD图
2.3 荧光性能分析
分别对Ag-MOF、PVP纤维薄膜与Ag-MOF@PVP纤维薄膜的荧光性能进行分析.如图6所示,曲线a、b、c分别代表Ag-MOF@PVP纤维薄膜、PVP纤维薄膜、Ag-MOF的荧光强度.从图6可看出,Ag-MOF荧光强度较弱,PVP纤维薄膜的荧光强度较强(发射波长为345 nm,激发波长为284 nm).相对于Ag-MOF和PVP,通过静电纺丝技术将Ag-MOF与PVP进行复合后所得的Ag-MOF@PVP纤维薄膜荧光性能最好,其原因是在纺丝过程中,均匀附着于纺丝纤维上,聚乙烯吡咯烷酮(PVP)中的自由基将Ag-MOF还原,产生微量的纳米银,而纳米银会使荧光物质的荧光性能增强,产生金属增强荧光效应(MEF)[25-27].

图6 配合物与纺丝薄膜的荧光光谱图
2.4 Ag-MOF@PVP纤维薄膜稳定性分析
2.4.1 Ag-MOF@PVP纤维薄膜的热稳定性
利用热重分析仪对Ag-MOF晶体粉末与Ag-MOF@PVP纤维薄膜的热稳定性进行分析.升温速率为10 ℃/min、测试温度范围为30 ℃~800 ℃.测试结果如图7所示,曲线a、b分别代表Ag-MOF晶体粉末与Ag-MOF@PVP纤维薄膜的热重曲线.从曲线a可看出107 ℃出现质量损失,这对应于Ag-MOF晶体结构中游离的水分子的失去,失重比为2.491%.107 ℃到180 ℃出现失重平台,所以在这个阶段Ag-MOF晶体结构保持稳定,当升温到180 ℃之后Ag-MOF结构骨架迅速坍塌.由曲线b得到,Ag-MOF@PVP纤维薄膜在30 ℃~60 ℃出现第一个失重平台,失重百分比为7.62%,这部分失重归因为Ag-MOF@PVP纤维薄膜中溶剂甲醇分子的失去;在60 ℃~380 ℃之间,热重平台未发生明显变化,这说明在此温度范围内,金属有机纤维薄膜的结构可以较好的保持.当超过380 ℃时出现快速失重,这部分归因于金属有机薄膜的分解.综上所述,Ag-MOF@PVP纤维薄膜的热稳定性优于Ag-MOF晶体颗粒.
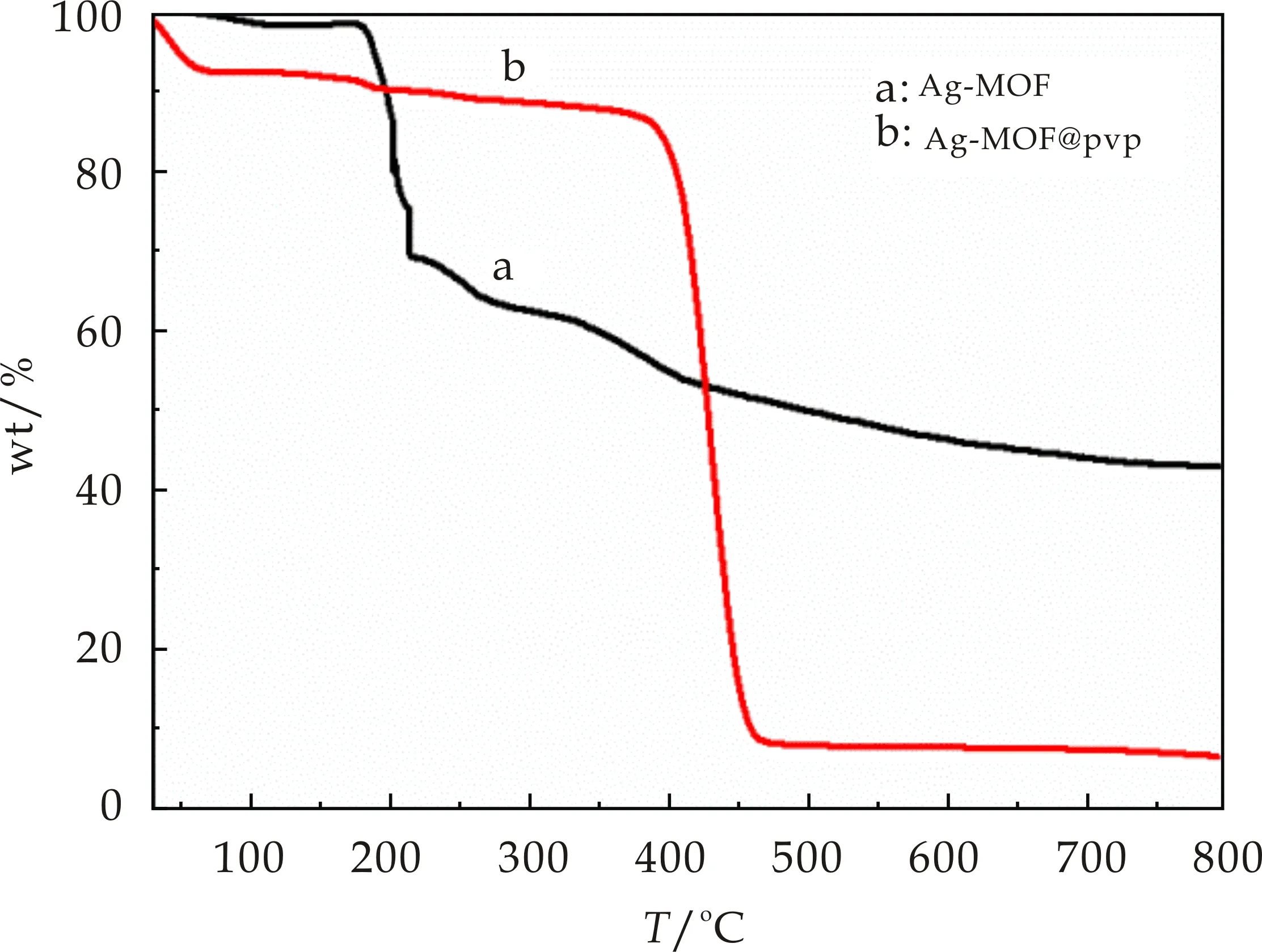
图7 金属有机薄膜热重曲线图
2.4.2 光稳定性
利用固体紫外-可见分光光度计对Ag-MOF@PVP纤维薄膜的光稳定性进行分析,将Ag-MOF@PVP纤维薄膜置于可见光和紫外光(365 nm)下照射24 h,以黑暗环境下未经过任何光照射的Ag-MOF@PVP纤维薄膜作为空白对照,如图8所示.由图8可看出,在三种不同条件下的纤维薄膜其主要特征峰峰位基本吻合,峰强稍有变化.由此说明Ag-MOF@PVP纤维薄膜长时间在紫外光以及可见光照射下其化学结构保持稳定.
2.4.3 时间稳定性
由于目前所出现的同类型抗菌材料,不易保存,对条件要求苛刻,导致制备成本增加,阻碍了复合抗菌膜材料的发展与应用,所以其稳定性是现在所面临的一个难题.本文对所制备的Ag-MOF@PVP纤维薄膜的稳定性进行分析,其分析结果如图9所示.由图9可知,保存0天的纺丝薄膜的衍射峰与保存10天的纺丝薄膜的衍射峰基本吻合,表明将纤维薄膜在室温下放置10天后,其结构仍然保持稳定.
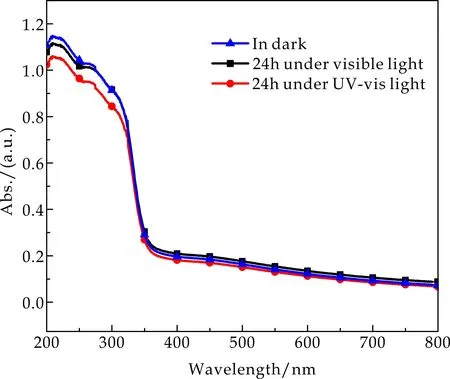
图8 Ag-MOF@PVP纤维薄膜紫外光和可见光照射下固体紫外-可见光光谱图
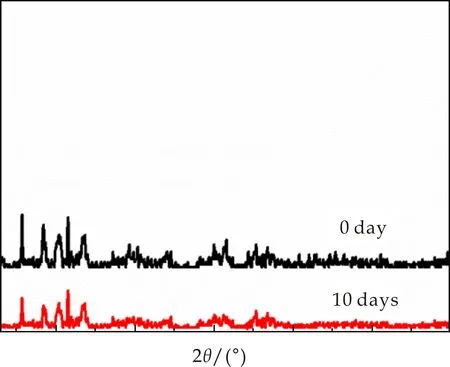
图9 纺丝薄膜时间稳定性的PXRD图
2.5 抗菌性能
通过抑菌实验对Ag-MOF@PVP纤维薄膜的抑菌活性进行分析.选取铜绿假单胞杆菌、大肠杆菌作为研究对象.通过抑菌圈实验,生长曲线实验对其抗菌活性进行研究.由于Ag-MOF可以通过控制银离子的释放,使其与微生物相互作用,实现对细菌的杀灭,利用静电纺丝制备的纤维薄膜具有高的比表面积且质地柔软可作为载药的载体并有很好的可加工性,而Ag-MOF@PVP结合了两者优点,所以具有更加优良的抗菌性能.
2.5.1 抑菌圈实验
通过抑菌圈实验分别对Ag-MOF晶体、PVP 、Ag-MOF@PVP纤维薄膜的抑菌活性进行研究并进行对比分析.从图10可以看出,Ag-MOF与Ag-MOF@PVP纤维薄膜对铜绿假单胞杆菌、大肠杆菌均具有抑菌活性且Ag-MOF@PVP纤维薄膜的抑菌活性明显优于Ag-MOF而纯PVP纤维薄膜无抑菌活.由图10(a)、(b)还可知Ag-MOF晶体颗粒对铜绿假单胞杆菌、大肠杆菌的抑菌圈直径分别为8.35 mm、10.85 mm,Ag-MOF@PVP纤维薄膜对铜绿假单胞杆菌、大肠杆菌的抑菌圈直径分别为14.95 mm、15.25 mm,Ag-MOF@PVP纤维薄膜对铜绿假单胞杆菌与大肠杆菌的抑菌圈直径均大于Ag-MOF,由此说明Ag-MOF@PVP的抑菌活性优于Ag-MOF且Ag-MOF@PVP对大肠杆菌的抑菌活性优于铜绿假单胞杆菌.
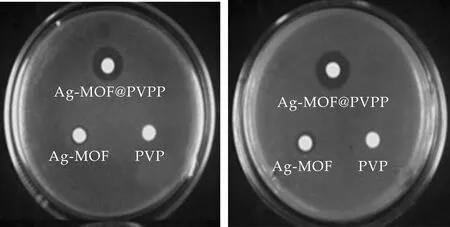
(a)铜绿假单胞杆菌 (b)大肠杆菌 图10 Ag-MOF、PVP 、Ag-MOF@PVP对铜绿假单胞杆菌和大肠杆菌的抑菌圈图片
2.5.2 生长曲线法
利用生长曲线法对Ag-MOF@PVP抑菌活性进行研究,如图11、12所示,加入Ag-MOF@PVP纤维薄膜后,铜绿假单胞杆菌与大肠杆菌的生长曲线的OD值几乎没有变化,而空白对照组其OD值,随时间推移越来越大,所以结果表明Ag-MOF@PVP对铜绿假单胞杆菌与大肠杆菌具有良好抗菌活性.从图13可得出Ag-MOF@PVP对大肠杆菌的抑菌活性要稍强于铜绿假单胞杆菌,此结论与用抑菌圈法所得结论相符.

图11 Ag-MOF@PVP纤维薄膜对铜绿假单胞杆菌的生长抑制曲线
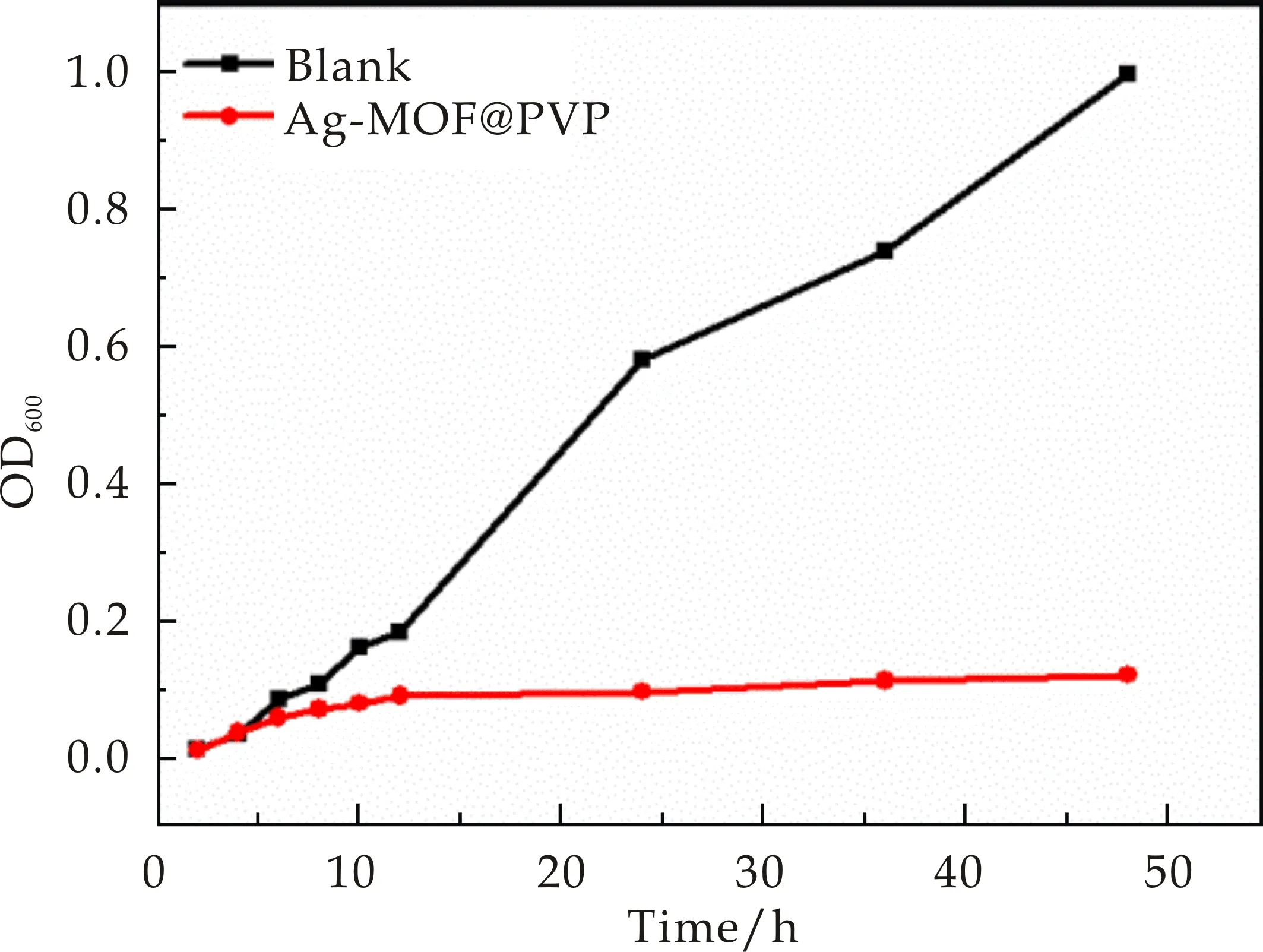
图12 Ag-MOF@PVP纤维薄膜对大肠杆菌的生长抑制曲线
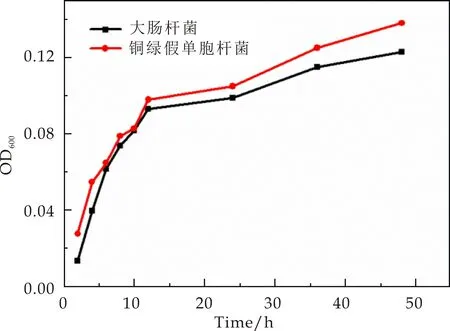
图13 大肠杆菌与铜绿假单胞杆菌的生长抑制曲线对比图
3 结论
本文采用静电纺丝技术制备出具有良好发光性能的金属有机薄膜.利用SEM、PXRD、TGA、荧光光谱分析以及紫外-可见分光光谱仪对其结构与基本性质进行表征,结果分析表明其具有高达380℃的热稳定性,良好的光稳定性以及时间稳定性,且在345 nm处具有蓝色的荧光发射,其荧光性能增强的原因是在纺丝过程中Ag-MOF被PVP产生的自由基还原产生微量纳米银,由于金属增强荧光效应(MEF),Ag-MOF@PVP纤维薄膜的荧光性能增强.利用抑菌圈法与生长曲线法得出其对铜绿假单胞杆菌与大肠杆菌具有优异的抑菌活性.
