布鲁氏菌OMP25与OMP31蛋白的表达及其间接ELISA诊断试剂盒研制
2019-05-23
布鲁氏菌病是由布鲁氏菌(Brucellaspp.)属引起的人兽共患性传染病,严重威胁着人和多种动物的生命健康。我国将布鲁氏菌病列为二类传染病,世界动物卫生组织将其列为B类法定传染病[1]。布鲁氏菌病呈世界性流行,可引发多种家畜的流产、不育以及人的波浪热,造成严重的经济损失和食品安全问题[2-4]。在我国31个省、市、自治区都有不同程度的发生和流行,在全世界170多个国家和地区存在和流行,而在拉丁美洲它每年造成约6亿美元的损失,在美国每年造成的损失平均达1.5亿美元[4]。随着畜牧业的快速发展,布鲁氏菌病在多数疫区有明显回升的趋势。
布鲁氏菌细胞膜是一个3层膜的结构,OMP25与OMP31均为OmpA家族成员之一,是布鲁氏菌的重要外膜蛋白,在维持细菌外膜结构稳定性、细菌毒力等方面发挥着重要作用[6-9]。目前布鲁氏菌病的实验室检测方法主要包括免疫学检测方法(包括凝集试验、补体结合试验、变态反应检查、ELISA检测方法等)、病原学检查与分子生物学技术(包括PCR检测方法、脉冲场凝胶电泳技术、荧光偏振试验等)等方法[10-11]。
在国际贸易中,布鲁氏菌病ELISA检测方法被指定为牛种布鲁氏菌病的标准检测方法;而我国布鲁氏菌病法定检测方法中,血清学诊断方法存在非特异性反应、假阳性、前带现象或动物自身免疫抑制等缺陷,远不能满足对布鲁氏菌病的防控需求。因此,本研究在克隆表达猪种布鲁氏菌S2株OMP25与OMP31外膜蛋白的基础上,建立了羊布鲁氏菌病ELISA检测方法,从而为羊布鲁氏菌病的防控提供参考。
1 材料与方法
1.1 材 料
1.1.1菌种与质粒 猪种布鲁氏菌S2株(Brucellasuis)由中国兽医药品监察所提供;DH5α感受态细胞、BL21表达菌(DE3)与pET-28a原核表达载体由山东绿都生物科技有限公司重点实验室保存。
1.1.2主要试剂NdeⅠ与EcolⅠ限制性内切酶、pMD18-T载体、rTaq Mix、T4连接酶、DL2000 Marker与IPTG购自大连宝生物制品有限公司;羊布鲁氏菌病标准阳性与阴性血清、布鲁氏菌虎红平板凝集抗原购自中国兽医药品监察所;辣根过氧化物酶标记的金黄色葡萄球菌蛋白A (HRP-SPA)购自中杉金桥生物技术有限公司;细菌基因组提取试剂盒、预染蛋白Marker购自Fermentas公司。质粒提取试剂盒、胶回收试剂盒购自生工生物工程(上海)股份有限公司;可溶型单组分TMB底物溶液购自天根生化科技(北京)有限公司;His-Tag亲和层析试剂盒购自上海拜力生物科技有限公司。
1.2 方 法
1.2.1引物设计与合成 根据布鲁氏菌S2株OMP25与OMP31基因组序列,设计引物,并引入NdeⅠ与EcolⅠ酶切位点,分别扩增573 bp与783 bp的目的基因片段。将引物序列送生工生物工程(上海)股份有限公司合成。
OMP25和OMP31的引物序列如下:
OMP25基因上游引物:5′-TATCATATGATGCGCACTCTTAAGTCTCT-3′
OMP25基因下游引物:5′ -GTGAATTCTTAGAACTTGTAGCCGATGC-3′
OMP31基因上游引物:5′-TATCATATGGCCGACATCATCGTTGT-3′
OMP31基因下游引物:5′-GGTGAATTCTTAGAGCTTGTAGTTCAG-3′
1.2.2OMP25与OMP31目的基因的扩增 将布鲁氏菌S2株放入80 ℃水浴锅中30 min进行灭活,应用细菌基因组提取试剂盒提取基因组。以提取的基因组为模板进行PCR扩增。PCR反应体系为: rTaq mix 10 μL,上下游引物各1.0 μL,模板DNA 4 μL,H2O 4 μL。反应条件为:95 ℃ 5 min,95 ℃ 45 s,57 ℃/60 ℃ 30 s,72 ℃ 1 min,30个循环,72 ℃ 10 min,4 ℃ 终止反应。OMP25与OMP31目的片段分别为573 bp与783 bp。
1.2.3OMP25与OMP31原核表达载体的构建 将PCR扩增产物经琼脂糖凝胶电泳后,利用胶回收试剂盒回收纯化DNA,用NdeⅠ与EcolⅠ限制性内切酶同时对目的基因片段和pET-28a原核表达载体进行双酶切并回收纯化,T4 DNA连接酶16 ℃过夜连接,连接产物转化到DH5α感受态细胞,利用质粒提取试剂盒提取质粒pET-OMP25与pET-OMP31,经NdeⅠ与EcolⅠ双酶切鉴定正确后,送生工生物工程(上海)股份有限公司测序鉴定。
1.2.4OMP25与OMP31目的蛋白的表达 将鉴定正确的重组质粒pET-OMP25与pET-OMP31转化BL21表达菌,并加入IPTG 37 ℃进行诱导表达16 h后,进行超声裂解后,收集上清和沉淀,进行SDS-PAGE鉴定。
1.2.5OMP25与OMP31目的蛋白的纯化与鉴定 采用亲和层析法,将表达的OMP25与OMP31蛋白进行分离纯化,应用BCA法分别测定两种蛋白的浓度,并应用Western blot技术,确定纯化蛋白的抗原性和特异性,将纯化并鉴定正确的OMP25与OMP31蛋白分别进行冻干保存。
1.2.6羊布鲁氏菌病抗体PPA-ELISA检测试剂盒反应条件的确定
1.2.6.1OMP25与OMP31蛋白最佳配比的确定 将冻干保存的OMP25与OMP31蛋白溶解至冻干前的体积,将OMP25与OMP31蛋白分别按1∶1、2∶1、3∶1与4∶1的配比加入96孔ELISA板中,100 μL /孔(混合蛋白浓度10 μg/mL),4 ℃孵育16 h;应用羊布鲁氏菌病标准阳性血清进行ELISA检测,根据试验结果,选择OMP25与OMP31蛋白的最佳配比浓度。
1.2.6.2OMP25与OMP31混合蛋白最佳包被浓度的确定 将纯化的OMP25与OMP31混合抗原进行20 μg/mL、10 μg/mL、5 μg/mL、2.5 μg/mL、1.25 μg/mL、0.625 μg/mL 稀释并包被96孔板,应用布鲁氏菌病阳性与阴性标准血清进行ELISA检测,当标准阳性血清OD450≈1.0,标准阴性血清OD450<0.2时,确定该蛋白浓度为最佳包被浓度。
1.2.6.3OMP25与OMP31蛋白最佳包被时间和温度的确定 将OMP25与OMP31混合蛋白加入96孔ELISA板中,分别在4 ℃ 12 h、4 ℃ 16 h、4 ℃ 20 h、4 ℃ 24 h、37 ℃ 2 h、37 ℃ 3 h、37 ℃ 4 h进行包被,经ELISA检测,选取P/N值最大的组,确定最佳包被时间。
1.2.6.4血清最佳稀释倍数的确定 将标准阳性血清进行1∶25、1∶50、1∶100、1∶200、1∶400、1∶800共6个稀释度进行方阵滴定试验,将标准阳性血清OD450≈1.0,标准阴性血清OD450<0.2,选取P/N值最大的组合,确定为待检血清的稀释倍数。
1.2.6.5阴阳性临界值的确定 应用已优化的最佳ELISA反应条件,对40份羊布鲁氏菌病阴性血清进行ELISA测定,并计算其平均值(X)及标准差(SD),根据统计学原理确定阴阳性临界值:样本的OD450值> OD450(-)平均值+3×S时,可以在99.9%的水平上判为阳性,则设定阴阳性临界值=OD450(-)平均值+3×S。
1.2.6.6PPA-ELISA检测试剂盒特异性试验 应用以上组装的羊布鲁氏菌病抗体检测ELISA试剂盒,分别对大肠杆菌、巴氏杆菌、沙门氏菌、羊布鲁氏菌阳性血清进行检测,确定其特异性。
1.2.6.7PPA-ELISA检测试剂盒敏感性试验 将羊布鲁氏菌病阳性血清分别进行1∶50、1∶100、1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800倍稀释,应用已有的ELISA试剂盒按以上最佳条件进行检测,依据检测为阳性的血清的最大稀释倍数,确定该试剂盒敏感性的高低。
1.2.6.8羊布鲁氏菌病抗体PPA-ELISA检测试剂盒重复性试验 批内重复性试验:4人分别应用同1批次羊布鲁氏菌病抗体检测ELISA试剂盒,对10份羊布鲁氏菌病阳性血清进行检测,计算各值之间的变异系数;批间重复性试验:取4批次羊布鲁氏菌病抗体检测ELISA试剂盒,分别对10份羊布鲁氏菌病阳性血清进行检测,计算各值之间的变异系数。
1.2.6.9PPA-ELISA检测试剂盒与布鲁氏菌虎红平板凝集试验对比性试验结果 对来自于山东省部分地区的、布鲁氏菌虎红平板凝集试验检测为阳性的63份血清与检测为阴性的80份血清,分别应用研发的羊布鲁氏菌病抗体检测ELISA试剂盒进行检测,计算该试剂盒的符合率。
2 结 果
2.1OMP25与OMP31基因片段的PCR扩增 根据GenBank公布的布鲁氏菌S2株OMP25与OMP31基因组序列,设计引物并进行PCR扩增,结果显示分别获得了573 bp与783 bp的目的基因片段。
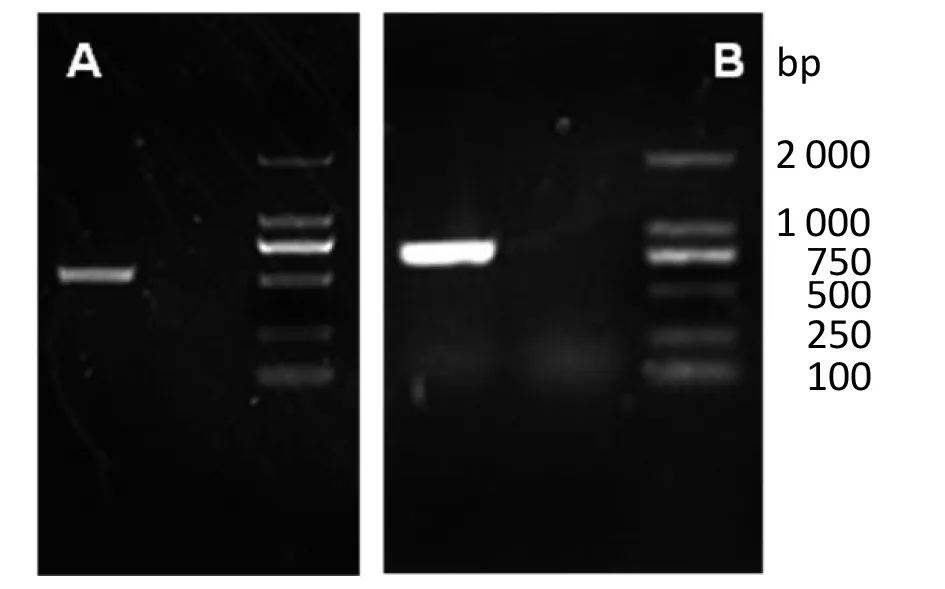
A:PCR of OMP25; B:PCR of OMP31图1 OMP25与OMP31基因片段的PCR扩增结果Fig.1 PCR of OMP25 and OMP31
2.2OMP25与OMP31原核表达载体的构建 将构建的原核表达载体pET-OMP25与pET-OMP31质粒分别进行双酶切鉴定与测序鉴定。结果显示经限制性内切酶NdeⅠ与EcolⅠ双酶切鉴定,经1.0%琼脂糖凝胶电泳可见约573 bp与783 bp大小的DNA片段,与预期结果一致;测序结果表明OMP25与OMP31基因序列与GenBank公布的序列100%相同;以上结果说明pET-OMP25与pET-OMP31重组质粒构建成功。
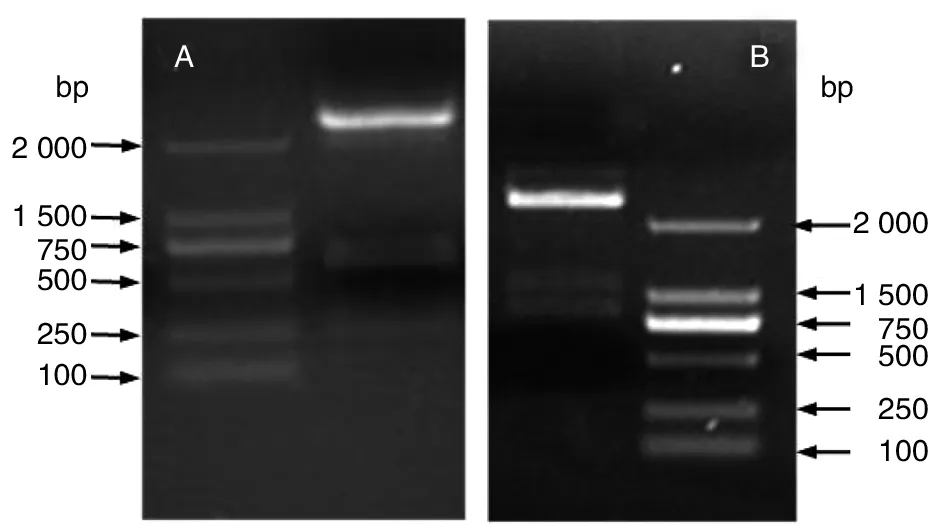
A: NdeⅠ/EcolⅠ双酶切pET-OMP25重组质粒B: NdeⅠ/EcolⅠ双酶切pET-OMP31重组质粒图2 pET-OMP25质粒与pET-OMP31质粒双酶切鉴定结果Fig.2 Identification of recombination plasmid pET-OMP25 and pET-OMP31 by digesting with restriction enzymes
2.3OMP25与OMP31目的蛋白的表达与可溶性鉴定 将pET-OMP25与pET-OMP31进行诱导表达,结果表明,分别在约25 Ku与31 Ku位置出现一条浓染蛋白条带(图3),而未经诱导的重组质粒转化菌和经诱导的空质粒转化菌培养提取物没有相应目的条带。离心收集菌液,超声破碎后,离心分别取上清和沉淀进行SDS-PAGE检测,表明OMP25与OMP31基因均以包涵体形式进行了有效表达(图4)。
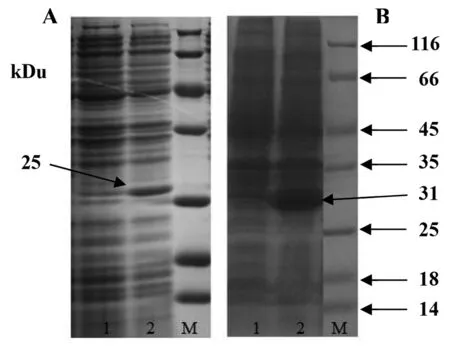
A:1,OMP25诱导前;2,在 37 ℃下IPTG诱导OMP25表达B:1,OMP31诱导前;2,在 37 ℃下IPTG诱导OMP31表达M:蛋白分子量Marker图3 OMP25与OMP31目的蛋白的诱导表达Fig.3 SDS-PAGE analysis of expressed OMP25 and OMP31

A:1,OMP25蛋白在上清中表达情况;2,OMP25蛋白在沉淀中表达情况A:1,OMP31蛋白在上清中表达情况;2,OMP31蛋白在沉淀中表达情况M:蛋白分子量Marker图4 OMP25与OMP31目的蛋白在上清与沉淀中的表达Fig.4 Expression of OMP25 and OMP31protein in upper clearing and precipitation
2.4OMP25与OMP31目的蛋白的纯化与鉴定 采用亲和层析法,将OMP25与OMP31目的蛋白纯化后,进行SDS-PAGE电泳分析,最终分别只有一条目的条带,表明OMP25与OMP31目的蛋白获得了纯化(图5)。将纯化的OMP25与OMP31蛋白分别进行Western blot分析,结果表明,OMP25与OMP31蛋白均能与羊布鲁氏菌多克隆抗体相反应,经DAB显色后分别在25 Ku与31 Ku左右有一明显特异性条带,表明OMP25与OMP31蛋白具有良好的免疫学活性(图6)。
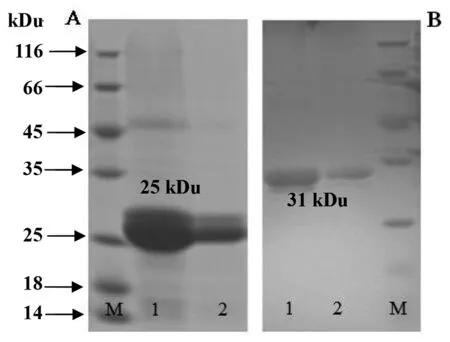
A:1,OMP25蛋白用500 mmol/L咪唑洗脱结果;2,OMP25蛋白用200 mmmol/L咪唑洗脱结果A:1,OMP31蛋白用500 mmol/L咪唑洗脱结果;2,OMP31蛋白用200 mmmol/L咪唑洗脱结果M:蛋白分子量Marker图5 OMP25与OMP31目的蛋白的纯化Fig.5 Purification of OMP25 and OMP31 target proteins

A:OMP25蛋白免疫印迹分析;B:OMP31蛋白免疫印迹分析;M:蛋白分子量Marker图6 OMP25与OMP31目的蛋白Western blotting鉴定Fig.6 Western Blot analysis of OMP25 and OMP31 proteins expression
2.5羊布鲁氏菌病PPA-ELISA检测试剂盒最佳反应条件的确定 经以上ELISA检测确定,OMP25与OMP31蛋白的最佳配比浓度为4∶1;混合蛋白的最佳包被浓度为10 μg/mL;最佳包被时间与温度分别为37 ℃ 1 h;血清的最佳稀释倍数为1∶50倍稀释;血清最佳孵育时间37 ℃ 1 h;酶标二抗最佳工作浓度为1∶2 000倍稀释,最佳孵育时间为37 ℃ 1 h;底物最佳显色时间为37 ℃ 15 min。
2.6阴阳性临界值的确定 应用已优化的最佳ELISA反应条件,对40份羊布鲁氏菌病阴性血清进行ELISA测定。经测定,其平均值X为0.208,标准差为0.053,即当样本OD450nm值≥0.367时判为阳性,当样本OD450nm值≤0.314时判为阴性,OD450值处于两者之间判为可疑。
2.7PPA-ELISA检测试剂盒特异性试验 应用以上组装的羊布鲁氏菌病抗体检测ELISA试剂盒,分别对大肠杆菌、巴氏杆菌、沙门氏菌、羊布鲁氏菌阳性血清进行检测。结果显示,应用该试剂盒,大肠杆菌、巴氏杆菌与沙门氏菌病阳性血清均为布鲁氏菌阴性,而羊布鲁氏菌阳性血清其OD450nm值为1.051,为强阳性。该结果说明,本试剂盒具有较好的特异性(见表1)。
表1 羊布鲁氏菌病抗体PPA-ELISA检测试剂盒特异性试验结果Tab.1 Results of PPA-ELISA test kit specificity test for antibody against sheep brucellosis

常见病阳性血清布鲁氏菌阳性/阴性血清大肠杆菌巴氏杆菌沙门氏菌Positive controlNegative controlOD4500.2190.1280.0771.0120.055S/P---1.00
2.8羊布鲁氏菌病抗体PPA-ELISA检测试剂盒敏感性试验 将羊布鲁氏菌病阳性血清分别进行系列稀释后,应用ELISA试剂盒,按以上最佳条件进行检测,结果显示,羊布鲁氏菌病阳性血清稀释度为1∶6 400时,其OD450nm值处于临界状态(P/N值为0.335),表明该试剂盒具有较强的敏感性(图7)。
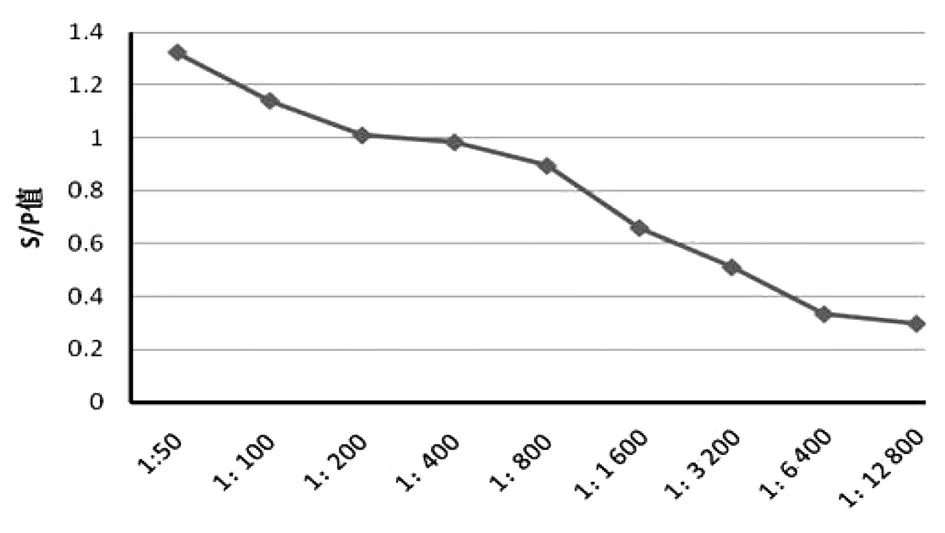
图7 PPA-ELISA试剂盒敏感性试验Fig.7 Sensitivity test of PPA-ELISA kit
2.9羊布鲁氏菌病抗体PPA-ELISA检测试剂盒重复性试验 经检测,结果显示,该羊布鲁氏菌病抗体检测ELISA试剂盒的批内变异系数为0.42%~1.85%,均小于5 %(见表2);批间变异系数为0.48%~7.65%,均小于10%(见表3);说明该试剂盒具有良好的重复性。
表2 羊布鲁氏菌病抗体PPA-ELISA检测试剂盒批内重复性试验结果Tab.2 Results of PPA-ELISA test kit in-batch repeatability test for antibody against Sheep Brucellosis

样品重复次数( S/P )平均值标准差变异系数12345678xSCV/%10.7860.7950.7740.7690.7520.7710.7820.7940.7780.0141.79920.8570.8660.8410.8610.8540.8500.8640.8690.8580.0091.04930.6590.6730.6420.6510.6630.6600.6490.6680.6580.0101.52040.7150.7060.7130.7150.7210.7140.7090.7110.7130.0050.70150.7390.7290.7310.7300.7350.7340.730.7350.7330.0030.40960.5990.5870.5890.5950.5940.5980.5910.5900.5930.0040.67570.6790.6780.6880.6750.6810.6900.6860.6790.6820.0050.73380.5770.5720.5690.5810.5670.5710.5730.5690.5720.0050.87490.5990.5970.5910.5930.5890.5970.5940.5920.5940.0030.505100.7290.7320.7350.7280.7290.7310.7360.7280.7310.0030.410
表3 羊布鲁氏菌病抗体PPA-ELISA检测试剂盒批间重复性试验结果Tab.3 Results of PPA-ELISA test kit of repeated test between batches of antibody against sheep brucellosis
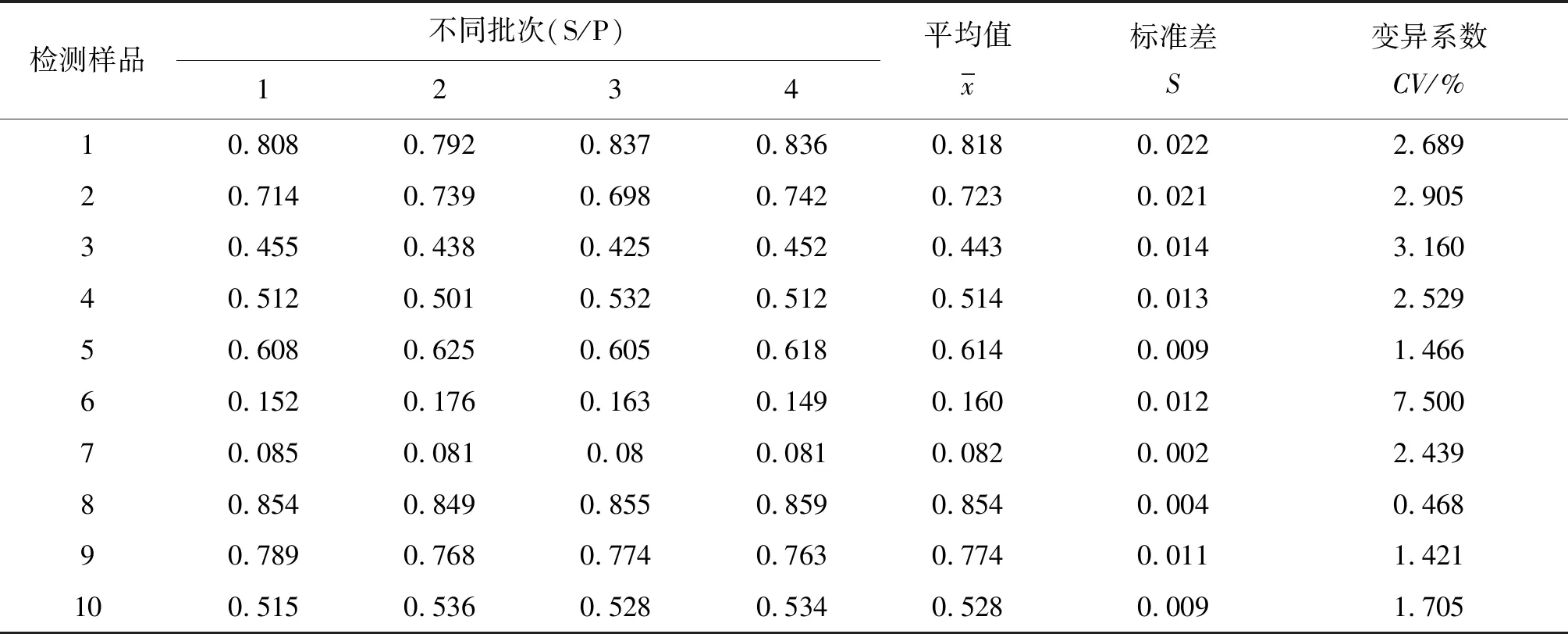
检测样品不同批次(S/P)1234平均值x标准差S变异系数CV/%10.8080.7920.8370.8360.8180.0222.68920.7140.7390.6980.7420.7230.0212.90530.4550.4380.4250.4520.4430.0143.16040.5120.5010.5320.5120.5140.0132.52950.6080.6250.6050.6180.6140.0091.46660.1520.1760.1630.1490.1600.0127.50070.0850.0810.080.0810.0820.0022.43980.8540.8490.8550.8590.8540.0040.46890.7890.7680.7740.7630.7740.0111.421100.5150.5360.5280.5340.5280.0091.705
2.10羊布鲁氏菌病抗体PPA-ELISA检测试剂盒与布鲁氏菌虎红平板凝集试验对比性试验 对来自山东省部分地区的、布鲁氏菌虎红平板凝集试验检测为阳性的63份血清与检测为阴性的80份血清,分别应用本研究的羊布鲁氏菌病抗体检测ELISA试剂盒进行检测。结果显示,63份阳性血清中,ELISA检测阳性为60份,阴性为3份;80份阴性血清张,ELISA检测阳性为10份,阴性为70份。因此,羊布鲁氏菌病抗体检测ELISA试剂盒相对于布鲁氏菌虎红平板凝集试验的符合率为91.4%,敏感性为95.2%,特异性为87.5%(见表4)。
表4 羊布鲁氏菌病抗体PPA-ELISA检测试剂盒与虎红平板凝集试验对比性试验结果Tab.4 Comparison between PPA-ELISA test kit and tabular agglutination test results

虎红平板凝集试验符合率/%敏感性/%特异性/%阳性阴性酶联免疫阳性601091.495.287.5吸附试验阴性370
3 讨 论
传统的布鲁氏菌病血清学检测方法包括虎红平板凝集试验、试管凝集试验和补体结合试验等,与ELISA检测方法相比,以上方法具有敏感性低,易与大肠杆菌、耶尔森氏菌发生交叉反应等缺点。因此,新制定的中华人民共和国国家标准(GB/T 18646-2018)将ELISA方法列为了动物布鲁氏菌病的标准诊断技术。另一方面,葡萄球菌A蛋白(SPA)可与多种动物血清IgG Fc片段结合,因此,将其与辣根过氧化物酶偶联形成酶标葡萄球菌A蛋白(PPA)作为酶标第二抗体,则具有应用范围广的优点,可做为猪、牛等其它动物布病抗体检测的辅助手段。因此,本研究以猪种布鲁氏菌S2株OMP25与OMP31外膜蛋白为抗原,以PPA为二抗建立了羊布鲁氏菌病间接ELISA检测方法,从而为羊布鲁氏菌病的防控提供参考。OMP25与OMP31均属于布鲁氏菌的第三组外膜蛋白,在维持细菌外膜结构中发挥着重要作用,与布鲁氏菌的毒力、胞内生产机制密切相关。研究发现,布鲁氏菌OMP25蛋白还是一种重要的免疫反应调节蛋白,可抑制宿主细胞分泌TNF-a,从而使布鲁氏菌可以在宿主细胞内长期存活。OMP31蛋白位于布鲁氏菌菌体表面,在不同感染动物的血清中均能检测到该蛋白的抗体。本课题应用Western blotting检测方法,对不同动物来源、不同种属的布鲁氏菌阳性抗体进行了敏感性与特异性检测。结果显示,虽然OMP25与OMP31基因高度保守,但其对不同种属的布鲁氏菌阳性血清敏感性与特异性有很大差异。为了提高ELISA检测方法的敏感性、扩大该方法的检测范围,本研究在表达纯化了OMP25与OMP31重组蛋白的基础上,将OMP25与OMP31蛋白以不同比例包被96孔聚苯乙烯微孔板,建立了间接ELISA诊断试剂盒,对试剂盒指控标准及保存期等进行了检验。研究结果表明,建立的ELISA及组装的试剂盒具有良好的敏感性和特异性,无血清交叉反应,操作简便,可重复性强,便于保存和运输,可用于临床布鲁氏菌病的检测及疫苗免疫效果的评价。
利益冲突:无
引用本文格式:王海丽,董炳梅,李芬,等.布鲁氏菌OMP25与OMP31蛋白的表达及其间接ELISA诊断试剂盒研制[J].中国人兽共患病学报,2019,35(5):404-410.DOI:10.3969/j.issn.1002-2694.2019.00.050
