盐酸伊立替康纳米胶束制剂耐受性和药效学评价
2019-05-23武卫党慈小燕郭传敏伊秀林刘昌孝
崔 涛,武卫党,慈小燕,李 薇*,郭传敏,徐 静,伊秀林,刘昌孝
(1天津中医药大学,天津 301617;2天津药物研究院新药评价有限公司,天津 300301;3国家纳米科学中心,北京 100190)
伊立替康是半合成的喜树碱衍生物,1998年获得FDA批准用于标准化疗方案失败后的转移性结直肠癌治疗。是FDA继氟尿嘧啶(5-FU)以后再次批准用于转移性结直肠癌一线治疗的化疗药[1]。除了结直肠癌,目前伊立替康临床还应用于胃癌[2]、胰腺癌[3]、肺癌[4]、乳腺癌[5]、卵巢癌[6]、宫颈癌[7]等多种肿瘤的临床治疗。临床应用过程中,伊立替康有许多不良反应,如腹泻、骨髓抑制、无力、急性胆碱能综合征、肠道反应等[8]。为了降低不良反应,提高疗效,开发新的制剂是一种较经济和周期较短的方法。由于多数实体瘤生长较快,需要丰富的血液供应,所以肿瘤组织中血管丰富,但是其血管内皮细胞间隙较宽,结构不完整,缺少肌肉层,同时肿瘤组织中还有许多血管通透性物质的广泛生成和交互作用[9],肿瘤组织处淋巴回流功能不全[10],这就使脂质体、纳米颗粒及其他大分子药物在肿瘤组织的通透性增加,清除率降低,进而产生了被动靶向性和滞留效应,即EPR效应(enhanced permeability and retention effect)。Greish等[11]报道,相对分子质量大于40 kD的大分子抗肿瘤药物能够克服肾脏的滤过清除,从而使药物的血浆半衰期延长,有利于实现EPR效应。基于这个原理,国家纳米科学中心开发了伊立替康新型纳米制剂,新制剂是以聚乙二醇-二硬脂酰基磷脂酰乙醇胺(PEG2000-DSPE)为包载材料制成的粒径分布为5~20 nm的纳米胶束,该新型制剂主要通过保护盐酸伊立替康免受体内降解酶的破坏和提高其肿瘤组织的靶向性而达到减毒增效的目的。本研究通过对盐酸伊立替康纳米胶束制剂及市售制剂最大耐受剂量(MTD)和体内外抗肿瘤效果的评价分析,探讨了该制剂在毒性和抗肿瘤效果上的改善情况。
1 材 料
1.1 药品与试剂
RPMI 1640培养基、胎牛血清(FBS)、胰酶(美国Gibco公司);MTS一步法细胞活力检测试剂盒(美国Promega公司)。盐酸伊立替康注射液(商品名:Campto,批号:T07958,美国Pfizer公司);注射用盐酸伊立替康纳米胶束(批号:20180702DM,国家纳米中心)。
1.2 仪 器
Zenyth 1100多功能扫描仪(奥地利Anthos公司);IC 1000 Countstar全自动细胞计数仪(上海睿钰生物科技有限公司);HFsafe生物安全柜(力康生物医疗科技控股有限公司);HERAcell 150i CO2培养箱(Thermo Scientific公司);数显游标卡尺(广陆数字测控股份有限公司)。
1.3 细胞株与实验动物
结直肠癌细胞株COLO205、HT-29、HCT-8、SW480均购于北京协和细胞资源中心。BALB/c裸鼠,SPF级,体重15~20 g,购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006。动物饲养及使用均在天津药物研究院新药评价有限公司动物房,许可证号:SYXK(津)2016-0009,动物试验方案经过了IACUC批准。
2 方 法
2.1 体外细胞毒性研究
收集对数生长期的COLO205、HT-29、HCT-8、SW480细胞,以新鲜培养基调整细胞浓度至每毫升5×104个细胞,将细胞液加入至96孔板中,每孔100 μL,在5% CO2、37 ℃条件下培养24 h。以培养基按3倍稀释度配制1.8~1 800 μg/mL的Campto或者盐酸伊立替康纳米胶束系列浓度梯度,加入96孔板中,使药物终浓度为0.145~415 μg/mL,每个浓度设置4个复孔,空白对照组加入等体积培养基,继续培养48 h后,每孔加入MTS试剂30 μL,继续培养1~3 h,应用荧光扫描仪在492 nm处测定每孔的吸收度。细胞生长抑制率(%)=(对照组吸收度-给药组吸收度)/对照组吸收度×100。
2.2 BALB/c荷瘤小鼠模型构建
收集处于对数生长期的COLO205细胞,调整为每毫升1×108个细胞的细胞悬液,将细胞悬液接种至BALB/c裸鼠腋窝皮下,每点100 μL,每只动物接种两个点。成瘤后,处死小鼠将肿瘤组织取出,于无菌条件下将肿瘤组织切成1 mm3左右的组织块,接种至新的裸鼠腋窝皮下,进行体内传代。体内传代两次后,选取肿瘤组织生长良好(平均肿瘤体积约100 mm3)的模型动物用于后期研究。
2.3 BALB/c荷瘤裸鼠最大耐受量(maximum tolerated dose,MTD)研究
BALB/c荷瘤裸鼠随机分组,每组8只(雌雄各半),尾静脉注射给予一定浓度的Campto或者盐酸伊立替康纳米胶束溶液,空白对照组给予5%葡萄糖注射液。受试药品的浓度设定参考前期昆明小鼠MTD实验结果(数据未列出),以昆明小鼠对于Campto或者盐酸伊立替康纳米胶束的MTD为起始给药剂量:①以前期所确定的正常动物MTD按比例因子1.25增加,直至出现急性死亡或注射1 d后所有动物出现毒性症状;②按比例因子0.8降低给药剂量,直至找到不出现急性死亡或注射1 d后不出现毒性症状的剂量,作为初步的MTD;③给药第2天,增加未出现动物死亡组别的动物数量(雌雄各增加1只),给予该组别药物。给药后连续观察7 d,观察指标包括体重、对外界刺激的反应、进食、排泄、被毛、呼吸、步态等,若观察期内不出现死亡、进展的毒性症状及体重与给药前相比下降15%,即可认为该剂量为MTD,否则继续按递减比例的剂量进行摸索,直至找到符合条件的MTD。
2.4 体内药效学研究
选取肿瘤体积100 mm3左右的荷瘤小鼠,随机分为5组,每组8只(雌雄各半)。根据前期MTD研究结果,Campto设置两个剂量组,分别为177.0和221.2 mg/m2;伊立替康纳米胶束设置两个剂量组,分别为276.5和345.6 mg/m2;空白对照组给予5%葡萄糖注射液。尾静脉注射给药,每周给药1次,连续3周。每天观察各组小鼠一般状态,包括体毛、神志、活动、饮食、饮水等。每周测量两次肿瘤体积,计算相对肿瘤增殖率T/C(%),与空白对照组比较,给药组肿瘤相对增殖率小于40%且具有统计学差异,视为具有抗肿瘤效果[12];每周测量两次动物体重,监测受试药物的毒性作用;实验结束后,摘取肿瘤,称量肿瘤湿重,计算肿瘤生长抑制率;摘取脏器心、肝、肾,福尔马林固定,5%硝酸脱钙、酒精逐级脱水,二甲苯透明,石蜡包理,切片,常规HE染色观察其病理变化。
2.5 统计学分析
3 结 果
3.1 体外细胞毒性研究分析受试药物对不同结直肠癌细胞株的生长抑制作用
通过体外细胞毒性试验,本研究获得了Campto及盐酸伊立替康纳米胶束对结直肠癌细胞COLO205、HT-29、HCT-8、SW480生长抑制的IC50,结果如表1和图1所示,两种制剂对几种细胞体外生长抑制作用并无明显差异,本研究选取抑制作用IC50最小的COLO205细胞构建荷瘤裸鼠模型,进行体内药效学研究。
Table1 IC50of Campto and nano-micelle irinotecan on colorectal cancer cellsinvitro(n=4)

CellIC50/(μg/mL)CamptoNano-micelle irinotecanCOLO20520.7513.05HT-2921.7918.72HCT-827.3421.44SW48095.3741.95
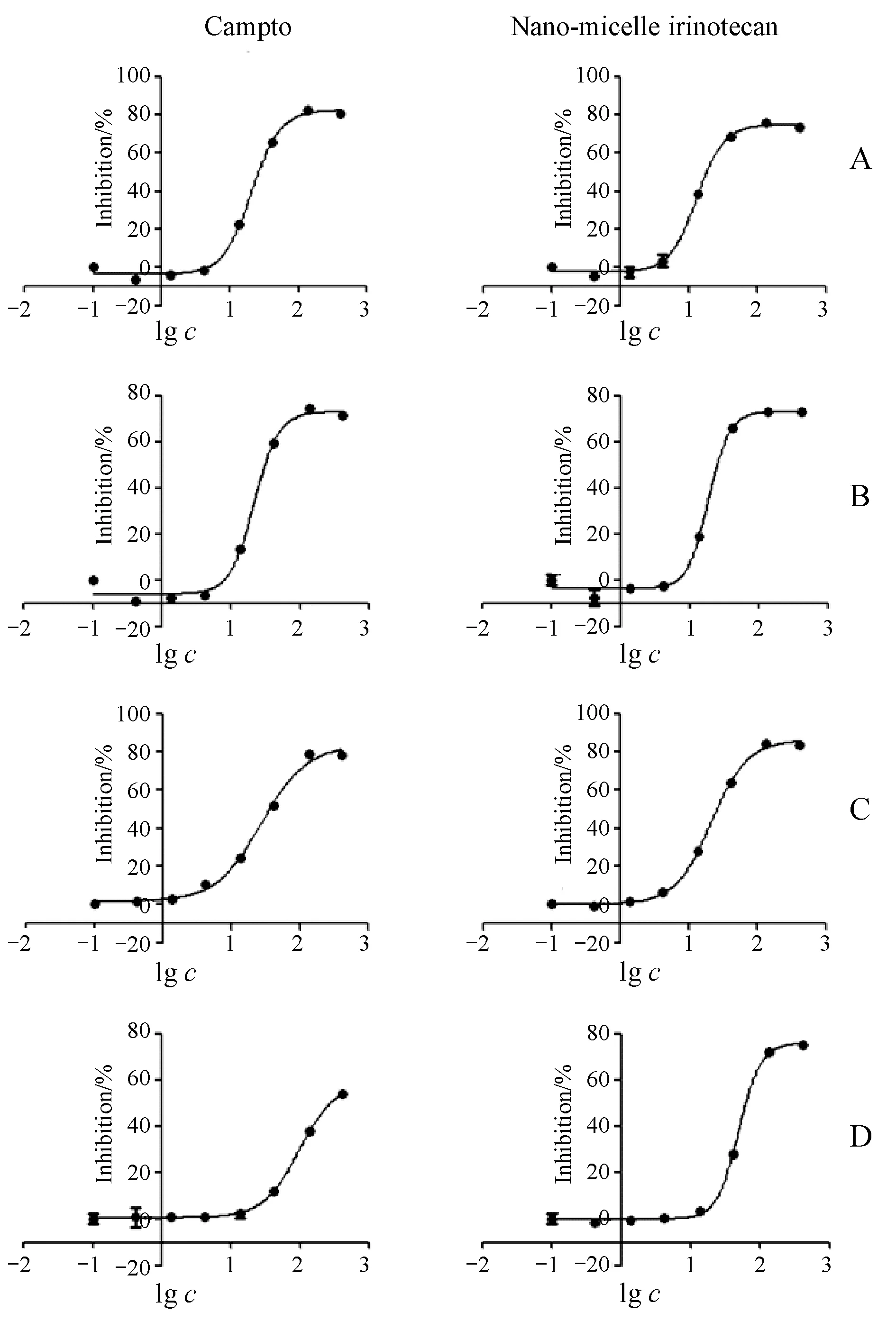
Figure1Inhibition rate of Campto and nano-micelle irinotecan with different concentrations on four types of colorectal cancer cells (n=4)
A:COLO205;B:HT-29;C:HCT-8;D:SW480
3.2 BALB/c荷瘤裸鼠对受试药物MTD的研究
参考前期昆明小鼠对于Campto及盐酸伊立替康纳米胶束MTD的研究,分别给予荷瘤裸鼠Campto 432.0、345.6、276.5及221.2 mg/m24个剂量,给予荷瘤裸鼠盐酸伊立替康纳米胶束540.0、432.0、345.6及276.5 mg/m24个剂量,测试荷瘤裸鼠对于Campto及盐酸伊立替康纳米胶束MTD。Campto 432.0、345.6 mg/m2剂量组及盐酸伊立替康纳米胶束540.0 mg/m2剂量组均在给药当天有动物出现急性死亡,其他给药组在第2天增加动物数量至10只,给药后连续观察7 d,没有发现动物有明显的毒性反应,各给药组与空白对照组相比也未出现平均体重下降的情况。由此确定COLO205荷瘤裸鼠对于Campto的MTD为276.5 mg/m2(区间范围为276.5~345.6 mg/m2),对于盐酸伊立替康纳米胶束的MTD为432.0 mg/m2(区间范围为432.03~540.04 mg/m2)。可以看出盐酸伊立替康纳米胶束制剂相对于Campto来说,提高了动物的最大耐受剂量,降低了药物的毒性。
3.3 体内药效学研究
BALB/c荷瘤裸鼠给药后,Campto及盐酸伊立替康纳米胶束给药组肿瘤体积均明显缩小(图2,图3)。给药后第21天(表2),各给药组相对肿瘤增殖率均小于40%,与空白对照组相比具有显著性差异(P<0.05),同时各给药组肿瘤湿重抑制率均大于80%,所以Campto及盐酸伊立替康纳米胶束各受试剂量均具有明显的抗肿瘤效果。两种制剂相比较,其中盐酸伊立替康纳米胶束345.6 mg/m2剂量组相对肿瘤增殖率显著低于Campto两个剂量组(P<0.05),同时肿瘤生长抑制率显著高于Campto两个剂量组(P<0.05)。由此可见,盐酸伊立替康纳米胶束制剂体内药效增加和给药剂量的提高是相关的。实验过程中各组动物体重无明显降低(图4),一般状态良好,无明显毒性反应。常规HE染色结果表明,与空白对照组比较,各给药组的心内膜、外膜光滑,心肌纤维排列整齐,胞浆丰富,横纹结构清楚,间质未见明显异常;肝小叶结构完整,肝细胞索排列整齐,肝细胞形态清晰,汇管区及间质未见明显异常;皮、髓质肾小球、肾小管结构完整,各种细胞形态清晰,间质未见明显异常(图5)。
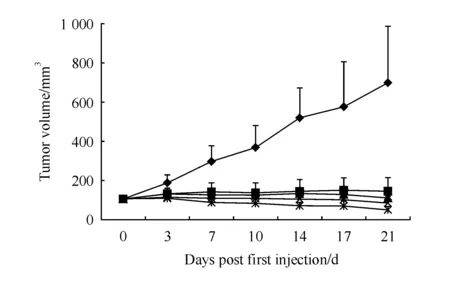

Figure3Tumor tissue after 21 days of administration

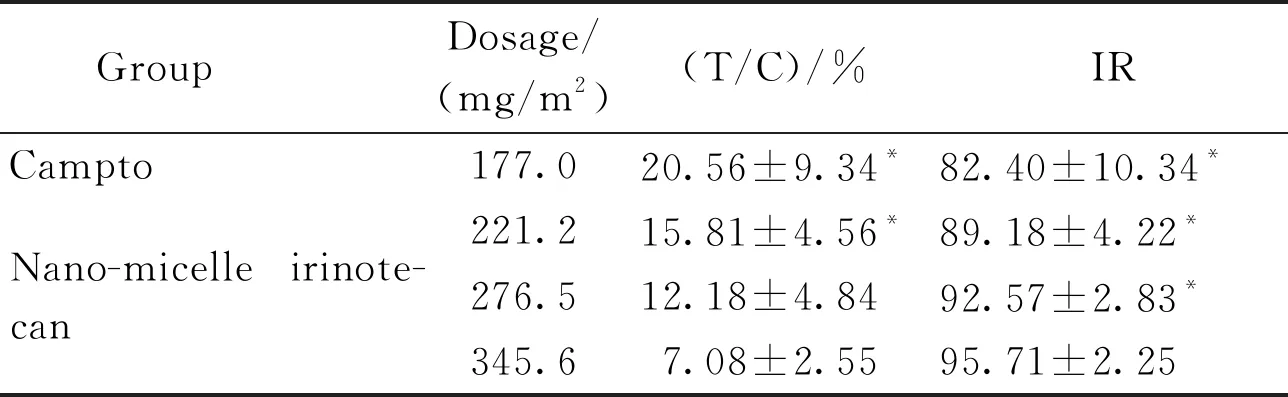
GroupDosage/(mg/m2)(T/C)/%IRCampto177.020.56±9.34*82.40±10.34*221.215.81±4.56*89.18±4.22*Nano-micelle irinote-can276.512.18±4.8492.57±2.83*345.67.08±2.5595.71±2.25
*P<0.05vsnano-micelle irinotecan 345.6 mg/m2


Figure5Pathological observation of heart,liver and kidney of mouse in each group (×10)
4 讨 论
众所周知,实体肿瘤由于生长迅速,组织中血管丰富,但其血管结构特殊,使得大分子药物能被动的靶向于肿瘤组织,进而减少其他组织的药物分布,增加肿瘤组织的药物浓度,从而降低药物的体内毒性,提高抗肿瘤效果。盐酸伊立替康是一种临床常用的较广谱的小分子前体抗肿瘤药物,其在体内可代谢为抗肿瘤活性较强的SN-38继而发挥作用,但SN-38毒性明显强于伊立替康。静脉滴注盐酸伊立替康后,体内药物浓度达到最高,因此活性代谢产物SN-38的浓度也随之增高,从而产生较严重的不良反应。盐酸伊立替康制备为纳米胶束后,一方面可提高其肿瘤组织的靶向性,增强疗效,同时减少其他组织脏器的分布,降低不良反应;另一方面可达到缓释的效果,稳定释放伊立替康,延长疗效,也降低了SN-38的瞬时药物浓度,减轻毒性。本文比较了伊立替康市售制剂及其纳米胶束制剂在荷瘤小鼠体内的最大耐受剂量及抗肿瘤效果,结果显示,荷瘤小鼠对纳米胶束制剂的最大耐受剂量较市售制剂有较大程度的提高,提示纳米制剂体内毒性降低;同时,由于纳米胶束制剂体内毒性降低,体内给药剂量得以提高,从而实现了更好的抗肿瘤效果。这提示伊立替康纳米胶束制剂值得更进一步深入研究,以期改善伊立替康的临床毒性,优化临床应用方案。
