碳包覆二氧化锰/石墨烯复合凝胶的制备与性能
2019-05-23王浩楠罗晓锋喻湘华
周 含,王浩楠,罗晓锋,喻湘华,李 亮
武汉工程大学材料科学与工程学院,湖北 武汉 430205
近几年,由于日益增加的环境问题和对电化学储能设备的广泛需求,引起科学界对绿色可持续发展的电化学储能设备的广泛兴趣。锰为基础的氧化物材料,因其具有高理论比电容、绿色环保、低毒性等优点被考虑应用于电化学储能设备中[1-7],然而,锰材料用做电极时会遇到如下问题:离子导电率较低;在充放电过程中出现非常大的体积膨胀[8-11]。这些缺点将直接影响锰材料电极的循环稳定性和电化学活性。根据Yao等[12]的研究将二氧化锰的长度控制在毫米级,直径控制在纳米级,可充分发挥二氧化锰的性能。另外,Li等[13]报道,选用多巴胺作为碳源,在碱性条件下,多巴胺在二氧化锰表面自聚,经煅烧处理,获得碳包覆二氧化锰(carbon coated manganese dioxide,C@MnO2)复合材料,这种核壳结构可以防止在充放电过程锰材料的体积膨胀,并且碳材料具有导电性,能提升二氧化锰的导电性能。
石墨烯(Graphene,Gr)是一种由碳原子以sp2杂化轨道组成的二维碳纳米材料。它具有优良的导电与导热性能,在常温下的电子迁移率超过15 000 cm2/(V·s)。因此它被广泛应用于构建超级电容器。本文结合石墨烯大的比表面积、低电阻率以及锰氧化物的高比电容,充分发挥二者的协同效应[14-15]。
在本工作中,首先制作超长二氧化锰(ultralong manganese dioxide,L-MnO2)纳米线,然后选用多巴胺作为碳源,在碱性条件下,多巴胺在L-MnO2表面自聚,再经煅烧处理得到碳包覆超长二氧化锰(carbon coated ultra-long manganese dioxide,C@L-MnO2),将 C@L-MnO2与氧化石墨烯(graphene oxide,GO)进行水热反应,得到碳包覆超长二氧化锰/石墨烯(carbon coated ultra-long manganese dioxide/graphene,C@L-MnO2/G)复合凝胶。进一步选取C@-MnO2和未经碳包覆的L-MnO2分别与GO反应,制得C@MnO2/G复合凝胶与L-MnO2/G复合凝胶,经对比发现C@L-MnO2/G的电化学性能更为突出。
1 实验部分
1.1 实验原料
硫酸锰、硫酸铵、过硫酸铵、多巴胺、氨水(上海国药集团化学试剂有限公司),GO(实验室自制)[16-18]。
1.2 材料的制备
1.2.1 L-MnO2纳米线的制备 将0.22 mol硫酸锰,0.22 mol过硫酸铵和0.72 mol硫酸铵加入36 mL水中,混合均匀,然后倒入水热反应釜进行水热反应,220℃恒温反应96 h,待反应完成用去离子水洗涤数次,在80℃下干燥,得到L-MnO2纳米线。
1.2.2 C@L-MnO2的合成 将0.5 g L-MnO2纳米线和0.15 g多巴胺分散到300 mL的pH为8.5的水溶液中,搅拌使多巴胺在L-MnO2纳米线自聚,得到多巴胺包覆超长二氧化锰(dopamine ultra-long managanese dioxide,D@L-MnO2),抽 滤 洗 涤 后 ,将D@L-MnO2在800℃氩气氛围下煅烧得到C@L-MnO2。
1.2.3 C@MnO2的制备 将1.12 g硫酸锰、2.85 g硫酸铵和1.51 g过硫酸铵分别加入30 mL去离子水中,再转移到水热反应釜中,在200℃加热12 h,过滤洗涤,并在60℃干燥得到普通二氧化锰。再按照1.2.2的步骤,将普通MnO2替换L-MnO2,制备C@MnO2。
1.2.4 C@L-MnO2/G复合凝胶的制备 将15、20、30和60 mg的C@L-MnO2分别加入到15 mL的4 mg/mL的GO溶液中,磁力搅拌3 h,然后将混合液移至水热反应釜中,在150℃下水热反应12 h,得到复合凝胶,此复合凝胶记作C@L-MnO2/G。选取C@MnO2和未经碳包覆的L-MnO2替换上述实验中的C@L-MnO2,重复以上实验制得C@MnO2/G和L-MnO2/G复合凝胶。
1.3 表征与测试
采用扫描电子显微镜(scanning electron microscope,SEM)(JSM-5510LV,日本电子株式会社)用来表征样品的微观形貌。X射线衍射仪(X-ray diffractometer,XRD)(XD-5A,日本 Shimadzu公司)用来表征样品的结构。采用CHI-660C型电化学工作站使用三电极体系进行测试分析其电化学行为。以压片电极作为工作电极,铂丝电极作为对电极,Ag/AgCl电极作为参比电极,压片得到的高密度石墨烯/聚苯胺薄膜作为工作电极,铂电极为对电极,Ag/AgCl电极为参比电极,电解液为0.5 mol/L的硫酸钠溶液分别进行恒电流充放电测试、交流阻抗测试。
2 结果与讨论
2.1 C@L-MnO2/G复合凝胶的合成
如图1所示,制备L-MnO2纳米线,再以多巴胺作为碳源,先在二氧化锰表面完成多巴胺的自聚,再煅烧得到C@L-MnO2,最后将C@L-MnO2与GO通过水热反应制备C@L-MnO2/G。

图1 C@L-MnO2/G复合凝胶的制备示意图Fig.1 Scheme of preparation of C@L-MnO2/G
为了研究加入不同量的C@L-MnO2对合成的C@L-MnO2/G复合凝胶的影响,图2给出了当C@L-MnO2与GO质量比为1∶4与1∶2时的复合水凝胶的实物图照片。可以观察到这2种比例均可以与GO复合成形貌完整的复合凝胶。

图2 不同C@L-MnO2与GO质量比合成的复合凝胶照片:(a)1∶4,(b)1∶2Fig.2 Photos of composite hydrogels prepared with mass ratios of C@L-MnO2and GO:(a)1∶4,(b)1∶2
2.2 SEM与XRD表征
L-MnO2和C@L-MnO2在不同放大倍率下的SEM图如图3所示。从图3(a)和 3(c)中可以看出,L-MnO2的长度在微米级,直径在纳米级,证明所合成的 L-MnO2与文献一致[12]。从图3(b)和图3(d)中可以看出,以多巴胺作为碳源的碳紧紧地包裹在二氧化锰表面,其形状为圆环状,说明高温煅烧使二氧化锰的微观结构发生变化,纳米线的微观结构被破坏,但仍能观察其一维结构。

图3 不同放大倍率SEM图:(a,c)L-MnO2,(b,d)C@L-MnO2Fig.3 SEM images at different magnifications:(a,c)L-MnO2,(b,d)C@L-MnO2
图4给出了L-MnO2和C@L-MnO2/G的XRD图。L-MnO2的晶型为α-MnO2型,与之前的报道一致[12]。经过碳包覆与石墨烯一起水热复合后,尽管在复合凝胶中由于石墨烯的包覆使得MnO2的结晶强度变弱,但仍能观察到它的晶型为α-MnO2型。

图4 L-MnO2和C@L-MnO2/G的XRD图Fig.4 XRD patterns of L-MnO2and C@L-MnO2/G
图5进一步给出了C@L-MnO2/G的SEM图。可以明显看出石墨烯的片层结构,相互堆叠成为三维空间网络结构。而且如图5中圆圈所示,石墨烯片层中穿插了一些一维结构的物质[与图3(d)一致],表明在复合凝胶中C@MnO2分布在石墨烯片层中。

图5 C@L-MnO2/G的SEM图Fig.5 SEM image of C@L-MnO2/G
2.3 电化学性能测试
2.3.1 恒电流充放电法 为探究材料的电化学性能,对复合凝胶进行电化学测试。比较图6(a)~图6(d)可以得知,相同扫描速率下,随着C@L-MnO2和GO质量比的增大,C@L-MnO2/G复合材料的恒电流充放电曲线的放电时间先增大后减小,表明C@L-MnO2/G复合凝胶的比电容随着质量比的增大呈现出先增大后减小的趋势,并在质量比为1∶2时达到最大,在电流密度为0.5 A/g时,最大比电容达到181.1 F/g,相应的,(a)、(b)和(d)组分的比电容在0.5 A/g依次为124.9、166.1、165.75 F/g。这说明随着C@L-MnO2的加入,提高了复合凝胶的比电容,但当C@L-MnO2加入量过多时,导致其在GO溶液中不能充分均匀分散,影响了水热反应所得到复合凝胶的结构,导致其电化学性能降低。
为了对比 C@L-MnO2与C@MnO2以及L-MnO2的电化学性能差异,以C@MnO2与GO质量比为1∶2和 L-MnO2与 GO 质量比为 1∶2分别合成C@MnO2/G复合凝胶和L-MnO2/G复合凝胶。比较图6(e)和图6(f),通过计算得到在电流密度为0.5 A/g时,C@MnO2/G复合凝胶和L-MnO2/G复合凝胶的比电容依次为113.9和71.8 F/g,可以看出,C@MnO2/G复合凝胶的比电容高于L-MnO2/GO复合凝胶,这说明碳包覆有利于与石墨烯的充分复合,碳包覆结构对比电容的提升有着更大的帮助。进一步对比图6(c)、图6(e)和图6(f),可以得知C@L-MnO2/G合凝胶的比电容远高于C@MnO2/G复合凝胶和L-MnO2/G复合凝胶,这是因为在C@L-MnO2/G复合凝胶中C@L-MnO2的微观结构及其与石墨烯发生协同作用的结果。

图6 不同电流密度下的恒电流充放电曲线:C@L-MnO2与GO质量比为(a)1∶4,(b)1∶3,(c)1∶2,(d)1∶1合成的C@L-MnO2/G复合凝胶,(e)C@MnO2与GO质量比为1∶2合成的C@MnO2/G复合凝胶,(f)L-MnO2与GO质量比为1∶2合成的L-MnO2/G复合凝胶Fig.6 Galvanostatic charge and discharge curves:C@L-MnO2/G prepared with C@L-MnO2/GO mass ratios of(a)1∶4,(b)1∶3,(c)1∶2 and(d)1∶1,(e)C@MnO2/G prepared with C@MnO2/GO mass ratio of 1∶2,(f)L-MnO2/G prepared with L-MnO2/GO mass ratios of 1∶2
由图7可知随着电流密度增大,C@L-MnO2/G复合凝胶的比电容逐渐减小,这是由于随着电流密度的增大,材料的电子传输效率逐渐变差。当C@L-MnO2与GO质量比为1∶2时,比电容达到最大,在0.5 A/g时的比电容为181.1 F/g,其比电容远高于C@MnO2/G复合凝胶(113.9 F/g)和L-MnO2/G复合凝胶的比电容(71.8 F/g)。这说明复合凝胶中C@L-MnO2与石墨烯之间存在相互作用,极大增强了复合凝胶的比电容性能。

图7 C@L-MnO2/G、C@MnO2/G、L-MnO2/G复合凝胶在不同电流密度下的比电容Fig.7 Specific capacitances of C@L-MnO2/G,C@MnO2/G and L-MnO2/G at different current densities
2.3.2 交流阻抗法 图8给出了C@L-MnO2/G复合凝胶的交流阻抗谱图。由图8可知所测得的交流阻抗谱图可以分为2个部分,高频区域的容抗弧和中频区域有一定斜率的直线。高频区域的圆弧与两部分阻抗有关,高频区域的半圆和阻抗实轴的交点表示的是电解液电阻Re,半圆弧的直径表示电荷转移电阻Rct,低频区域的直线对应为电解质溶液在电极孔隙内部的扩散传质进程,直线斜率的下降暗示着材料内部孔隙结构的变化和传质阻力的增大。直线斜率越大,表面材料的电容性能越好。C@L-MnO2与GO质量比为1∶4、1∶3、1∶2、1∶1合成的C@L-MnO2/G复合凝胶的电解液电阻Re的大小分别为1.62、1.72、1.54、2.22 Ω;电荷转移电阻Rct的大小分别为3.5、3.6、1.4、1.6 Ω。由此说明,C@L-MnO2与GO质量比为1∶2时合成的C@L-MnO2/G复合凝胶的高频区的弧线直径最小,且低频区的斜率最大,说明其电化学性能最佳。
2.3.3 循环稳定性测试 进一步测试了C@L-MnO2/G复合凝胶的电化学循环稳定性能。如图9所示,以100 mV/s的扫描速率扫描800圈后,C@L-MnO2/G的比电容保持率约在102%。这是因为C@L-MnO2制约了二氧化锰在充放电过程的体积变化,提高了其稳定性。C@L-MnO2与GO在复合凝胶材料中有效的相互作用以及多层次的微观结构共同作用使C@L-MnO2/G复合凝胶具有良好的电容性能。
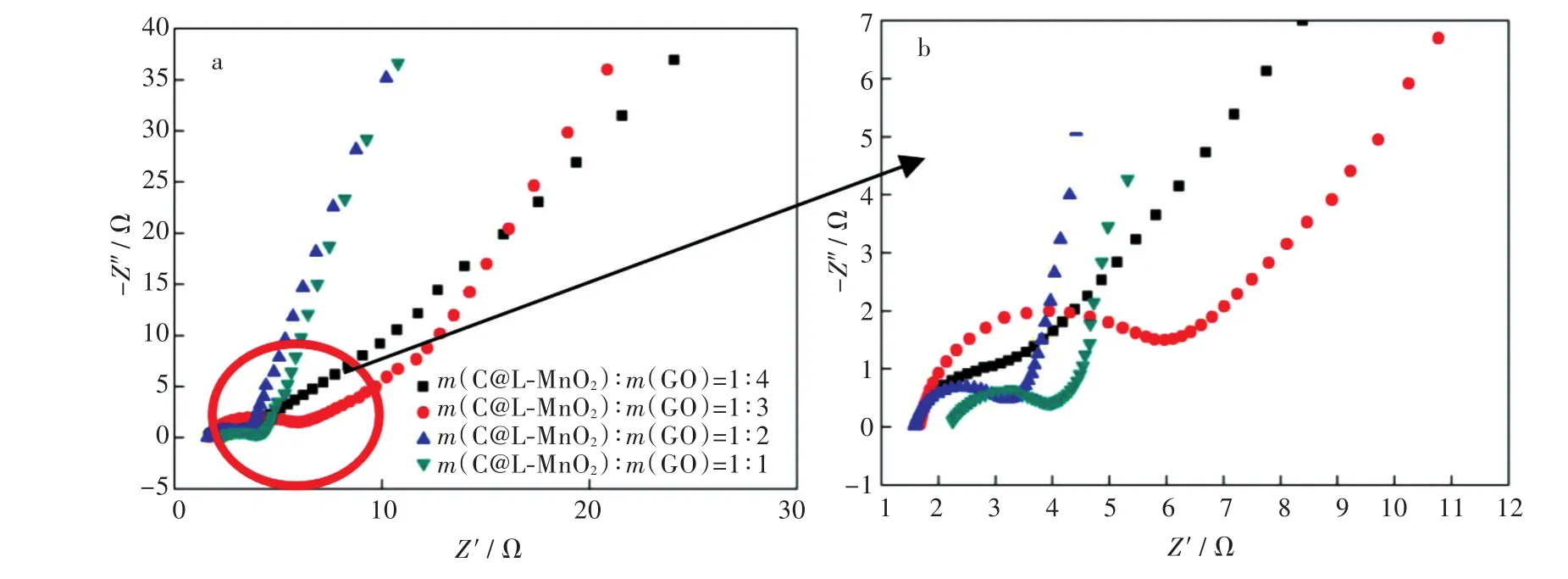
图8 (a)C@L-MnO2与GO不同质量比合成的C@L-MnO2/G的交流阻抗图,(b)为(a)的局部放大图Fig.8 (a)Alternating current impedance curves of C@L-MnO2/G prepared with mass ratios of C@L-MnO2and GO,(b)is a local magnification diagram of(a)

图9 C@L-MnO2与GO质量比为1∶3合成的C@L-MnO2/G复合凝胶在100 mV/s的扫描速率下扫描800圈的循环稳定性图Fig.9 Cycle tests of specific capacitance of C@L-MnO2/G prepared with mass ratio of C@L-MnO2and GO of 1∶3 at scanning rate of 100 mV/s after 800 cycles
3 结 语
本文介绍了一种制备碳包覆二氧化锰/石墨烯复合凝胶的方法,先以L-MnO2与多巴胺反应得到C@MnO2,再与GO水热反应得到复合凝胶。在复合凝胶中C@MnO2与石墨烯充分复合,二者之间相互作用,有效发挥了二氧化锰与石墨烯的物理化学性能,使得复合凝胶具有良好的比电容与电化学循环稳定性,该复合凝胶可用于超级电容器的电极材料。
