基于年龄因素的肠镜阴性人群与结直肠息肉患者肠道菌群结构及多样性研究
2019-05-22鲁弘骎陈晖黄颉刚
鲁弘骎,陈晖,黄颉刚
(广西医科大学研究生院,广西 南宁 530022)(广西医科大学第一附属医院老年消化内科,广西 南宁 530022)(广西医科大学公共卫生学院 广西艾滋病防治研究重点实验室,广西 南宁 530022)
结直肠息肉(colorectal polyps)是指任何突出于结直肠管腔内的隆起性病变,它具有潜在进展为结直肠癌的风险[1,2]。在中国有1.4%~20.4%的结直肠息肉患者会发生恶变[3]。已有的研究认为结直肠癌和结肠息肉患者的肠道菌群存在结构和功能的改变等潜因[4],肠道息肉病的发生与进展可能与肠道菌群失稳态有关[5],肠道息肉病的特征包括肠道菌群紊乱与肠黏膜屏障功能失调,提示肠道菌群的结构与丰度的变化在结直肠息肉的发生、发展过程中起着重要作用[6]。虽然,肠道微生物研究开展得较早,但基于年龄因素对结直肠息肉患者肠道菌群结构及多样性的研究却较少。笔者收集广西南宁地区结直肠息肉患者7例以及肠镜检查结果为阴性人群47例的粪便样本,应用细菌16S rDNA高通量基因测序技术,通过对测序数据、菌群差异性及相对丰度差异性的分析,基于年龄为主要风险因素,探寻肠道息肉显著相关的菌群结构及丰度的变化,为肠道息肉发生的风险评估及临床治疗提供科学依据与研究思路。
1 资料与方法
1.1 一般资料
研究对象为2018年6月至2019年1月在广西医科大学第一附属医院行常规肠镜检查的患者,包括结直肠息肉患者(术前)以及肠镜检查结果为阴性的人群。息肉病例(7例)均符合1982年全国结直肠癌协作组病理学者提出的息肉诊断标准,其中男性5例,女性2例,年龄31~82岁。肠镜阴性人群指排除结直肠息肉、肿瘤以及无明显的炎性肠道疾病者,作为对照组。对照组47例中男性34例,女性13例,年龄20~82岁。对照组按5∶2的男、女比例再筛分为对照一组(年龄≥40岁,14例)、对照二组(年龄<40岁,14例)。筛分原则参照息肉组的年龄与性别结构、年龄递增大致均衡、采样时段相同。各组性别、年龄差异无统计学意义(P>0.05),具有可比性。②排除标准:入组前2周内曾使用过抗生素、有其他消化道疾病、免疫性疾病或恶性肿瘤病史以及已服用息肉术前准备药物(息肉组)。此项研究通过医院伦理委员会批准,与所有纳入的研究对象签署了知情同意书,并以问卷调查方式获取患者相关信息。
1.2 样本采集
①准备2只采样管用于每例样本的采集(其中1只管含DNA稳定剂,标记包括姓名、性别、组别、样本编号)等关键信息;②采集粪便:用含DNA稳定剂的采样管采集两颗黄豆粒大小的样本,分别含1倍及2倍量的样本;③样本保存:样本采集完成立即存入冰盒中,然后置入专业冰箱中保存;④信息记录:详细记录采集对象的与本研究相关的信息。
1.3 基因组DNA提取和16S rDNA测序
根据E.Z.N.A.®soil试剂盒(Omega Bio-tek, Norcross, GA,U.S.)说明书进行总DNA抽提。提取的DNA浓度和纯度利用NanoDrop2000进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量。PCR扩增用338F(5’-ACTCCTACGGGAGGCAGCAG-3’)、806R (5’-GGACTACHVGGGTWTCTAAT-3’)引物对V4可变区进行PCR扩增。Illumina Miseq 测序:①2%琼脂糖凝胶回收PCR产物;②AxyPrep DNA Gel Extraction Kit (Axygen Biosciences, Union City, CA, USA) 进行纯化;③Tris-HCl洗脱;④2%琼脂糖电泳检测QuantiFluorTM-ST (Promega, USA) 进行DNA定量检测。根据Illumina MiSeq 平台 (Illumina, San Diego,USA)标准操作规程,将纯化后的扩增片段构建PE 2*300的文库。
1.4 数据分析及统计学方法
1)生物信息学方法。原始测序序列使用Trimmomatic软件质控,使用FLASH软件拼接:设置50bp的窗口,barcode精确匹配;引物允许2个碱基的错配,去除模糊碱基,根据重叠碱基overlap将两端序列进行拼接;应用UPARSE软件(version 7.1)在97%的相似度对序列进行OTU(Operational taxonomic units)聚类;使用UCHIME软件剔除嵌合体;利用RDP classifier各条序列进行物种分类注释;比对Silva数据库(SSU123),设置比对阈值为70%。
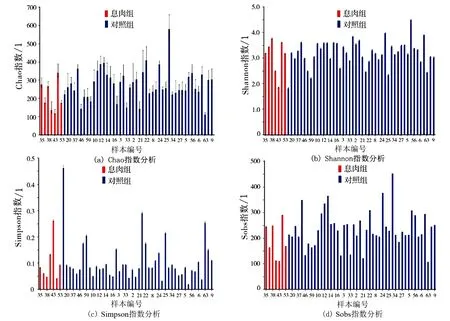
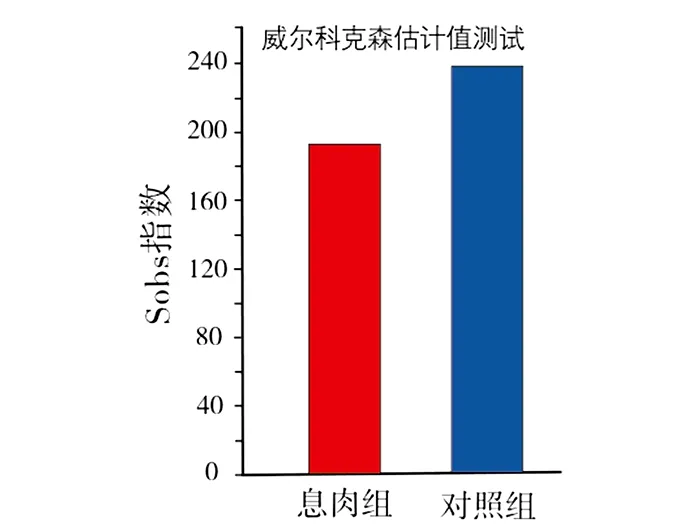
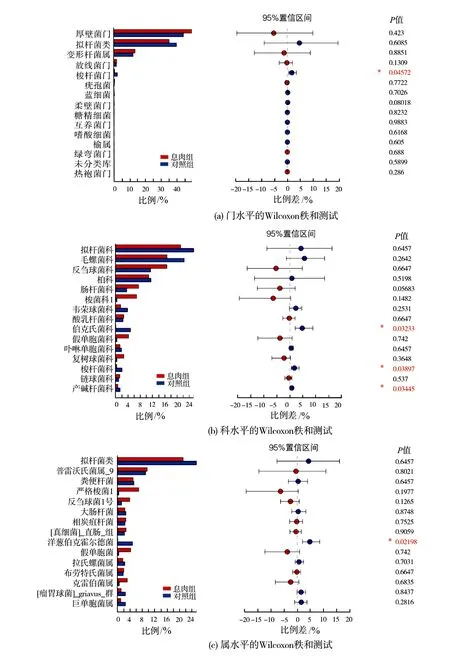
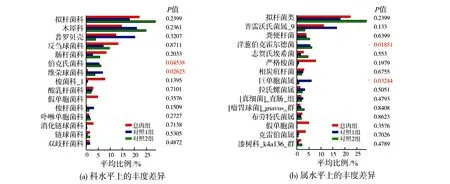
2)数据分析。①使用I-Sanger云平台进行高通量数据分析。门、科水平的α指数基于97%的序列相似性,属水平的α指数基于95%的序列相似性;②物种差异分析使用秩和检验法:指数组间差异检验取95%可信区间,P-value(P值)为假定值,用于判断原始假设是否正确(0.01 图1 息肉组与对照组的Venn图 息肉组与对照组总54个样本共获得1716985条可用的高质量序列,序列平均长度为252bp,所有样本文库的覆盖率达97%以上,表明各样本的测序量已达饱和。以97%相似度聚类,获558个OTU(图1):息肉组共获272个 OTU,对照组共获541个OTU。 Alpha多样性是指一个特定区域内的多样性,是一项反映物种丰富度和均匀度的综合指标。物种多样性的分析,是基于OTU种类和丰度计算Chao、Shannon、Simpson、Sobs(图2)等指数。 图2 息肉组与对照组的Alpha多样性指数分析 图3 息肉组与对照组的Sobs指数对比 Chao指数反映样本中物种的丰度,即OTU的数量。Shannon和Simpson指数用于反映群落的多样性,包括物种丰度和均匀度,Shannon指数值越大、Simpson指数值越小,物种多样性就越高。从图2中可看出,息肉组的Chao指数较对照组有下降趋势,即息肉组物种丰度总体上比对照组略低,但P=0.065,无统计学意义;息肉组的Shannon指数与对照组接近;息肉组的Simpson指数与对照组相比,平均值比较接近。但从Sobs指数对比图(图3)中可看出,对照组的物种种类较明显地多于息肉组。 息肉组与对照组的样本数比为7∶47。对比结果由OTU的Venn结果图以及在门、科属水平上的秩和测试条结果图中获得。 1)息肉组与对照组的肠道菌群构成不同。从OTU的 Venn结果图(图1)可以看出,息肉组和对照组样本的肠道菌群构成存在差异,即息肉组菌群丰度较对照组有显著降低。 2)应用秩和检验方法,分别在门、科、属水平上,对2组的肠道菌群丰度作对比分析。在门水平上,息肉组的梭杆菌门(Fusobacteria)相对丰度显著低于对照组(图4(a));在科水平上,息肉组伯克氏菌科(Burkholderiaceae)、梭杆菌科(Fusobacteriaceae)、产碱杆菌科(Alcaligenaceae)相对丰度显著低于对照组(图4(b));在属水平上,息肉组的洋葱伯克霍尔德菌(Burkholderia-Paraburkholderia)相对丰度显著低于对照组(图4(c))。 本次研究的息肉组平均年龄(62.71±12.50)岁,对照一组(55.00±13.90)岁,对照二组的平均年龄(32.00±17.99岁),息肉组平均年龄最大,对照二组最小。对照组筛分以40岁为界,是基于肠道息肉发病与年龄及性别因素的关系。 图4 息肉组与对照组在门、科、属水平上物种的相对丰度比较 1)息肉组与对照一组、对照二组的Alpha多样性对比结果见图5,P=0.065,差异无统计学意义(P>0.05)。 2)在科水平上,息肉组与对照一组、对照2组的对比结果见图6(a)。维荣球菌科(Veillonellaceae)(P=0.02623)、伯克氏菌科(Burkholderiaceae)(P=0.04538)的相对丰度差异具有统计学意义。其中,息肉组的相对丰度最低。 图5 息肉组与对照一组、对照二组的Alpha多样性对比 3)在属水平上,息肉组与对照一组、对照2组的对比结果见图6(b)。洋葱伯克霍尔德菌(Burkholderia-Paraburkholderia)(P=0.01851)、巨单胞菌属(Negamonas)(P=0.03244)的相对丰度差异具有统计学意义。其中,息肉组的相对丰度最低。 图6 息肉组与对照一组、对照二组的菌群在科、属水平上的丰度差异对比 通过在科、属水平上丰度的差异对比(图6)发现,与对照二组相比,息肉组与对照一组的维荣球菌科(Veillonellaceae)、巨单胞菌属(Megamonas)相对丰度明显下降,且具有一致性,提示随着年龄增大结直肠息肉发病风险也增大。 结直肠息肉为来源于黏膜上皮的局限性隆起[7],包括增生性和腺瘤性息肉[8],其中腺瘤性息肉约占结直肠息肉的70%,腺瘤性息肉恶变比例占80%以上[1]。结直肠息肉发病的危险因素包括:人口学因素、遗传因素、饮食因素、生活行为习惯、代谢性疾病、肠道微生物失稳态等[9]。结直肠息肉发病风险与年龄因素密切相关。Liebennan等[10]对美国327785名患者的资料研究结果提示肠息肉的发病风险随年龄增长而增大。结直肠息肉的发病率随年龄上升[11],小于40岁人群息肉检出率为20%~30%,而40岁以上人群检出率则上升至40%~50%;老年人大肠息肉检出率、癌变率均明显高于青中年,并随着年龄增长有增高的趋势[9]。另据黄小荣等[12]对我国浙北地区5320例接受结肠镜检查人群的研究,发现男性结直肠息肉病患多于女性;41~60岁为息肉高发年龄段[10]。不同年龄段人群的肠道微生态存在差异[13~15]。因此,研究结直肠息肉须综合考虑上述因素。既往的研究多侧重于结直肠癌与肠道息肉的相关性研究,该研究基于年龄因素,按发病风险依次递增的人群设计对照组的分组,使差异菌群辨别更为准确。息肉组与对照组的Alpha多样性研究结果:梭杆菌科、伯克氏菌科、洋葱伯克霍尔德菌的相对丰度较对照组下降,但该研究的息肉组的样本数似欠足够,有待今后足量样本的研究结果予以佐证。利用秩和检验法获得的统计学意义在于: 韦荣球菌科、巨单胞菌属相对丰度下降与结直肠息肉有关,提示随着年龄增大结直肠息肉发病风险也增加。下一步研究以下2个方面需加强:①息肉病例的病理分类;②肠镜阴性对照组的肠息肉发病的危险因素纳入。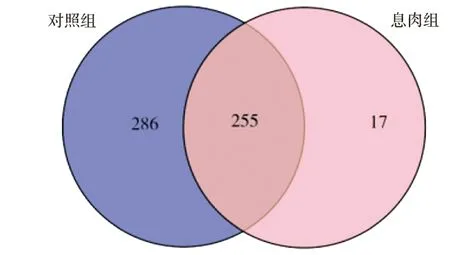
2 结果
2.1 测序数据
2.2 Alpha多样性分析结果
2.3 息肉组与对照组肠道菌群差异性及相对丰度对比
2.4 对照组不同年龄段肠道菌群结构与息肉组的相关性分析

3 讨论
