右旋糖酐的理化性质研究
2019-05-22王帅静蓝尉冰陈玉颖黄双霞齐鹏翔陈山
王帅静,蓝尉冰,陈玉颖,黄双霞,齐鹏翔,陈山*
(1.广西大学 轻工与食品工程学院,南宁 530004;2.广西大学 糖业工程技术研究中心, 南宁 530004;3.广西蔗糖产业协同创新中心,南宁 530004)
右旋糖酐是一种完全由α-D-吡喃葡萄糖单体聚合成的同型胞外多糖,其用途与聚合的葡萄糖分子数目密切相关,分子量不同,其应用领域也有所不同[1]。微小分子量(Mw<105Da)的右旋糖酐主要用于医学上,是目前最佳的血浆代用品之一,能阻止红细胞及血小板聚集,降低血液粘滞性[2]。中分子量(105Da
目前对右旋糖酐的研究多集中在制备机理以及聚合过程动力学,但是关于右旋糖酐的生理活性及在食品、化妆品中的应用研究却鲜有报道。本课题组前期通过研究不同中分子量的右旋糖酐(Mw:1951100,1047200,512000,253900,107500 Da)分别在吸湿保湿性、抗氧化性和抗过敏抗刺激性等方面的性质,得出低分子量右旋糖酐(Mw:107500 Da)抗氧化性优于其他高分子量右旋糖酐,但吸湿保湿性却略逊色些,且均有良好的安全性。本文将低分子量右旋糖酐(Mw:107500 Da)与其他高分子量右旋糖酐进行复配,测定其吸湿保湿性、抗氧化性、乳化性和乳化稳定性,探究其不同分子量之间的功效协同作用,为筛选合适的右旋糖酐分子量体系作为乳化增稠剂应用于食品、化妆品领域提供了参考。
1 实验部分
1.1 试剂与仪器
肠膜明串珠菌CICC-21724:中国工业微生物菌种保藏管理中心;果糖、蔗糖、葡萄糖、磷酸氢二钠、磷酸二氢钾、氢氧化钠、醋酸钠、冰醋酸、硫酸、氯化钙、3,5-二硝基水杨酸:AR,国药集团化学试剂有限公司;聚乙二醇6000、磷酸氢二钾、铁氰化钾、三氯化铁、三氯乙酸、十二烷基硫酸钠:AR,广东光华科技股份有限公司;牛肉膏、酵母膏:BR,北京奥博星生物科技有限公司;琼脂:BR,广东环凯生物科技有限公司;蛋白胨:BR,北京陆桥技术有限责任公司;鲁花花生油:购于南宁百货超市。
UV-1200紫外可见分光光度计 上海美谱达仪器有限公司;Aglient 1100 HPGFC色谱仪(配有示差折光检测器Aglient G1362A及Aglient GPC数据分析软件);LS-B50L立式压力蒸汽灭菌器 上海华线医用核子仪器有限公司;ZHJH-1115C垂直流超净工作台,ZHWY-211B全温度恒温培养振荡器 上海智城分析仪器制造有限公司;SHP-150生化培养箱 上海精宏实验设备有限公司;Avanti J-E多用途高效离心机 美国贝克曼库尔特有限公司;XH-C旋涡振荡仪 金坛市医疗仪器厂;HH-4 数显恒温水浴锅 常州国华电器有限公司。
1.2 方法
1.2.1 右旋糖酐蔗糖酶的制备及分离纯化
目前,由于右旋糖酐蔗糖酶(Dextransucrase,缩写为DS,合成酶)无商品酶,本实验所用的右旋糖酐蔗糖酶均为自制。基于课题组的前期研究,右旋糖酐蔗糖酶粗酶液制备及双水相萃取纯化方法如下[5]:
1.2.2 右旋糖酐蔗糖酶及右旋糖酐酶酶活力的测定
右旋糖酐蔗糖酶能够与单底物蔗糖发生反应,使D-吡喃葡萄糖基转移到右旋糖酐链上,生成的果糖单元与葡萄糖单元的量一样,因此,右旋糖酐的产量可通过换算果糖的生成量来测定。定义在25 ℃条件下,右旋糖酐蔗糖酶1 min内催化底物蔗糖生成1 μmol果糖所需要的酶量为1个酶活单位(U)[6]。一般情况下,果糖的生成量采用3,5-二硝基水杨酸法(即DNS法)来测定,根据吸光值与还原糖含量的线性关系计算酶活。
实验所用右旋糖酐酶(Dextranase,缩写为DN,分解酶)为商品酶。右旋糖酐酶仅对α-1,6糖苷键专一性水解,使大分子右旋糖酐分解成小分子的还原糖。采用Hens法测定酶解产生的还原糖,进而间接计算右旋糖酐酶的活力,右旋糖酐酶的酶活力定义为在25 ℃条件下,1 min内催化底物Dextran-70产生与1 μmol硫代硫酸钠的还原力相当的还原糖所需要的右旋糖酐酶的酶量。
1.2.3 不同分子量右旋糖酐样品的制备
基于课题组前期的研究[7],以蔗糖为反应底物,选取单酶法和游离双酶法2种方法构建5个终体积均为100 mL的反应体系,见表1。通过乙醇分级沉降制备不同分子量的右旋糖酐。
天祝牧区高寒草原生态安全2007~2014年呈现“安全”的状态,总体发展良好,但部分指标回落,超载率和草原退化率是制约该牧区高寒草原生态安全的主要因子。利用物元模型评价得出的天祝牧区高寒草原生态安全结果与实际客观情况较为吻合,说明该评价方法在高寒草原生态安全的评级中具有一定的应用价值。但是物元模型在高寒草原生态安全评价的研究较少,所以模型中量值范围的确定及模型的普适性仍需深入分析和研究。
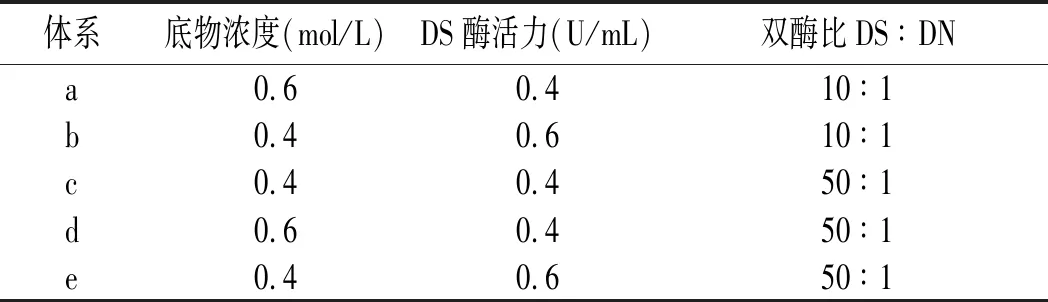
表1 酶法制备右旋糖酐的发酵体系Table 1 The fermentation system for preparation of dextran by enzymatic method
将以上体系置于25 ℃,120 r/min 条件下振荡培养30 h后,立即放入沸水浴中灭活。对体系1单酶法制得的发酵液经30%乙醇在45 ℃醇沉22 h离心得右旋糖酐大分子量样品。对体系2~5游离双酶法制得的发酵液采用分级醇沉的方法,先用40%的乙醇在40 ℃下沉降22 h离心得右旋糖酐中分子量样品,再用50%乙醇在34 ℃下沉降12 h离心得右旋糖酐小分子量样品。把通过乙醇醇沉制得的样品经真空冷冻干燥,去除产品中的乙醇和水分,打磨成粉置于干燥器中,用于后续实验。
1.2.4 HPGFC色谱条件及右旋糖酐分子量的测定
采用高效凝胶色谱法测定醇沉样品的分子量,HPGFC色谱检测条件为:安捷伦1100系统配RID示差检测器,色谱柱Shodex Sugar KS-801、KS-805和KS-guard(保护柱),流动相为超纯水,流速为1.0 mL/min,检测器温度为33 ℃,柱温箱温度为65 ℃。
将样品用0.45 μm微孔膜过滤,每次进样量为20 μL,平行操作3次。
1.2.5 吸湿性的测定
将样品于50 ℃烘箱内干燥48 h至质量恒定,准确称取1.000 g至相对湿度恒定的恒温恒湿培养箱内进行吸湿性实验,以透明质酸和海藻糖为对照。温度为30 ℃,湿度为81%。吸湿率计算公式为[8]:
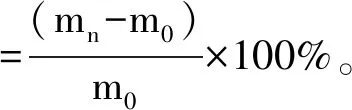
式中:m0为样品的初始质量,g;mn为放置n h后的样品的质量,g。
1.2.6 保湿性的测定
准确称取质量恒定的样品0.5000 g于称量瓶中,加入样品质量40%的蒸馏水,缓慢晃动称量瓶,待样品充分吸水后放入底部放有充分干燥硅胶的干燥器中,并置于30 ℃的培养箱中进行保湿性实验,以透明质酸和海藻糖为对照。保湿率计算公式为[9]:
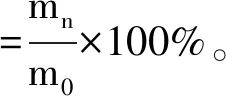
式中:m0为样品的初始含水质量,g;mn为放置n h后样品的含水质量,g。
1.2.7 抗氧化性的测定(铁离子还原力法)
在洁净的试管中分别加入不同浓度的多糖样品2 mL,pH 6.6的0.2 mol/L磷酸盐缓冲液2 mL和1%的铁氰化钾溶液2 mL,旋涡振荡仪振荡混匀后于50 ℃水浴20 min后迅速冷却,加入10%的三氯乙酸2 mL,混匀后离心(3000 r/min,10 min),取2 mL上清液、2 mL蒸馏水和0.4 mL 0.1%的FeCl3溶液混匀,静置10 min,空白对照以蒸馏水代替多糖,于700 nm处测吸光度值,吸光值越大,还原力越强。以Vc为对照。
还原力=样品吸光值-空白对照组吸光度。
1.2.8 乳化性及乳化稳定性的测定
将1 mL花生油和3 mL一定质量浓度的样品溶液混合,用旋涡振荡仪充分混匀1 min,用移液枪快速从杯底取100 μL溶液并加入到10 mL 0.1%的SDS溶液中,震荡混匀,立即在500 nm波长下比色(0.1% SDS为空白),测定0 min时的吸光值A0,静置10 min后取样,同样方法测A10,A0表示乳化活性(EA),乳化稳定性(ESI)表示为[10]:
ESI=(A0×△T)/(A0-A10)。
式中:ESI的单位为min;A0为0 min的吸光值;△T为测定两次乳化的时间间隔,本实验为10 min;A10为10 min的吸光值。光对较大颗粒敏感,因此吸光度越小,乳化活性越好。
2 标准曲线的建立及右旋糖酐分子量的检测的结果与分析
2.1 各标准曲线的建立
基于课题组的前期研究方法,对右旋糖酐蔗糖酶酶活测定中果糖的标准曲线进行绘制,并进行线性拟合,得到拟合方程为Y=0.82905X-0.03017,R2=0.9988,式中:X为果糖质量(mg),Y为样品在545 nm波长下的吸光度值。
右旋糖酐分子量校正曲线的建立:将重均分子量为667,5900,11800,22800,47300,112000,212000,404000,788000,2000000 Da的右旋糖酐标准品配制成10 mg/mL的溶液,在HPGFC色谱工作站条件下进行检测,以洗脱体积为横坐标,右旋糖酐分子量的对数值为纵坐标,绘制得右旋糖酐分子量校正曲线为Y=13.6199-1.54808X+0.11534X2-0.00379X3,R2=0.9998,式中:Y为右旋糖酐分子量的对数值,X为洗脱体积,R2值为0.9998。
2.2 右旋糖酐样品分子量的检测
通过乙醇分级沉降提取不同分子量的右旋糖酐,经高效液相色谱检测,右旋糖酐的分子量分布见表2。
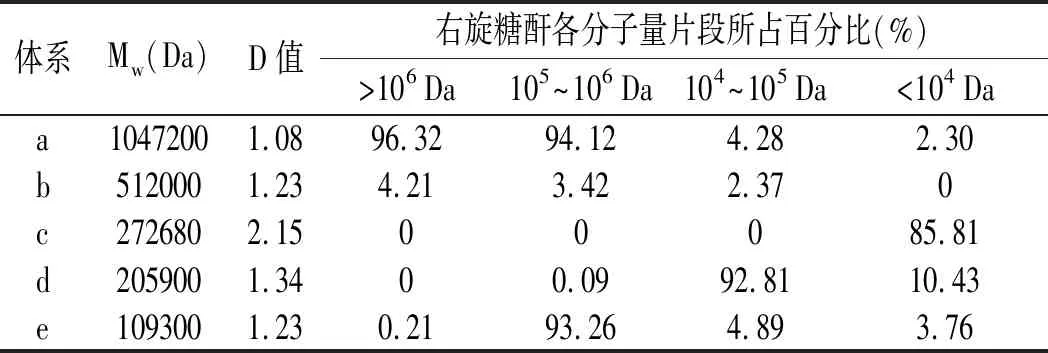
表2 右旋糖酐样品的分子量及分布Table 2 Molecular weight and its distribution of dextran samples
实验所用右旋糖酐样品的重均分子量分别为1047200,512000,272680,205900,109300 Da,分别表示为Dex-1000、Dex-500、Dex-270、Dex-200、Dex-100。
本实验所用4个复配体系分别为Dex-100与Dex-200、Dex-270、Dex-500、Dex-1000,记为体系1~4。
2.3 右旋糖酐的吸湿和保湿能力
用体外称重法测定右旋糖酐的吸湿性和保湿性,以样品的放置时间为横坐标,以吸湿率或保湿率为纵坐标作图,吸湿性结果见图1,保湿性结果见图2。

图1 Dex-100单一及复配体系和对照组的吸湿率Fig.1 The hygroscopicity of the single and complex systems with Dex-100 and control group

图2 Dex-100单一及复配体系和对照组的保湿率Fig.2 The moisture retention of the single Dex-100 and complex systems and control group
由图1可知,在30 ℃、相对湿度为81%的条件下,4种复配体系的吸湿性均优于Dex-100单一体系,且体系4表现出优异的吸湿性,与传统保湿因子透明质酸的吸湿能力相当,Dex-100以及4种复配体系的吸湿能力均优于“生命之糖”海藻糖。由图2可知,在30 ℃、强干燥环境下,Dex-100单一体系和4种复配体系的保湿能力相当,虽均逊色于透明质酸和海藻糖,但相差并不太大,且在24 h后仍具有5%左右的保湿能力。
右旋糖酐具有良好的吸湿保湿性可能与其本身结构中含有大量羟基和醛基有关,这些极性基团可与水分子形成结合力较强的氢键,氢键之间呈交织网状结构牢牢锁住水分。Dex-100右旋糖酐通过与高分子量右旋糖酐复配,可以提高其吸湿能力,原因在于高分子量右旋糖酐含有极性基团数目更多,因而表现出更强的氢键结合力。
2.4 右旋糖酐的抗氧化性
Fe3+在反应体系环境下,获得被测物质提供的电子而被还原为Fe2+,使得反应体系颜色加深,吸光度增大。吸光度越大,说明被测物质的还原力越强,即抗氧化能力越好。以各反应体系的质量浓度为横坐标,吸光度值为纵坐标作图,样品和对照样的抗氧化能力见图3和图4。

图3 Dex-100单一及复配体系对Fe3+的还原力Fig.3 The ferric reducing power of the single Dex-100 and complex systems
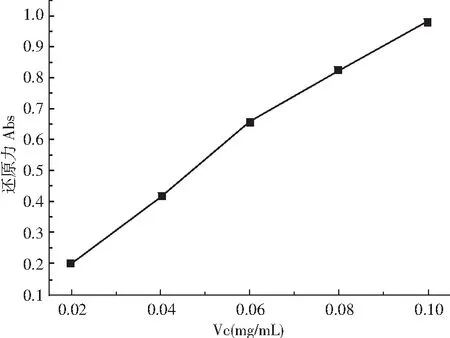
图4 对照样Vc对Fe3+的还原力Fig.4 The ferric reducing power of Vc for the control sample
由图3和图4可知,Dex-100和各复配体系以及对照样Vc的抗氧化能力均随浓度的升高而增大,Dex-100和Vc的抗氧化能力与浓度之间呈现出良好的线性关系。Dex-100和各复配体系均表现出一定的抗氧化能力,复配体系的抗氧化能力优于单一体系Dex-100,尤其是体系4表现更为明显,但与Vc相比,抗氧化能力仍相对较弱,当体系4中样品质量浓度达到15 mg/mL时的吸光度为0.063,Vc在质量浓度为0.02 mg/mL时的吸光度已达0.202。以上分析说明,右旋糖酐虽具有一定的抗氧化能力,与Vc相比并不理想,通过不同分子量右旋糖酐之间进行复配,可以适当提高其抗氧化性。
2.5 右旋糖酐的乳化性和乳化稳定性
右旋糖酐是乳酸菌属肠膜明串珠菌发酵而得的细菌胞外多糖,与植物多糖相比,具有高粘度、浓稠特性以及剪切稀释性等,可以在水相和油相之间形成稳定的乳化液。不同质量浓度的Dex-100的乳化性和乳化稳定性见图5,不同分子量右旋糖酐的乳化性和乳化稳定性见图6,Dex-100及各复配体系的乳化性和乳化稳定性见图7。
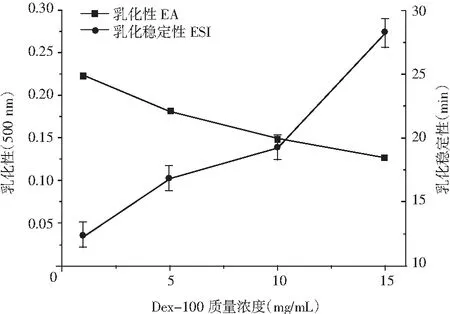
图5 不同质量浓度Dex-100的乳化性和乳化稳定性Fig.5 The emulsification and emulsion stability of Dex-100 with different mass concentration

图6 不同分子量右旋糖酐的乳化性和乳化稳定性Fig.6 The emulsification and emulsion stability of dextran with different molecular weights
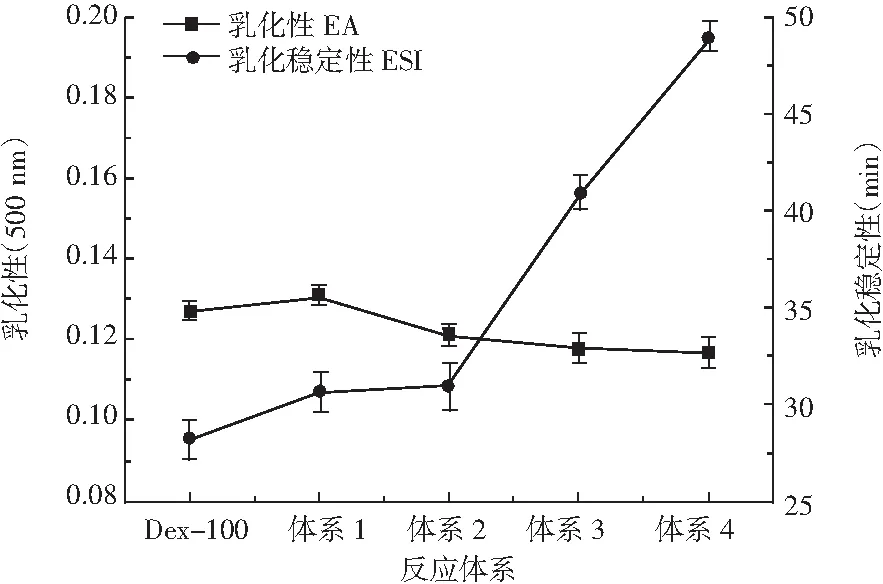
图7 Dex-100单一及复配体系的乳化性和乳化稳定性Fig.7 The emulsification and emulsion stability of the single Dex-100 and complex systems
由图5可知,右旋糖酐对油水溶液的乳化性和乳化稳定性具有浓度依赖性,Dex-100的乳化活性和乳化稳定性随着浓度的增加而呈现出增长的趋势,原因在于右旋糖酐作为胞外多糖,其组分的亲水性能够伸展到水相中,形成水化层,通过空间位阻以及静电作用保持稳定性,在浓度低时,多糖分子不足以包裹油滴形成乳浊液,随着浓度增大,体系粘稠度增加,使得乳化液更细腻也更加稳定。由图6和图7可知,高分子量右旋糖酐的乳化性和乳化稳定性要优于低分子量右旋糖酐,Dex-100单一及复配体系的乳化性没有很大区别,体系3和体系4的乳化稳定性较好,原因可能为高分子量右旋糖酐极性基团更多而能够形成更强的静电排斥力和空间位阻作用,也可能因为高分子量右旋糖酐的粘度较大,使得体系变粘稠,从而使乳化体系稳定性上升。
3 结论
本实验研究结果表明,在中分子量范围内,将十万分子量级别的右旋糖酐与相对较高分子量的右旋糖酐进行复配,各功效间协同作用能得出较好的实验结果,和百万分子量级别的右旋糖酐进行复配效果最佳,其吸湿保湿性和乳化活性较好,且具有一定的抗氧化能力。低分子量右旋糖酐(Mw:109300 Da)虽然具有良好的抗氧化能力,但其吸湿保湿性和乳化活性略逊色于高分子量右旋糖酐,通过将低分子量右旋糖酐与高分子量右旋糖酐进行复配,充分发挥了低分子量右旋糖酐良好的抗氧化能力和高分子量右旋糖酐良好的吸湿保湿性以及粘度大、乳化活性好的优点,为筛选合适的右旋糖酐分子量体系作为乳化增稠剂应用于食品、化妆品中提供了参考。
