京尼平对小鼠棕色和白色脂肪组织UCP1表达的影响*
2019-05-22申娜娜宫德正邹丰锴关莉莉
申娜娜, 宫德正, 邹丰锴, 严 宇, 关莉莉, 邹 原
(大连医科大学基础医学院生理教研室, 辽宁 大连 116044)
肥胖呈逐年上升趋势,与肥胖密切相关的代谢性疾病如2型糖尿病、高血压、心脑血管病、肿瘤等成为全球性公共健康问题,预防和治疗肥胖具有重要的意义[1]。已知脂肪组织可分为白色脂肪组织和棕色脂肪组织。白色脂肪组织主要功能是将能量以三酰甘油的形式储存于大脂滴中,同时分泌各种不同的内分泌激素(如瘦素,脂联素等)来调节人体能量平衡[2-3],白色脂肪组织中的脂肪细胞在某些因素作用下,可表达产热基因,增加能量消耗。这过程称为“白色脂肪组织棕色化”。棕色脂肪组织主要功能是通过解偶联蛋白1(uncoupling protein 1,UCP1)介导的解偶联作用,减少腺苷三磷酸(ATP)正常产生,将能量以热能的形式散发,参与非震颤性产热和供能,不仅维持体温平衡,还增加能量消耗,利于抵抗肥胖的形成等,因此促进棕色脂肪组织活化及白色脂肪组织棕化是改善肥胖的新策略[4]。
京尼平是中药栀子的主要成分栀子苷的水解产物。较多研究显示京尼平有抗炎、抗氧化,治疗糖尿病、癌症以及中枢神经系统疾病等作用[5-9]。我们前期研究证明京尼平可改善老龄大鼠胰岛素抵抗,降低食源性肥胖大鼠摄食量和体重的作用[7],但其对脂肪组织活化和棕化是否有作用,目前尚不清楚。因此,本研究观察京尼平对棕色脂肪组织活化和白色脂肪组织棕化的作用,以进一步了解京尼平降脂减肥的作用机制。
1 材料与方法
1.1 主要试剂
京尼平购自Wako公司/日本;TRIzol试剂购自天根生化科技有限公司;FastQuant cDNA第一链合成试剂盒购自天根生化科技有限公司;SuperReal荧光定量预混试剂(SYBR Green)购自天根生化科技有限公司;Western及IP细胞裂解液购自碧云天生化科技有限公司;BCA蛋白浓度测定试剂盒购自碧云天生化科技有限公司;Anti-UCP1抗体购自Abacam公司;Anti-β-actin抗体购自北京中杉金桥生物技术有限公司;山羊抗兔IgG(H+L)购自北京中杉金桥生物技术有限公司。
1.2 动物分组与处理
实验选用雄性8周龄C57BL/6J小鼠(购自大连医科大学实验动物中心)。实验遵循大连医科大学动物伦理规范要求。正常饮食、饮水,小鼠饲养在室温为22℃±2℃,湿度控制于55%~65%,昼夜时间均为12 h,适应一周之后,随机分为正常对照组、京尼平组和冷刺激组,每组10只。京尼平组小鼠给予腹腔注射京尼平处理(15 mg/(kg·d),连续9 d),对照组给予生理盐水处理,冷刺激组小鼠室温下处理4 d后,置于4℃寒冷环境中持续5 d(24 h/d)冷刺激处理。实验期间,每天监测各组小鼠的体温、摄食量和体重变化,在实验的第10日,采集各组小鼠皮下(腹股沟区)、内脏(附睾及肾周)的白色脂肪组织及肩胛间区的棕色脂肪组织,称量各脂肪组织的湿重,计算体脂率(脂肪质量/体重),之后将组织经液氮速冻后储存于-80℃备用。取肩胛下区、腹股沟区及附睾周围的部分脂肪组织观察形态学的变化,测定棕色脂肪组织、皮下白色脂肪组织以及内脏白色脂肪组织解偶联蛋白1(UCP1)的表达。
1.3 脂肪组织形态观察
制片:将肩胛下区、腹股沟区及附睾周围的部分脂肪组织置于10%的福尔马林液中,用梯度酒精脱水、浸蜡包埋,并通过切片机将其切成5~6 μm的薄片,烘干备用。HE染色:切片用二甲苯脱蜡,梯度乙醇(无水乙醇、95%乙醇、85%乙醇、75%乙醇)脱去二甲苯,加入苏木精染色,经1%盐酸酒精分化,此时细胞核及核糖体成蓝紫色。再加入伊红染料,细胞质呈现淡红色或者红色。二甲苯透明,盖片封片。
1.4 实时定量PCR分析
总RNA用TRIzol法提取获得;cDNA是用2 μg总RNA通过FastQuant cDNA第一链合成试剂盒(去基因组)方法制备;QPCR用SuperReal PreMix Plus(SYBR Green)试剂盒进行检测。UCP1的引物序列:Forward:5’-AGGCTTCCAGTACCATTAGGT-3’,Reverse: 5’-CTGAGTGAGGCAAAGCTGATTT-3’;β-actin的引物序列:Forward:5’-CCTAAGGCCAACCGTGAAAA-3’,Reverse:5’-CAGAGGCATACAGGGACAGCAC-3’。反应条件是95℃ 15 min×1, (95℃ 10 s、55℃ 30 s、72℃ 32 s)×40。荧光定量PCR结果均使用Agilent MX3005 Real Time PCR(美国)扩增仪检测得出。检测结果用2-△△CT法进行分析。
1.5 Western blot
组织剪碎后放入添加了PMSF的Western及IP细胞裂解液中充分裂解,取上清获得总蛋白。用BCA法测定蛋白浓度,采用SDS-PAGE电泳(BIO-RAD),之后将蛋白转至PVDF膜上。用TBST配置5%的脱脂奶粉常温下封闭1 h,清洗膜后在4℃条件下孵育一抗过夜。常温下孵育二抗1 h。凝胶成像分析系统(BIO-RAD)检测膜上目的条带发光亮度。ImageJ软件系统进行分析。
1.6 统计学处理
2 结果
2.1 京尼平对小鼠体重、摄食量和体温的影响
京尼平组小鼠的体重、摄食量与对照组相比无差异,但体温在实验的第8日后与对照组相比有差异(P<0.05,图1A、B、C)。冷刺激组小鼠进行冷刺激处理后第3日,体重下降,小于常温条件下的小鼠(图1A);摄食量大于常温下的两组小鼠,在实验第7日和第8日(冷刺激后第3日和第4日)时增加明显(P<0.01,图1B)。冷刺激处理可使小鼠体温显著下降(P<0.01, 图1C)。
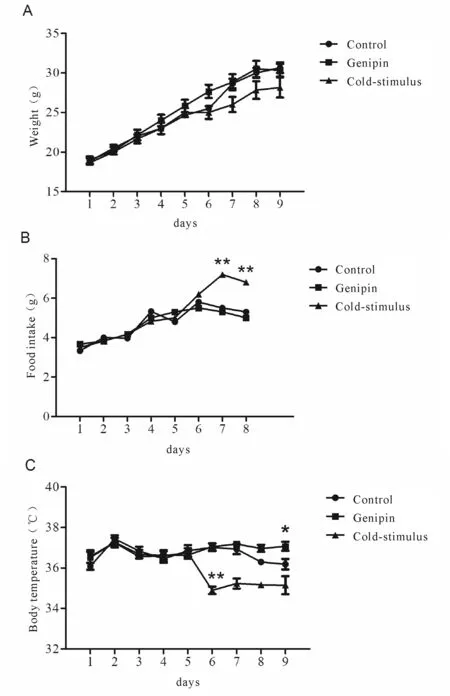
Fig.1Effects of genipin on body weight, food intake and body temperature of mice(n=10)
A: Body weight; B: Food intake; C: Body temperature. In the first four days, three groups of mice were in the normal temperature environment, and in the later five days, the mice with cold-stimulus were exposed to 4℃ environment
*P<0.05,**P<0.01vscontrol group
2.2 京尼平对脂肪组织湿重、体脂率的影响
与对照组相比,京尼平组棕色脂肪组织的湿重明显增加(P<0.05,表1);冷刺激组棕色脂肪组织湿重也有增加,但没有统计学差异(P>0.05,表1)。与对照组相比,京尼平组和冷刺激组白色脂肪组织的湿重明显减少(P<0.05,表1),体脂率亦明显减少(P<0.05,表1)。
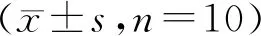

GroupWet weight of brown adipose(g)Wet weight of white adipose(g)Body fat rate(%)Control0.045±0.0080.331±0.0441.633±0.159Genipin0.066±0.003*0.277±0.033*1.200±0.113*Cold-stimulus0.058±0.0080.219±0.194*1.133±0.095*
*P<0.05vscontrol group
2.3 京尼平对脂肪细胞形态的影响
与对照组相比,京尼平组和冷刺激组的棕色脂肪细胞脂滴变小,数量增加(图2A1-A3)。京尼平组的皮下和内脏白色脂肪细胞均出现与冷刺激组相似的变化,与对照组脂肪细胞相比,细胞内脂滴变小,数量增加(图2B1-B3,C1-C3)。
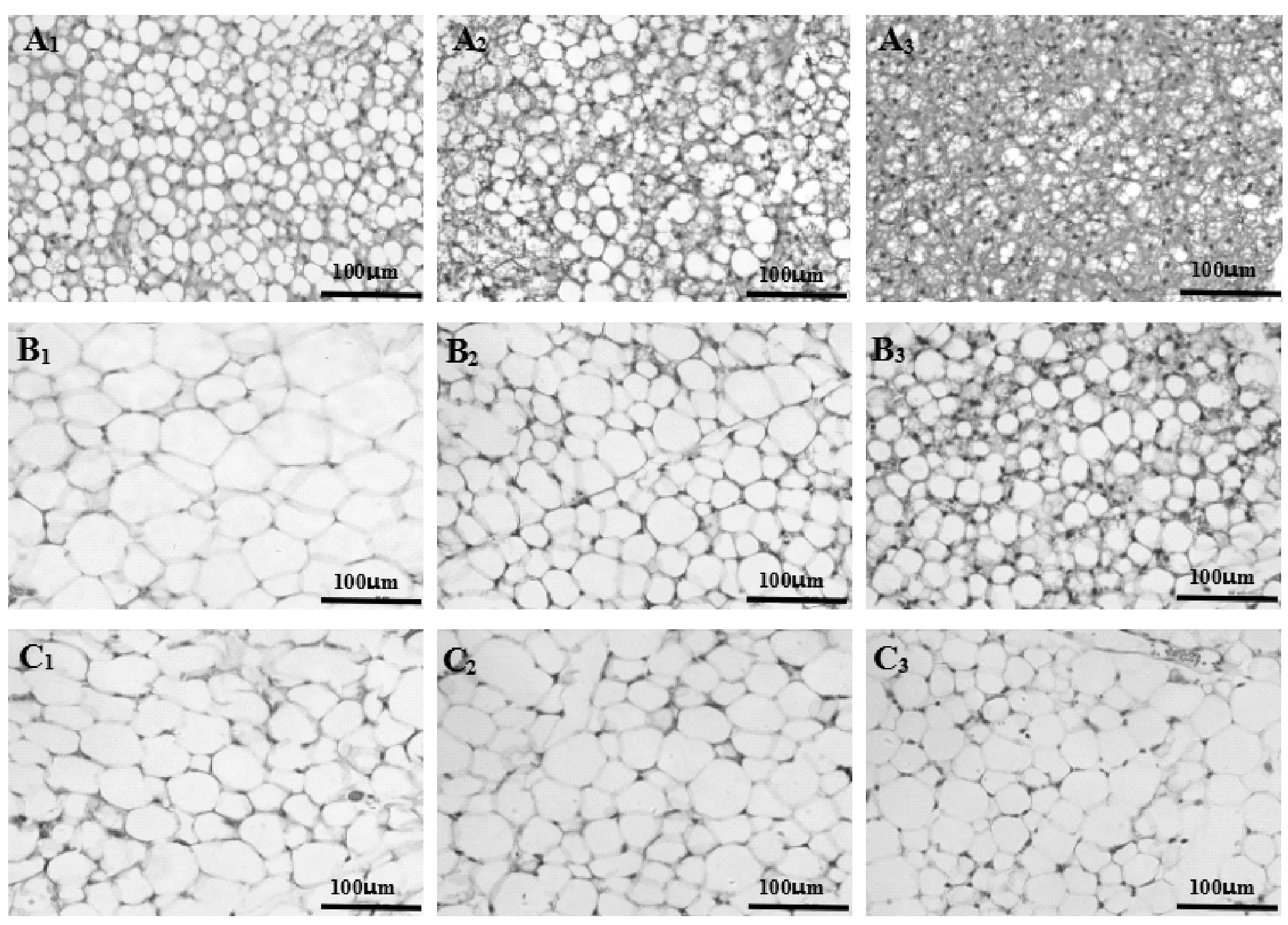
Fig.2Morphological analysis of adipose tissues after genipin treatment(HE staining ×200)
A1, A2 and A3 represent brown adipocytes of control group, genipin group and cold-stimulus group respectively; B1, B2and B3represent subcutaneous adipocytes of control group, genipin group and cold-stimulus group respectively; C1, C2and C3represent visceral adipocytes of control group, genipin group and cold-stimulus group respectively
2.4 京尼平对脂肪组织的UCP1 mRNA表达的影响
棕色脂肪组织中UCP1 mRNA水平在冷刺激组的表达量相对于对照组显著增加(P<0.01,表2);京尼平组的UCP1 mRNA水平的表达量与对照组相比也有显著增加(P<0.05, 表2)。皮下脂肪组织中,京尼平组和冷刺激组小鼠UCP1 mRNA水平均显著升高,与对照组相比差异显著(P<0.05,表2)。内脏脂肪组织中,京尼平组和冷刺激组的UCP1 mRNA水平相对于对照组均明显增加(P<0.05,表2)。
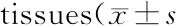

Group2-△△CT (BAT)2-△△CT(SAT)2-△△CT(VAT)Control1.000±0.1841.000±0.0201.000±0.076Genipin2.881±0.455*24.460±7.735*2.041±0.408*Cold-stimulus17.700±1.042**11.720±2.757*3.228±0.225*
BAT: Brown adipose tissue; SAT: Subcutaneous adipose tissue; VAT: Visceral adipose tissue
*P<0.05,**P<0.01vscontrol group
2.5 京尼平对脂肪组织的UCP1蛋白表达的影响
进一步观察京尼平对脂肪组织UCP1蛋白表达的作用。结果显示,棕色脂肪组织中,京尼平组和冷刺激组UCP1蛋白表达量,相对于对照组均明显增加(P<0.05, 图3A)。皮下白色脂肪组织、内脏白色脂肪组织中,京尼平和冷刺激处理后,UCP1蛋白表达量与对照组相比均明显增加(P<0.05和P< 0.01, 图3B,3C)。
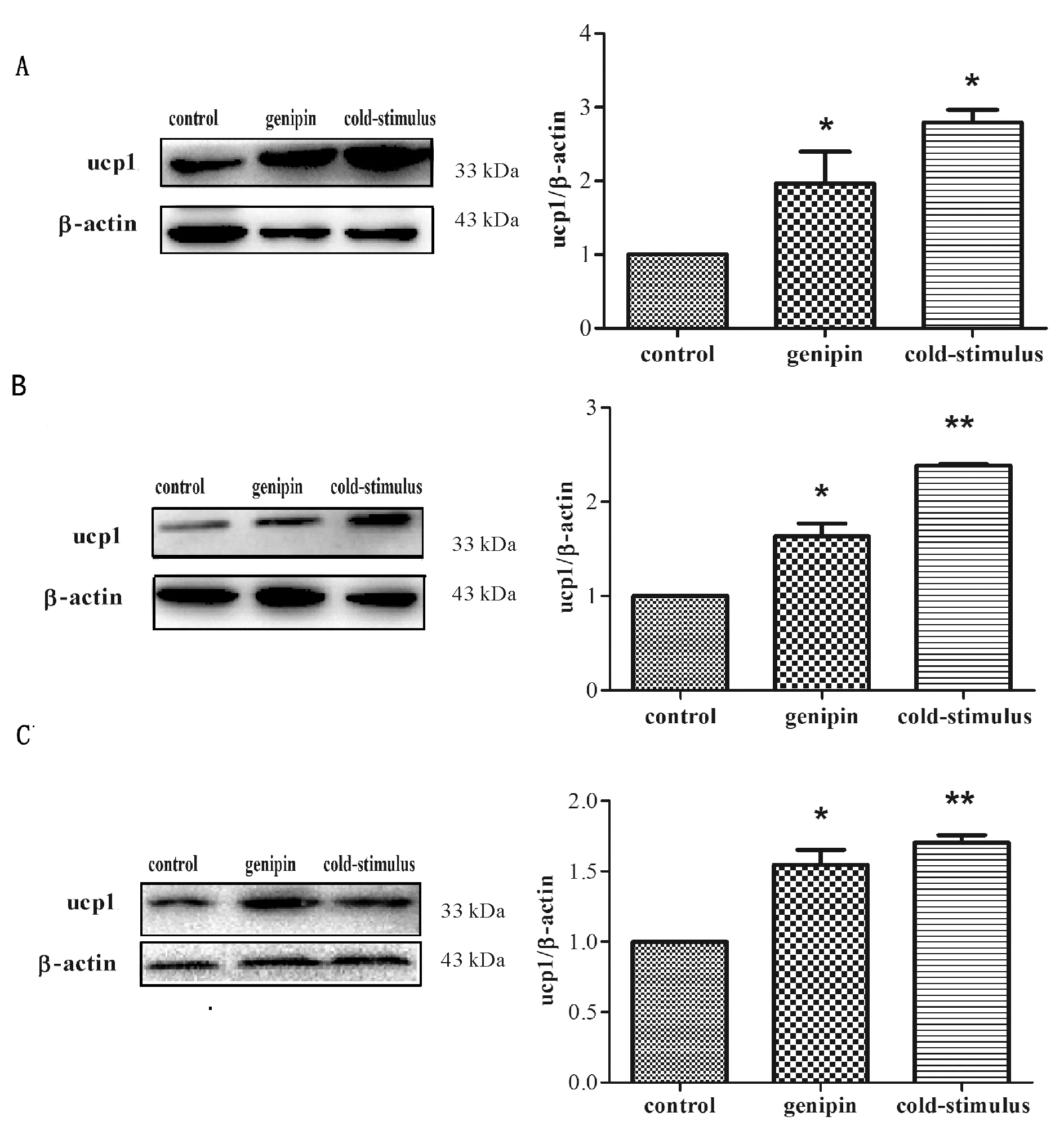
Fig.3Genipin upregulates UCP1 protein expression in adipose tissues(n=3)
A: Brown adipose tissue; B: Subcutaneous adipose tissue; C: Visceral adipose tissue
*P<0.05,**P<0.01vscontrol group
3 讨论
有研究显示,在寒冷刺激或者是β3肾上腺素受体激动剂的作用下,棕色脂肪细胞可以被活化,促进脂质氧化分解,从而产热增加,起到维持体温的作用,且伴有体重减少的现象[10-12]。在肾上腺素受体激动剂或寒冷刺激下,白色脂肪组织中有部分白色脂肪细胞可发生类似棕色脂肪细胞的形态变化,脂滴增多,细胞质内线粒体数量增加,且棕色脂肪细胞标志性基因UCP1 mRNA表达增加,功能上也有类似棕色脂肪细胞耗能、产热的作用,这些现象表明白色脂肪细胞发生了棕化[13-14]。有文献证实,冷刺激处理的前3 d,体温变化较为明显,以后趋于平稳[15]。因此,本实验选用寒冷刺激作为阳性对照,并选用5 d作为冷刺激组小鼠冷暴露时长,以保证寒冷刺激后小鼠机体代谢处于稳定状态,观察京尼平是否具有与寒冷刺激相类似的促进脂肪组织“活化”或“棕化”作用。
本实验结果显示,京尼平处理后小鼠的体温较对照组升高,棕色脂肪组织湿重增加,白色脂肪组织湿重以及体脂率下降,京尼平组和冷刺激组小鼠的3种脂肪细胞出现脂滴变小、数量增加等相同的形态变化。这些结果提示京尼平可促进棕色脂肪组织的活化和白色脂肪组织的棕化,增加脂肪的氧化分解,增加热量的产生与释放,减少小鼠体内脂质的蓄积。有研究显示,黄连素等可促进外周脂肪分解代谢,引起脂肪细胞出现脂滴变小、数量增加等形态变化[16-17]。我们的研究显示京尼平也具有相似的作用。
另外,实验中也观察到,京尼平组和冷刺激组小鼠与对照组相比,棕色脂肪组织的颜色加深,白色脂肪组织的颜色也由白色变为浅红色。脂肪组织的颜色变化与已有的研究结果一致[15]。同时也有研究表明在高脂饮食的小鼠中,白色脂肪组织中特异性的血管内皮生长因子表达增加,诱发白色脂肪组织棕化,增加棕色脂肪组织,从而达到预防肥胖和胰岛素抵抗的作用,以往的研究可以解释本实验结果中脂肪组织颜色变化的现象[18-20]。
为进一步证实京尼平促进棕化的作用,我们分别从核酸和蛋白水平检测棕色脂肪组织“活化”和白色脂肪组织“棕化”的标志分子UCP1的表达。实验结果显示,京尼平组与冷刺激组小鼠UCP1在棕色脂肪组织、皮下白色脂肪组织和内脏白色脂肪组织中的表达均上调。结果表明京尼平具有类似冷刺激促进棕色脂肪组织活化以及白色脂肪组织棕化的作用。因为京尼平和冷刺激是两种不同属性的刺激因素,因此,难以简单比较二者对脂肪组织的作用效应。目前已知冷刺激主要通过交感神经和甲状腺激素,促进脂肪组织的活化与棕化,而京尼平如何促进脂肪组织的活化与棕化,还需要进一步深入研究。此外,我们还观察到,京尼平刺激皮下白色脂肪组织的UCP1 mRNA表达作用较棕色脂肪组织和内脏脂肪组织更加明显(表2),这一现象与以往的研究结果相一致[15-21]。但是,皮下白色脂肪组织中UCP1蛋白表达结果显示京尼平组没有冷刺激组明显(图3)。这种核酸和蛋白水平上的表达差异可能由于是转录后调节的作用,具体的机制还需要进一步研究。
综上所述,本实验研究结果证实京尼平可促进UCP1的表达,促进棕色脂肪组织的代谢活性和白色脂肪组织棕化,减少体内脂肪的蓄积,从而达到降脂减肥的目的。该结果为京尼平在肥胖等代谢性疾病的防治应用提供实验依据。
