竹节参皂苷Ⅳa对FFA诱导肝细胞脂肪沉积保护作用及机制
2019-05-21周耿瑶方从文秦绪军
高 宇,周耿瑶,方从文,周 健,程 坤,秦绪军,王 枫
太白楤木(aralia taibaiensis)是秦巴山区特产的药用植物,在民间主要用于肝、肾等多种急慢性炎症的治疗,药理学研究发现,皂苷类为其主要的药理学作用成分[1]。本课题组较早地对太白楤木成分特别是皂苷的药理学作用进行了研究,发现竹节参皂苷Ⅳa(CHS)的含量丰富,且具有很好的抗氧化以及抗衰老作用[2]。营养过剩引起的重要脏器如肝脏内脂肪沉积是多种代谢疾病的发病基础,有大量研究提示,活性氧(ROS)引起的氧化应激在此过程中发挥重要作用[3]。前期本课题已经证明CHS具有很好的抗氧化应激损伤的作用,本研究采用混合游离脂肪酸(FFA)诱导的人肝细胞L-02建立体外脂肪肝的细胞模型,观察CHS的保护作用,并从抗氧化应激和调控自噬的角度探讨其可能的作用机制。
1 材料与方法
1.1 主要试剂与设备 CHS购自狄尔格公司(南京)(HPLC≥98%);胎牛血清(FBS)、高糖 DMEM 培养基和0.25%胰蛋白酶购自Gibco公司;油酸(OA)、棕榈酸(PA)、四甲基偶氮唑盐(MTT)和DCFH-DA染料购自Sigma公司;MitoSOXTM Red线粒体超氧化物检测试剂盒购自Invitrogen公司;BCA蛋白检测试剂盒购自Thermo公司;Western及IP细胞裂解液、MDA试剂盒购自碧云天生物公司;ULK1、p-ULK1、AMPK和p-AMPK抗体购自 Cell Signaling Technology公司;LC3抗体购自Novus公司;Tubulin抗体购自Bioworld公司;TG试剂盒购自北京普利莱公司;MDA试剂盒和线粒体分离试剂盒购自凯基生物公司;全波段酶标仪购自瑞士TECAN公司;蛋白电泳、转膜及成像系统购自美国Bio-Rad公司。
1.2 细胞培养及处理 人肝L-02细胞由中科院上海细胞库赠送,采用10%FBS的高糖DMEM,于5%CO2、37℃培养箱常规培养,待长至60%~70%融合,1×105个/孔,接种于 6孔板,。将细胞随机分为对照组(Control)、FFA 模型组和 10、20、40 μg/ml CHS干预组。其中对照组给予相同剂量牛血清白蛋白(BSA),FFA 模型组加入终浓度为 400 μmol/L 的FFA(油酸∶棕榈酸=2∶1),CHS 干预组分别给予 10、20、40 μg/ml CHS共处理。2 w后收集各组细胞进行相应指标检测。
1.3 实验方法
1.3.1 MTT法测定细胞活力 将L-02细胞接种96孔板,加入不同浓度的 CHS(5、10、20、40、80 μg/ml)处理24 h,加入终浓度为5 mg/ml的MTT溶液继续培养4 h,对照组为相同剂量BSA处理,最后加入DMSO 100 μl,全波段酶标仪测定492 nm处吸光值。
1.3.2 细胞总活性氧(T-ROS)和线粒体活性氧(MROS)测定 各组细胞采用DCHF-DA染色法测定T-ROS,DCFH-DA 终浓度为 10μmol/L(287810,Sigma)。5%CO2、37℃培养30 min,0.25%胰酶消化后收集细胞,激发光波长488 nm,发射光波长525 nm处测定荧光强度。线粒体ROS采用MitoSOXTM Red试剂盒,MitoSOXTM工作液加入终浓度为5 μmol/L,5%CO2、37℃培养30 min,0.25%胰酶消化后收集细胞,激发光波长510 nm,发射光波长580 nm处测定荧光强度。
1.3.3 甘油三酯(TG)和丙二醛(MDA)水平测定0.25%胰酶消化收集各组细胞,每孔加入RIPA裂解液200 μl, 充分裂解后,4℃14 000 r/min离心20 min,取上清。试剂盒提取线粒体(23229,Thermo)。BCA试剂盒蛋白定量,试剂盒测定TG(E1003,北京普利莱)和 MDA 水平(KGT004,凯基生物)。
1.3.4 Western blot法测定 LC3、ULK1、AMPK 及相应磷酸化蛋白水平 提取各组细胞总蛋白,BCA蛋白检测试剂盒定量,取总蛋白15~20 μg上样进行SDS-PAGE电泳,半干转法将蛋白转移到NC膜,牛奶封闭后加入一抗,4℃摇床孵育过夜。去除一抗,TBST洗膜3次,加入HRP标记二抗,室温孵育2 h,TBST洗膜4次,滴加化学发光液,Bio-Rad凝胶成像系统采集图像,Quantity One软件进行定量分析。
1.4 统计学方法 应用SPSS 27.0统计软件分析,结果数据以±s表示,多组间比较采用ANOVA方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 CHS对L-02细胞活力的影响 MTT实验结果发现,不同剂量CHS组与对照组细胞活力比较无显著差异(P> 0.05,图 1)。
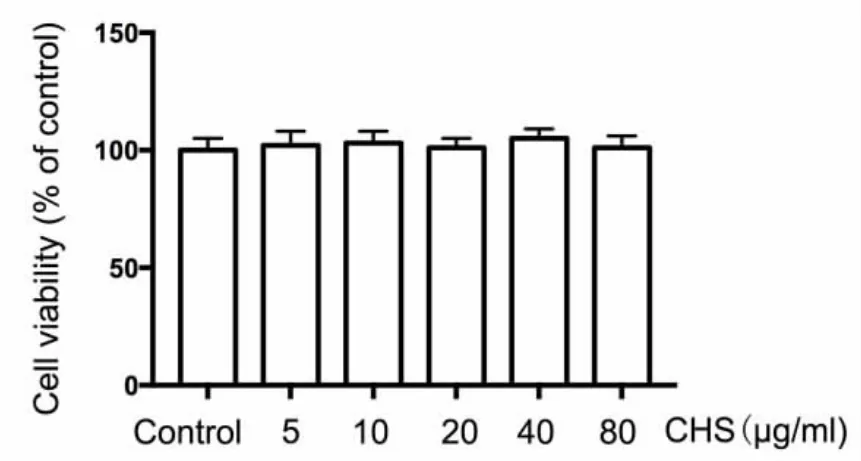
图1 各组L-02细胞活力检测结果
2.2 CHS对FFA处理引起的细胞T-ROS和MROS水平的影响 T-ROS和M-ROS检测结果表明,FFA处理可以显著提高T-ROS和M-ROS水平,而CHS可以有效抑制FFA引起的T-ROS和M-ROS水平升高,并呈一定的量效关系(图2)。
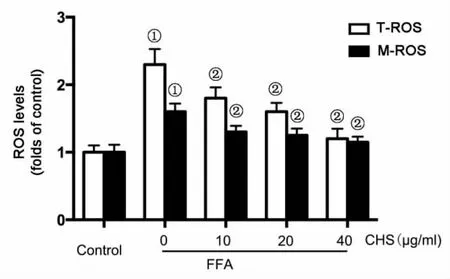
图2 CHS对FFA诱导L-02细胞T-ROS和M-ROS水平的影响
2.3 CHS对FFA处理引起的细胞氧化应激产物及TG水平的影响 MDA变化趋势与ROS变化趋势相一致,FFA处理可以显著增加细胞整体和线粒体的MDA的水平,而CHS能够有效抑制MDA水平升高。与此同时,FFA处理可以显著提升TG水平,CHS也可以显著降低FFA引起的TG水平的增加,并且也呈现一定的剂量效应关系。见表1。
2.4 CHS对FFA抑制细胞自噬水平及AMPK/ULK1通路的影响 Western blot法检测结果发现,FFA处理能够显著抑制LC3II的水平,而给与不同剂量CHS可以明显提高LC3II的水平。FFA处理可以显著抑制ULK1的Ser555的磷酸化及上游的AMPK的Thr172磷酸化水平,而不同剂量CHS可以显著提高ULK1和AMPK的磷酸化水平。见图3。
3 讨论
脂肪肝是临床常见病和多发病,也是肝硬化、肝癌等恶性肝脏疾病发病的危险因素,因此,防治脂肪肝的意义重大[4]。有研究表明,在由营养过剩引起的脂肪肝发生、发展中,氧化应激扮演了重要角色[5-6],因此,有效抑制ROS的产生,减轻氧化应激,是防治脂肪肝的潜在重要策略之一。本课题前期研究发现,太白楤木皂苷中的重要成分CHS具有很好的抗氧化作用[2],因此推测,CHS可能具有防治脂肪肝的作用。L-02细胞是人正常肝细胞,是理想的降脂研究体外细胞模型。因此本研究采用混合游离脂肪酸(FFA)诱导的人肝细胞L-02建立体外脂肪肝的细胞模型,观察CHS的保护作用。首先本课题进行了CHS剂量筛选实验,结果发现5~80 μg/ml剂量范围的CHS对L-02细胞增殖及活力无显著影响,因此,后续实验选用了 10、20 和 40 μg/ml 3 个剂量。本课题采用经典的FFA处理建立体外脂肪肝的细胞模型,发现CHS浓度在3个剂量下,可以有效降低FFA引起的细胞ROS水平。而线粒体是细胞内源性ROS的最主要来源[7]。CHS干预可有效降低氧化应激产物MDA和TG含量,提示CHS很可能通过抑制线粒体ROS水平,从而降低细胞整体ROS水平,减轻相应的氧化应激,发挥抗FFA诱导脂肪沉积的作用。
研究表明,代谢性疾病如脂肪肝等脂肪堆积过程中的脂代谢紊乱与自噬障碍密切相关,激活自噬能够改善脂代谢紊乱[8]。本研究结果发现,FFA可以显著抑制L-02细胞自噬经典标志物LC3II的水平,表明FFA可以显著抑制自噬水平,而CHS处理提高LC3II水平的作用存在一定量效关系,即LC3II含量随CHS浓度增加而升高。AMPK/ULK1是调控自噬的重要通路,ULK1也被称为Atg1,是启动自噬过程中的重要因子之一,它的活性依赖于其Ser555位点的磷酸化水平,而在ULK1上游主要依赖于AMPK的激活[9]。在本研究中,FFA处理可以显著抑制ULK1的激活;而不同剂量CHS可以有效拮抗FFA对AMPK的抑制作用,进而提高ULK1的磷酸化水平激活自噬。提示FFA可以通过抑制AMPK/ULK1通路抑制自噬,而CHS可以通过激活AMPK/ULK1通路激活自噬,改善脂质沉积,从而发挥抗FFA诱导的脂肪沉积。
综上所述,CHS可以通过减轻线粒体氧化应激,激活AMPK/ULK1通路提高自噬,改善FFA引起的脂肪沉积。本研究仅以L-02细胞脂肪肝模型为基础,研究了CHS抗FFA诱导的脂肪沉积的作用,其具体机制和临床应用效果还有待于进一步体内实验及临床验证。
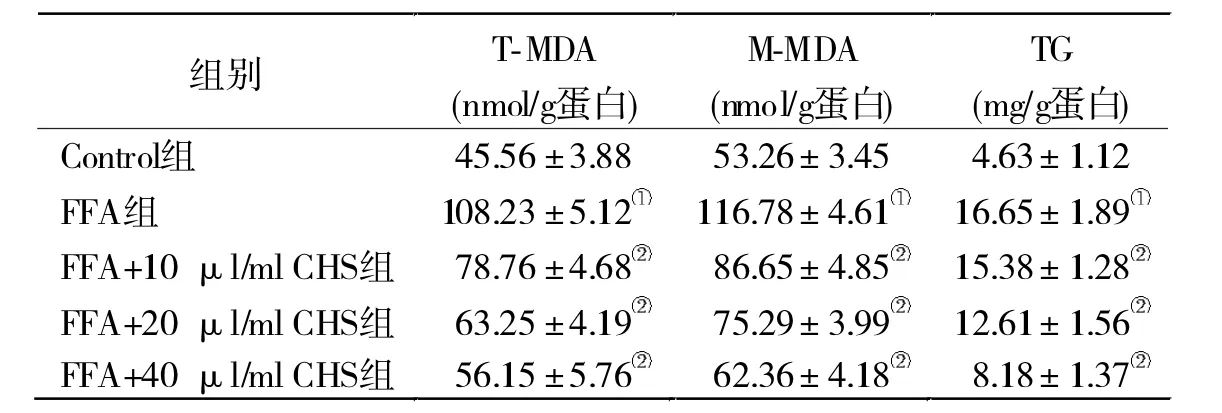
表1 CHS对FFA引起的细胞T-MDA、M-MDA和TG水平的影响(n=6)
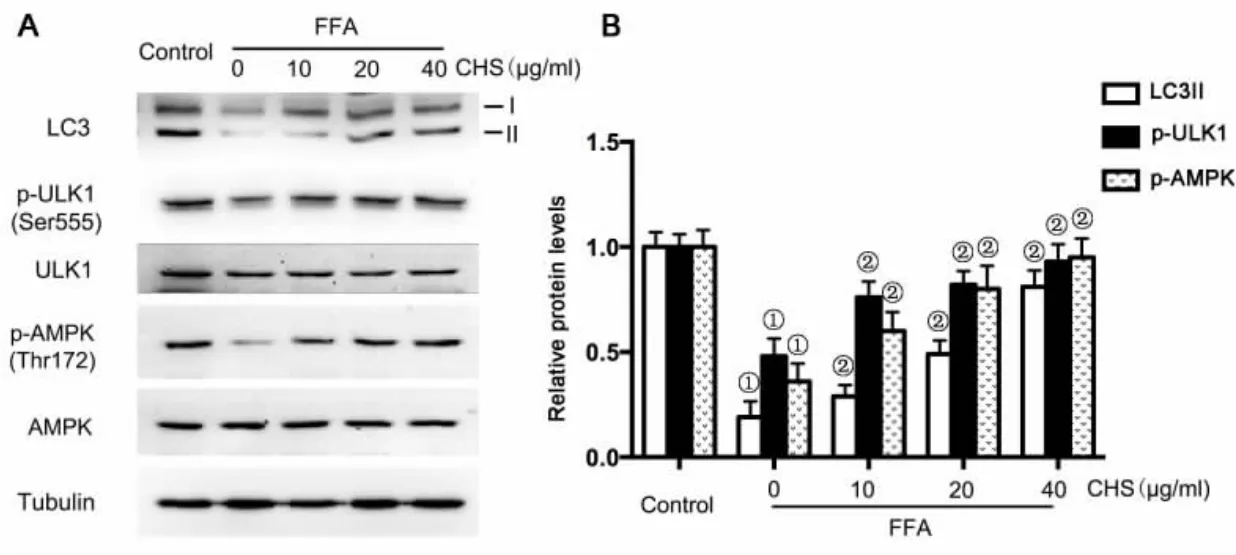
图3 CHS对FFA诱导L-02细胞LC3及AMPK/ULK1通路蛋白影响
