巨噬细胞极化在微生物感染中的作用研究进展
2019-05-21廖成水毛福超程相朝
廖成水,毛福超,程相朝
(河南科技大学 动物科技学院/ 洛阳市活载体生物材料与动物疫病防控重点实验室,河南 洛阳 471023)
巨噬细胞(Macrophage)起源于骨髓中的前体细胞,分化成熟的巨噬细胞广泛分布于机体各个组织和器官中[1]。在特定因素作用下,机体内某些细胞可以直接分化成为巨噬细胞,不同细胞分化后的巨噬细胞可以分布于不同组织[2]。巨噬细胞是参与机体固有免疫的一类重要免疫细胞,不但可以吞噬外来微生物,还能递呈抗原,通过合成分泌多种细胞因子发挥功效,在控制炎症变化的过程中起到主导作用。当外界病原体侵入机体引发感染时,机体的无菌环境被打破,巨噬细胞被激活后识别病原体和抗原递呈,吞噬杀灭病原体起到免疫保护作用。巨噬细胞在机体调控下产生极化,极化后的巨噬细胞表现出不同的功能表型,根据表位的不同可以将极化后的巨噬细胞分为经典活化的巨噬细胞(Classically activated macrophage)和替代性活化的巨噬细胞(Alternatively activated macrophage)[3-4],分别称为 M1型巨噬细胞和 M2 型巨噬细胞。甘露糖受体(Macrophage mannose receptor,MR)、精氨酸酶 1(Arginase 1,Arg1)和清道夫受体(Scavenger receptor,SR)等是 M2 表型的特征表达物,而M1 表型的特征表达物是诱导型一氧化氮合酶(Inductible nitric oxide synthase,iNOS)[5]。M1型巨噬细胞在炎症发生方面起主导作用,对微生物、胞内寄生虫和肿瘤细胞展现出明显的杀伤作用;而M2 型巨噬细胞主要在组织修复、寄生虫感染和免疫反应等调控环节中发挥着不可替代的作用[6]。
1 巨噬细胞多样性
巨噬细胞作为一类多功能细胞,是由骨髓前体细胞分化而来,最初对巨噬细胞的定义是有活性或无活性巨噬细胞[7],随后发现不同条件刺激下的巨噬细胞可以发生不同效应的活化,且活化后的巨噬细胞执行不同的免疫应答反应。在免疫应答中巨噬细胞发挥着极其重要的作用,当病原体侵入机体时巨噬细胞可非特异性的识别并启动宿主免疫应答直接杀伤病原体[3]。二元分类法将巨噬细胞分为M1 型巨噬细胞和 M2 型巨噬细胞,而 Mantovani 等在二元分类法基础上提出的分类方法更明确的区分不同效应下活化的巨噬细胞[8]。该方法与二元分类法最大的区别是在保留M1 型巨噬细胞分类的基础上,对M2 型巨噬细胞给出了更细微的区分,即在不同因子刺激下的M2 型巨噬细胞又分为 M2a、M2b 和 M2c 三类。巨噬细胞的核心亚群与细菌、原虫、肿瘤、自身免疫以及蠕虫感染等的免疫应答反应有关联[9]。
2 巨噬细胞极化在微生物感染中的作用
当微生物侵入机体后,机体为了内环境的稳态而快速做出应答反应,巨噬细胞作为机体固有免疫的主力军发挥着极其重要的作用。微生物感染前期,巨噬细胞以M1 型极化为主导诱发炎症反应,同时释放大量的炎症相关因子,杀灭侵入机体的微生物。感染后期,机体对炎症反应进行调节,减弱炎症反应避免其对机体产生的损伤,调节的机制主要是改变巨噬细胞的极化类型,由M1 型向M2 型发生偏移或者诱发凋亡,M2 型巨噬细胞的产生减缓了炎症反应的同时也为微生物逃避机体免疫提供了条件(图1)。
M1 型巨噬细胞的极化主要由Th1 型细胞因子、IL-1和一些病原微生物的脂多糖(Lipopolysaceharide,LPS)、脂蛋白(Lipoproteins,Lp)等刺激而发生,释放促炎因子IL-12、IL-6、IL-1、IL-23和其它趋化因子等参与炎症反应。M1型极化不但可以促进炎症反应的发生而且还具有极强的抗原递呈功能,进一步加强Th1 细胞免疫反应[10-11]。M1型巨噬细胞可高表达 iNOS 和活性氧(Reactive oxygen species,ROS),从而释放大量NO和ROS,对微生物具有杀伤作用[12],NO 可促进 NK 细胞的活化和调节淋巴细胞杀灭病毒和寄生虫。吞噬细胞细胞膜的氧化酶可被细菌或其它病原体的病原相关分子模式(Pathogen-associated molecular patterns,PAMP)与吞噬细胞受体结合后激活,产生大量 ROS,从而发挥杀伤细菌作用[13]。铁转运蛋白在M1 型巨噬细胞中高表达,而血清铁蛋白呈低表达,胞内铁的聚集可以促进巨噬细胞对细菌的抑制作用[14]。
M2 型巨噬细胞的极化主要由 IL-3、细胞集落刺激因子(M-CSF)等刺激产生,被激活的M2 型巨噬细胞分泌抗炎因子 如 IL-10、TGF-β 和 AMAC-1 等,介导 Th2 型免疫反应。极化后的 M1 和 M2 型巨噬细胞功能差异很大,但是在介导炎症反应的过程中关系非常密切,M2 型巨噬细胞通常起到抑制炎症反应的作用,从而减少M1 型巨噬细胞的极化,参与慢性炎症反应,是微生物逃避免疫反应的重要途径。M2 型巨噬细胞在寄生虫感染过程中的主要作用是减少急性组织损伤、增强修复、激活Th2 型免疫反应和促进杀伤虫体[15]。M2 型巨噬细胞虽然可以通过增强Arg1 信号通路破坏虫体运动而杀伤寄生虫,但也可以通过上调Arg1 的表达以及增强iNOS 与L- 精氨酸竞争性结合,降低NO 的产生,从而抑制杀菌和寄生虫的免疫。此外,M2 型巨噬细胞还可以协同中性粒细胞以及补体系统杀伤寄生虫[16]。极化后的M2 型巨噬细胞在机体抵抗寄生虫侵染时起到了一定的作用,其作用机制首先表达细胞趋化因子,进而在机体内招募大量白细胞聚集,这一系列的反应将对组织修复和变态反应产生影响[17]。
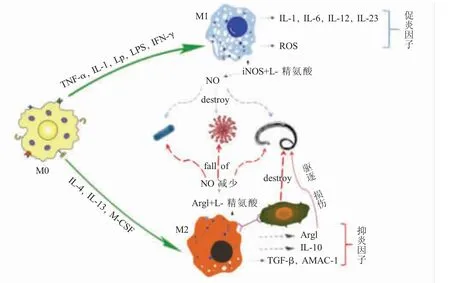
图1 巨噬细胞极化与微生物感染之间的关联
2.1 巨噬细胞极化在细菌感染中的作用 GM-CSF 和IL-4 共同作用产生的M2 型巨噬细胞对细菌的吞噬能力增强,而 GM-CSF 和 IFN-γ 共同作用产生的 M1 细胞朗汉斯巨细胞具有相对高的杀菌作用,但时间越长其杀菌能力越弱。研究显示,羊布鲁菌感染后期,M2 型巨噬细胞内启动了JAK-STAT6 信号转导通路,发挥了抑制炎症反应的作用[18]。Paciello 等研究显示弗氏志贺菌侵入细胞后可以调控细胞内LPS 乙酰化水平,而LPS 乙酰化后与TLR4 的结合位点发生改变,导致两者不能特异性结合,从而降低了TLR4 通路调控的炎性因子的释放,减弱M1 型巨噬细胞的极化进而逃避巨噬细胞的吞噬和杀灭[19]。小鼠肺脏感染葡萄球菌时,细胞Akt1 信号通路可以增强细胞因子信号转导抑制因子 1 (Suppressor of cytokine signaling1,SOCS1)的活性,抑制核因子 κB (NF-κB)的活性,从而抑制炎性的 M1 型巨噬细胞的极化[20]。也有研究表明,金黄色葡萄球感染期间,巨噬细胞 Forkhead box 转录因子 O1(FoxO1)的分泌可以促进巨噬细胞 M1 极化,有利于对金黄色葡萄球菌的清除[21]。结核病时分泌的致病因子糖脂可调控巨噬细胞吞噬体以抑制巨噬细胞M1 型的极化,而结核病早期分泌抗原靶蛋白6(Early secretory antigenic target-6,ESAT-6)则可以通过调节 NF-κB 信号通路的活性继而来调控巨噬细胞的M1 型极化[22]。结核分支杆菌对巨噬细胞极化的调控可以控制Wnt6 信号通路,阻断炎症反应的进行,进而增大巨噬细胞向M2 型极化发生偏移[23]。此外,在结核分支杆菌感染期间,由结核分支杆菌刺激的B细胞产生的I 型干扰素(IFN-I)促进巨噬细胞向M2 表型极化[24]。Eisele 等研究伤寒沙门菌侵入机体诱发感染时发现,菌体感染后可以通过刺激M2 型巨噬细胞过氧化物酶增殖物激活受体(Peroxisome proliferator activated receptor,PPAR) δ 基因的高表达来提高菌体在小鼠机体的存活率,证实M2 型巨噬细胞PPAR δ 基因的表达可对细菌杀灭和清除产生影响,低表达时可以限制细菌的复制[25]。铜绿假单胞菌感染眼部时,IL-33 的表达上调,巨噬细胞向 M2极化,有利于细菌的清除进而减轻炎症[26]。幽门螺杆菌感染可使巨噬细胞中阳离子通道瞬时受体电位melastatin 2(TRPM2)的功能丧失,促进经典活化的M1 型巨噬细胞极化,从而减少幽门螺杆菌的胃定植,同时增加胃黏膜的炎症反应[27]。通常情况下 M1 巨噬细胞通常比非活化的或M2 巨噬细胞能够更好地杀死病原体[28-29],但对戈登氏链球菌感染的研究结果却恰好相反。已知巨噬细胞具有成熟的吞噬体,还具有产生反应性吞噬体活性氧(ROS)以及蛋白水解的能力,并且炎症性巨噬细胞(M1)与调节性或创伤愈合型巨噬细胞相比,其可延长ROS 的反应和缓慢酸化[30-32]。而戈登氏链球菌寄生在巨噬细胞内可抵抗ROS 的活性,同时可延缓吞噬体的成熟,因此戈登氏链球菌在炎症性巨噬细胞(M1)内的存活能力远远大于替代性活化巨噬细胞(M2)[33]。因此,对于细菌性感染,一般情况下菌体侵入机体后可阻碍巨噬细胞向M1 型极化,从而逃避免疫系统的杀灭与清除。
2.2 巨噬细胞极化在寄生虫感染中的作用 M1 型巨噬细胞能够利用活性氧化物抑制和杀灭胞内寄生虫,M2 型通过上调Arg-1 的表达,与iNOS 对相同底物 L- 精氨酸进行竞争,继而抑制NO 的生成,使得机体对寄生虫胞内感染呈现出免疫抑制效应[34]。华支睾吸虫感染的早期阶段,肝巨噬细胞优先分化为M1 巨噬细胞,然而,华支睾吸虫成熟蠕虫释放卵时,M1 巨噬细胞和活化的肝巨噬细胞(M2 巨噬细胞)的丰度均显著增加。此外,纤维化和肝硬化阶段,M2 巨噬细胞的比例明显增加。值得注意的是,在纤维化和肝硬化阶段可以显著增加产生Arg-1 的巨噬细胞(M2 表型)的比例,这与肝纤维化和组织修复相关[35]。墨西哥利什曼原虫感染时,机体产生的PPAR 诱导M1 巨噬细胞极化,促进M1 巨噬细胞分泌ROS,从而增强对墨西哥利什曼原虫的杀伤和清除[36]。Zhu 等研究发现由经典途径激活的巨噬细胞(M1 巨噬细胞)产生的 NO 对血吸虫幼虫具有细胞毒性并且可以防止肝脏血吸虫纤维化,而交替活化的巨噬细胞(M2 巨噬细胞)表达的 Arg-1 促进肝脏纤维化[37]。Xu 等指出重组旋毛虫假丝酵母丝氨酸蛋白酶抑制剂(rTp-Serpin)通过活化信号转导体和转录激活因子3信号通路诱导巨噬细胞向M2 表型极化,并在体外抑制脂多糖诱导的M1 经典活化,从而干扰巨噬细胞的杀伤,使旋毛虫可以逃避机体的免疫监控[38]。还有研究指出弓形虫逃避机体免疫监视的机制是弓形虫可以直接代谢脯氨酸,而脯氨酸合成的原料是L- 精氨酸,使得 M1 型巨噬细胞极化受到抑制,而M2 型极化上调为弓形虫的生存繁殖创造了有利条件,并且M2 型在一定意义上成为了弓形虫在体内播散的重要载体[39]。因此,对于寄生虫感染,不同寄生虫或者寄生虫不同的发育时期激发巨噬细胞极化的类型不尽相同。
2.3 巨噬细胞极化在病毒感染中的作用 Hajizadeh 等发现丙型肝炎病毒感染机体时首先引发机体肝脏内部产生一个慢性感染病灶,病毒蛋白NS3 通过巨噬细胞THP-1 提高 IL-12 和 TNF-α 的分泌,进一步提高 M1 型巨噬细胞的偏移,引起持续性的炎症反应[40]。IFN-γ 介导的 M1 型巨噬细胞下调初级 CD4 受体和CCL 趋化因子(CCL3,CCL4和 CCL5)而限制 HIV-1 复制,并且 M2a 巨噬细胞极化后抑制病毒复制水平。IL-4 受体缺陷的小鼠可以阻断巨噬细胞M2a 极化,呼吸道合胞病毒感染加剧了其肺部炎症和损伤,表明平衡的M2 巨噬细胞分化对于在疾病晚期控制呼吸道合胞病毒诱发的免疫病理学是必需的[41-43]。因此,对于病毒感染早期,机体巨噬细胞偏向M1 极化有利于病毒生存。
2.4 巨噬细胞极化在其它微生物感染中的作用 Vanin-1是一种谷胱甘肽调节酶,同时可以在局部释放半胱氨酸对细胞的氧化还原状态进行调控。立克次体感染模型中发现Vanin-1 可以控制肉芽肿的形成和巨噬细胞向M2 型极化,从而保证其在机体内长期存活[44]。衣原体不但可以在上皮细胞中存活也可以存活于巨噬细胞中[45],并且衣原体不会像其它细胞内的细菌一样在胞内感染过程中诱发巨噬细胞极化[46]。极化的巨噬细胞对细胞外衣原体具有不同的控制能力,M2 巨噬细胞不影响衣原体生长,而 M1 巨噬细胞可以控制衣原体感染。尽管极化后的M1 巨噬细胞具有抗微生物特征,却不能消除细胞内的衣原体[46]。以新生隐球菌感染建立的支气管肺真菌病(ABPM)小鼠感染模型的主要偏向 Th2 免疫应答,但也有 Th1 因子的产生[47]。因此,巨噬细胞极化分型在许多微生物感染免疫中均起到一定的作用。
3 展 望
巨噬细胞作为机体抵抗感染的第一道防线,在疾病发展和转归中起到极为重要的作用,通过改变巨噬细胞的功能表达将对疾病防控与机体康复带来重大的影响。极化后的巨噬细胞对一些微生物的存活和清除发挥着非常重要的作用,一般认为经典活化的M1 型巨噬细胞被是消除某些微生物的重要效应细胞,而替代性活化的M2 型巨噬细胞是病原体存活的关键。巨噬细胞精确的极化在机体对抗微生物感染的不同阶段发挥着不尽相同的作用。因此,以干预巨噬细胞极化为切入点,使其向有利于控制、清除病原微生物的方向发展,可以成为治疗微生物感染性疾病的新思路[48]。然而,巨噬细胞活化的某些机制、分型和功能特点等不清楚。巨噬细胞胞外捕获器被认为是固有免疫细胞的新型防御机制,本实验室也试图揭示巨噬细胞活化分型在巨噬细胞胞外捕获器形成中的确切作用[49]。此外,已知靶向抑制 Krüppel 样因子 13 (Krüppel like factor 13,KLF13)与巨噬细胞极化的调控有关,但 KLF13 与巨噬细胞极化的确切关系尚不明确。let-7c 虽然可以通过靶向阻碍C/EBPδ 的分泌进而调节巨噬细胞发生极化,但是C/EBPδ和M2 极化的联系不明确,仍需要进一步的研究。
