牛源腔隙莫拉菌的分离鉴定与药敏试验
2019-05-21朱利霞王洪彬赵希艳王双月史秋梅高光平
朱利霞,王洪彬,赵希艳,王双月,史秋梅,高光平
(河北科技师范学院 河北省预防兽医学重点实验室,河北 秦皇岛 066600)
莫拉菌属的细菌是短链状或成对状的革兰阴性菌、短且宽,接近球状,一直被认为具有潜在的致病性,多数寄居在人和温和动物的皮肤和黏膜中,如上呼吸道、口腔,是呼吸道继发性感染致病菌之一[1]。文献显示,从豚鼠[2]、骆驼[3]、山羊[4-5]、犬[6]等多种动物中分离到该菌。近年来,由该菌属细菌引起的细菌性疾病呈逐年增加趋势,部分分离株致病性较强,其中腔隙莫拉菌主要引起结膜炎、脑膜炎、肺炎、慢性鼻窦炎和心内膜炎等病症[7];该菌引起人类患病的报道也在逐年增多[8-9],但未见从病牛分离到腔隙莫拉菌的报道。本研究以河北省某牛场采集的病牛鼻腔拭子样品中分离纯化得到的病原菌为试验菌株,对其进行细菌鉴定和药敏试验,为由腔隙莫拉菌引起的牛细菌性疾病的防控提供一定的参考。
1 材料与方法
1.1 病料样品来源 患呼吸道病牛的鼻拭子,采集自河北省某养牛场;昆明系小鼠,体质量 20±2g,雌雄各一半,购自北京维通利华实验动物有限公司。
1.2 主要试剂 胰蛋白胨大豆肉汤(TSB)、胰蛋白胨大豆琼脂(TSA)购自北京奥博星生物技术有限责任公司;细菌基因组提取试剂盒购自天根生化科技(北京)有限公司;E.Z.N.A.TMPlasmid MiniKit 质 粒提取试剂盒、Gel extraction kit 购自 Omega 公司;DL 2000 DNA Marker、dNTP、ExTaqDNA聚合酶购自TaKaRa 公司;常规药敏纸片购自杭州天和微生物试剂有限公司;pMD18-T 载体、大肠杆菌感受态细胞DH5α 购自北京全式金生物技术有限公司;本研究用到的中药购自秦皇岛民乐医药。
1.3 病原菌的分离纯化 将无菌采集的病牛鼻拭子样品接种于TSA平板(含 5 %胎牛血清),置 37 ℃培养24 h;挑取优势菌株的单菌落再次划线接种于TSA、SS、EMB、TCBS培养基上培养 24 h;挑取单菌落经革兰氏染色镜检观察结果;无菌挑取优势菌株的单菌落,接种于新鲜的TSB 培养液(含5 %胎牛血清)中,于 37 ℃恒温摇床中培养 24 h,加入甘油冻存菌种。
1.4 病原菌的生化鉴定 挑取优势菌株单菌落制备菌悬液;利用ID32E 生化鉴定试纸条进行细菌鉴定,由法国梅里埃公司提供的ATB 全自动微生物鉴定系统判定结果。
1.5 分离菌株的16S rDNA 鉴定 利用细菌基因组提取试剂盒提取分离菌株基因组DNA;利用16S rDNA 通用引物对分离菌株进行PCR 扩增;阳性产物回收与 pMD18-T 载体连接,转化至E.coli中,PCR 检测阳性的菌液由北京生工生物工程有限公司测序鉴定。
将测序所得的16S rDNA 基因序列与GenBank中登录的相应莫拉菌属细菌进行比对分析,并利用DNAStar 软件分析其同源性并绘制系统进化树。
1.6 分离菌株的致病性试验 将分离菌株单菌落接种于TSB 培养液(含 5 %胎牛血清)中,置37 ℃培养24 h,采用琼脂平板计数法计算活菌含量;以无菌的 PBS 分别将其 10 倍倍比稀释(1.0×105cfu/mL~1.0×109cfu/mL),每个浓度经腹腔注射接种 5 只小鼠,0.2 mL/ 只,对照组 5 只小鼠注射无菌 PBS,0.2 mL/ 只[10]。
1.7 分离菌株的药敏试验
1.7.1 西药药敏试验 按照美国临床实验室标准委员会(CLSI)推荐的抗菌药物敏感性试验执行标准,采用K-B 纸片扩散法进行药敏试验并判定结果[11]。
1.7.2 中药药敏试验 按照文献[12]的水煎煮法提取中药有效成分,终浓度为1 g/mL;采用琼脂平板打孔法进行中药药敏试验,试验菌液浓度为1.0×107cfu/mL。在 TSA 平板(含 5%胎牛血清)均匀涂抹 100 μL分离菌菌液,然后用直径6 mm 的打孔器打4 个孔,用无菌的0.5 %琼脂封底,其中第 3 孔加入 100 μL中药提取液,另1 孔加入无菌等量生理盐水作阴性对照,重复 3 次,将其正面朝上置 37 ℃培养 24 h后观察结果,测定抑菌圈直径。以3 次抑菌圈直径的平均值作为药物对该菌的抑菌圈直径。判定标准:抑菌圈直径≥20 mm 为极敏,15 mm≤抑菌圈直径<20 mm 为高敏,10 mm≤抑菌圈直径 <15 mm 为中敏,抑菌圈直径<10 mm 为耐药。采用试管二倍稀释法[13]进行中药最小抑菌浓度(MIC)和最小杀菌浓度(MBC)的测定。试验过程中,加入 TTC 有助于准确判断MIC 值,当孔内不显示红色时,即为该中药的MIC。分别蘸取各试管中的液体,涂布于TSA 平板(含5 %胎牛血清),观察有无细菌生长,无细菌生长时的最低浓度即为该中药的最低杀菌浓度(MBC)[14]。
2 结 果
2.1 分离菌株的形态特征 对患病牛的鼻拭子样品进行细菌分离,结果分离纯化得到1 株优势菌株;分离菌株不能在 SS、EMB、TCBS 培养基上生长;在TSA 平板上长出乳白色、边缘整齐、凸起、不透明、湿润的菌落;在血平板上长出灰白色、湿润、半透明、圆形、凸起、不溶血菌落;革兰氏染色结果显示,分离菌株为革兰阴性短杆菌或球杆菌,菌体两端钝圆,无芽胞,单个或成对排列(图1),将其命名为Mor QHD-1。

图1 分离菌株革兰氏染色形态(100×)Fig.1 Micrograph of the isolate with Gram staining (100×)
2.2 分离菌株的生化鉴定 对分离菌株Mor QHD-1 进行生化鉴定。结果显示,Mor QHD-1 具有触酶、氧化酶活性,无苯丙氨酸脱氢酶活性;硝酸盐还原反应和明胶液化反应均为阳性;不能发酵麦芽糖、甘露醇、木糖、蔗糖、乳糖、果糖、阿拉伯糖、鼠李糖;不能分解尿素及不能利用枸橼酸盐;V-P 试验阴性;不产生硫化氢等。参考 《 伯杰细菌鉴定手册》进行比对,分离菌株Mor QHD-1 符合腔隙莫拉菌(Moraxella lacarnata)的生理生化特性。
2.3 分离菌株的16S rDNA 鉴定 以分离菌株Mor QHD-1的基因组DNA为模板,进行16S rDNA 的PCR扩增。结果显示,扩增出的片段在 1 500 bp 左右,与预期相符(图2),进一步表明分离菌株为腔隙莫拉菌。

图2 分离菌株Mor QHD-1 的16S rDNA 基因的PCR 扩增Fig.2 Amplification for 16S rDNA gene of Mor QHD-1 isolate by PCR
2.4 分离菌株的同源性分析及系统发育树的建立将测序得到的16S rDNA 基因序列经Blast 比对分析,结果显示分离菌株 Mor QHD-1 的 16S rDNA 基因序列与GenBank 中腔隙莫拉菌相应基因序列同源性为97.6 %。系统发育树显示分离菌株Mor QHD-1与液化莫拉菌(Moraxella nonliquefaciens)、犬莫拉菌(Moraxella canis)、卡他莫拉菌(Moraxella catarrhalis)、林肯莫拉菌(Moraxella lincolnii)、苯丙酮酸莫拉菌(Moraxella phenylpyruvica)、亚特兰大莫拉菌(Moraxella atlantae)、奥斯陆莫拉菌(Moraxella osloensis)等亲缘关系较远,而与腔隙莫拉菌自然聚为一簇(图3),进一步表明了分离菌株 Mor QHD-1 为腔隙莫拉菌。
2.5 分离菌株致病性试验 将分离菌株Mor QHD-1 采用不同的剂量对小鼠进行致病性试验,结果显示,小鼠在感染约12 h 开始出现精神不振,部分小鼠食欲降低,甚至废绝;小鼠在感染24 h 后,高剂量组小鼠出现不同程度的死亡,而低剂量组小鼠未出现死亡。将死亡的小鼠剖检,发现小鼠心包有少量积液,肺脏、肝脏有出血点等。无菌取死亡小鼠心包积液、肺脏、肝脏样品接种于TSA 平板进行细菌分离纯化。经形态学观察、生化鉴定、16S rDNA 鉴定,确定为腔隙莫拉菌,与本实验接种菌株一致。表明分离菌株Mor QHD-1 具有一定的致病性。

图3 分离菌株与相关菌株的系统发育树Fig.3 Phylogenetic tree based on 16S rDNA gene sequences between Mor QHD-1 isolate and the related strains
2.6 分离菌株的药敏试验结果
2.6.1 西药药敏试验结果 药敏试验结果如表1 所示,因此可以选用氨基糖苷类、氟喹诺酮类和β- 内酰胺酶类药物治疗由腔隙莫拉菌引起的牛细菌性疾病。

表1 分离菌株西药敏感性试验结果Table 1 Drug susceptibility test of the isolate
2.6.2 中药药敏试验结果 选用动物养殖中常用中药进行敏感性试验。结果显示,分离菌株 Mor QHD-1 对苏木、诃子、乌梅、黄柏、五味子、黄连、五倍子极敏;对知母、厚朴等中药耐药(表2)。苏木、黄柏、五倍子、黄连对腔隙莫拉菌的MIC 和MBC 较小,均在 1.95 mg/mL~7.82 mg/mL,其次为诃子、乌梅、五味子的 MIC 和 MBC 在 15.63 mg/mL~62.50 mg/mL。表明分离菌株 Mor QHD-1 对不同中药敏感性不同。
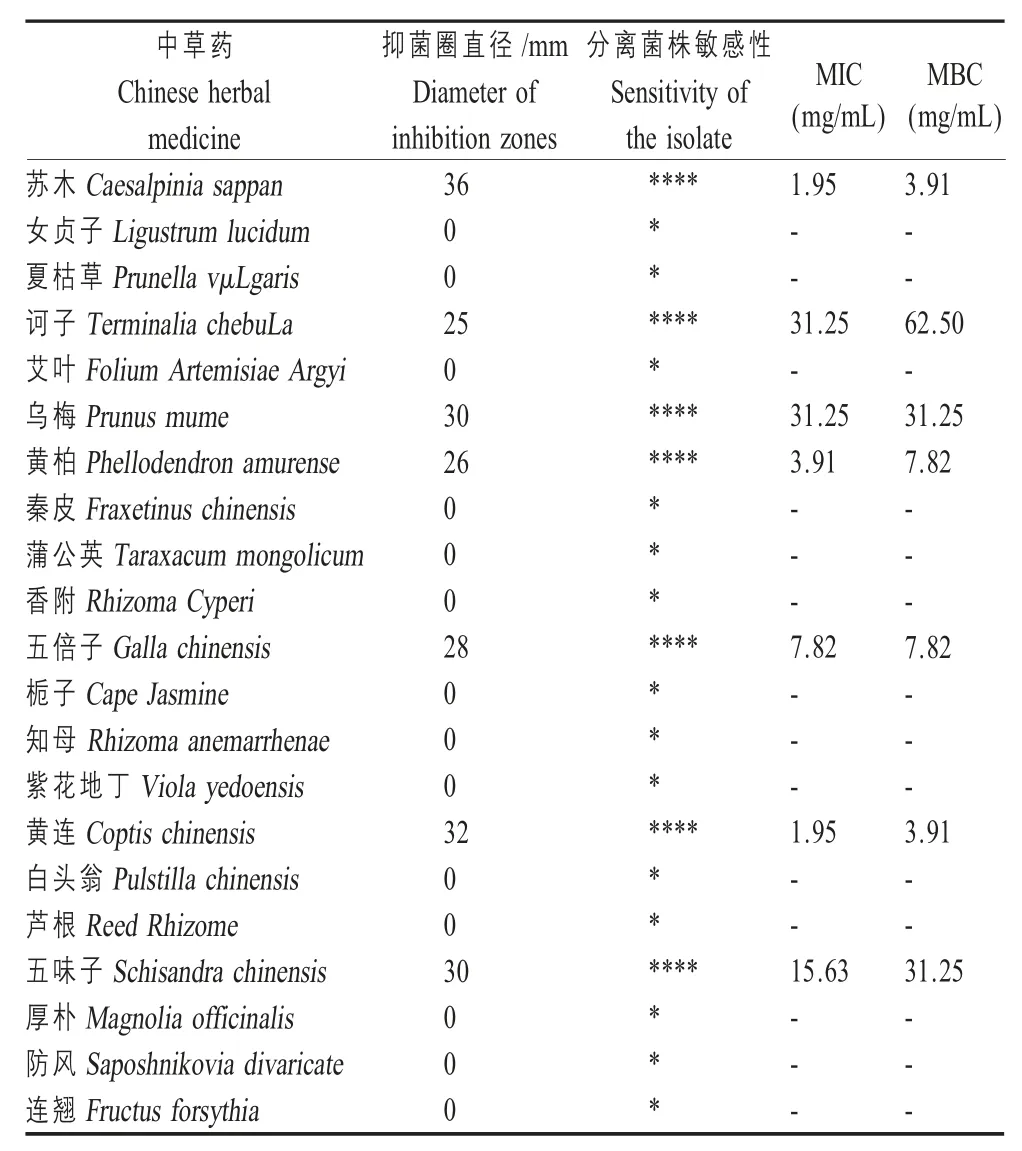
表2 分离菌株中药药敏试验结果Table 2 Chinese herbal medicine susceptibility test of the isolate
3 讨 论
腔隙莫拉菌是一种条件性致病菌,也是人畜共患菌之一,其可以导致结膜炎、儿童中耳炎、慢性鼻窦炎及咽炎。由该菌引起的侵入性感染比较少见,国外曾有报道该菌引起人败血症[1,15]、化脓性关节炎[16]和感染性心内膜炎[17]等,国内由该菌引起的病例也较为少见。谢林峰等在患病婴儿血液中分离到腔隙莫拉菌[18];沈伊娜等报道腔隙莫拉菌可以引起人类败血症[19];赵莉萍等从脑脊液中分离到1 株腔隙莫拉菌[20];白丽等报道该菌致一位肾衰女性患者尿路感染[21];杨海莲等首次在茶饮料中检测出腔隙莫拉菌并导致人发病[22];梁莎莎报道腔隙莫拉菌可以引起男泌尿、生殖道感染[9],因此具有公共卫生学意义。近年来由腔隙莫拉菌引起人类发病的病例报道逐年增多[9,23],已经引起医护人员和科研工作者的重视。本实验从患有呼吸道疾病的牛鼻腔拭子中分离到1 株优势菌株,通过常规形态学观察、生理生化鉴定和分子生物学的方法鉴定,结果显示分离菌株Mor QHD-1 与腔隙莫拉菌同源性高达97.6%,与腔隙莫拉菌属于同一进化分支。致病性试验结果显示,该分离菌株对小鼠具有一定的致病性,因此在兽医临床上不可忽视该菌对养殖业的潜在威胁。
有效、合理使用药物是防治细菌性疾病的重要措施之一。西药药敏试验结果表明,分离菌株Mor QHD-1 对受试的15 种常用的抗菌药物大部分均敏感,这可能也是该菌引起的相关疾病偶有发生,未出现大面积流行的重要原因。此外,中药药敏试验结果显示,分离菌株 Mor QHD-1 对苏木、诃子、乌梅、黄柏、五味子、黄连、五倍子极敏;对其余中药的敏感性不同。因此,治疗由该菌引起的疾病,需结合动物本身的实际情况,根据药敏试验结果合理用药。
本实验分离的牛源腔隙莫拉菌为国内首次分离,且具有一定的致病性;此外,董文龙等研究证实腔隙莫拉菌能够跨物种传播,使山羊和人类感染发病[5],这给畜牧业的安全生产及人类的健康带来一定的风险。目前,国内外有关该菌的研究相对较少,因此对其流行趋势还需要更进一步的研究。
