植物乳杆菌共培养诱导产细菌素基因座的遗传分析
2019-05-18赵美静刘树文
赵美静 孟 强 田 雨 刘树文,2,3* 何 玲
(1 西北农林科技大学葡萄酒学院 陕西杨凌712100 2 陕西省葡萄与葡萄酒工程技术研究中心 陕西杨凌712100 3 西北农林科技大学合阳葡萄试验示范站 陕西渭南715300 4 西北农林科技大学园艺学院 陕西杨凌712100)
葡萄酒酿造过程中,植物乳杆菌可以适应恶劣的葡萄酒环境[1-2],启动二次发酵——苹果酸乳酸发酵(Malolactic fermentation,MLF)。与酒酒球菌相比较,植物乳杆菌不仅具有更多MLF 相关的酶类[3-4],而且植物乳杆菌可产生植物乳杆菌素(pln)[5-8],抑制或杀死某些葡萄酒中的有害乳酸菌,从而抑制葡萄酒破败,部分替代葡萄酒中二氧化硫作用,降低二氧化硫的使用量[9-10]。目前,在酒酒球菌中没有明确发现存在编码细菌素的基因和种类,使其不具抑菌或杀菌作用。由此,植物乳杆菌具有成为葡萄酒中苹果酸乳酸发酵剂的巨大潜能[9]。
研究表明,植物乳杆菌菌株通过与其它乳酸菌共培养,可诱导产生细菌素或提高细菌素产量[11-13]。如植物乳杆菌NC8[14]、J23[15]在液体培养基单独培养不能产生细菌素,与某些革兰氏阳性菌共培养诱导均产生细菌素。Maldonado 等学者[16]在植物乳杆菌NC8 菌株中最早发现了自诱导现象。最近研究发现,植物乳杆菌进行共培养诱导产细菌素时,不同种属的诱导菌株其诱导能力也不同[11]。目前通过共培养提高植物乳杆菌细菌素产量的研究日益增多,而如何选择诱导菌株作为细菌素产生的环境刺激因素是研究的主要方向。
细菌素的产生不仅需要外界环境的刺激,还需要其本身基因的调控。目前研究植物乳杆菌菌株的pln 基因座,发现pln 基因座非常复杂且多变[17-18],包含5 ~6 个 操纵子,plnEFI、plnJKLR、plnGHSTUV、plnMNOP 等[19],同时也不断发现新的基因[20]。很多基因的编码蛋白功能仍未知,有待进一步研究。目前发现的调控操纵子[21]有两种:plnABCD[22]和plnC8IF-plnC8HK-plnD[23],而在诱导产生细菌素的植物乳杆菌中,很多植物乳杆菌菌株 如NC8,J23 等,调 控 操 纵 子 是plnC8IFplnC8HK-plnD。研究植物乳杆菌的pln 基因座,从而发现新的功能基因或发现基因突变或基因缺失,具有重要意义。
本试验通过共培养筛选得到两株植物乳杆菌XJ25 和PC520,分离于新疆产区自发进行苹果酸乳酸发酵的干红葡萄酒和杨凌泡菜。利用全基因组测序,全面分析比较共培养产生细菌素的植物乳杆菌间基因的差异,重点关注调控操纵子之间的基因差异,探究调控植物乳杆菌细菌素表达的机制。
1 材料与方法
1.1 菌株与培养基
植物乳杆菌XJ25,PC520 等乳酸菌均由本实验室保藏,非乳酸菌菌株(巴氏醋杆菌、李斯特氏菌、大肠杆菌、金黄色葡萄球菌、粪肠球菌等)由本校食品学院惠赠。
MRS 培养基:蛋白胨1%,牛肉膏1%,酵母浸粉0.5%,葡萄糖2%,吐温-80 0.1%,磷酸氢二钾0.2%,醋酸钠0.5%,柠檬酸氢二胺0.2%,七水合硫酸镁0.02%,硫酸锰0.005%,pH 调至6.3 左右,固体培养基加入2%琼脂。
LB 培养基:胰蛋白胨1%,酵母浸粉5%,氯化钠1%,调节pH 至7.0。
YPD 培养基:葡萄糖2%,蛋白胨2%,酵母粉1%。
1.2 试剂与仪器
细菌基因组提取试剂盒,上海生物工程有限公司;DNA Marker,Taq 酶,RNaseA 等,宝生物工程(大连)有限公司;其他试剂均为国产分析纯或生化纯。
Micro CL17 高速冷冻离心机,美国赛默飞世尔科技公司;各种规格移液器,德国Eppendorf 公司;Orion Star A111 pH 计,美国赛默飞世尔科技公司;SHP-250 生化培养箱,上海森信实验仪器公司;ChampGel 5000 plus 凝胶成像仪,北京赛智科技有限公司;YJ300HC 电泳仪,北京君意科技有限公司;EXL800 酶标仪,美国博腾仪器有限公司。
1.3 方法
1.3.1 抑菌活性测定
1.3.1.1 琼脂扩散法 (Spot-on-the-lawn)[5,24]将试验菌株点样于MRS 固体培养基,37 ℃过夜培养;指示菌株按1%(终浓度5×105cfu/mL)接种于半固体培养基中,倾倒覆盖在MRS 固体培养基上,37 ℃培养24 h。
1.3.1.2 96 孔板法[15]每个孔板中加入:100 μL(2×)LB 液体培养基,100 μL 不同稀释梯度的无细胞上清液,30 μL 的指示菌株 (金黄色葡萄球菌,终浓度107CFU/mL),37 ℃,静止培养24 h;每3 h测定OD600。对照组不添加上清液,指示菌株正常生长。重复3 次。其中,当稀释一定倍数的无细胞上清液可抑制50%指示菌株生长时,表示抑菌活性为1 AU。
1.3.2 共培养诱导[15]分别将2%过夜培养的植物乳杆菌(活菌数至109cfu/mL),与0.5%用于诱导的菌株(活菌数为107cfu/mL),接种至MRS 培养基中,37 ℃诱导培养55 h。每3 h 取样测OD600;同时取样4 mL,12 000 r/min 离心15 min,获得上清液;调节上清液pH 至7.0;0.22 μm 滤膜过滤除菌,利用96 孔板法测抑菌活性,其中对照组为单独培养的植物乳杆菌及诱导菌株。在此基础上,对共培养上清液进行过氧化氢酶,蛋白酶K(1 g/L)等处理,同样测定抑菌活性。
1.3.3 共培养产细菌素植物乳杆菌基因组重测序及pln 基因座分析[12,17]按照细菌基因组提取试剂盒步骤,提取产细菌素菌株基因组DNA,送由北京诺禾致源生物公司,对筛选获得产细菌素植物乳杆菌菌株进行全基因组重测序。此外,植物乳杆菌XJ25 和PC520 经全基因组重测序的基因组序列已在NCBI 公开发布,GenBank 序列登录号分别为:MAXE00000000 和MAMT00000000。
植物乳杆菌菌株的pln 基因座序列数据分析与处理:RAST Server(http://rast.nmpdr.org/)进行pln 基因座基因注释;在NCBI 利用Blast 比对分析基因间的差异;利用Lasergene 7.0 软件,进行基因序列及蛋白序列分析;Easyfig2.1 软件作图,获得菌株的pln 基因座遗传图谱。
2 结果与分析
2.1 产细菌素植物乳杆菌的初筛
在固体培养基上,对14 株植物乳杆菌进行抑菌活性测定,从中筛选获得了两株抑菌谱广,且抑菌效果较强的植物乳杆菌XJ25 和PC520。其中,12 株指示菌包括致病菌,及葡萄酒中可能存在的微生物(酒酒球菌、植物乳杆菌、短乳杆菌、酿酒酵母、醋酸菌等)。由表1可知,14 株试验菌株对酿酒酵母及单增李斯特氏菌均无抑制性;相反地,植物乳杆菌XJ25 和PC520 对其他9 株指示菌株都有较强的抑制作用。13 株植物乳杆菌 (除542外),对大肠杆菌,粪肠球菌,金黄色葡萄球菌均有明显抑制效果。由此,试验选择金黄色葡萄球菌作为96 孔板法测定抑菌活性的指示菌株。同时,醋酸菌是葡萄酒中的污染菌,可导致葡萄酒的“酸破败病”,而14 株植物乳杆菌中,只有4 株菌(XJ25,PC520,215,509)对醋酸菌表现了较强抑菌效果。
综上所述,14 株植物乳杆菌中,菌株XJ25 和PC520 抑菌范围大,抑菌性较强,对醋酸菌有一定的抑制作用。
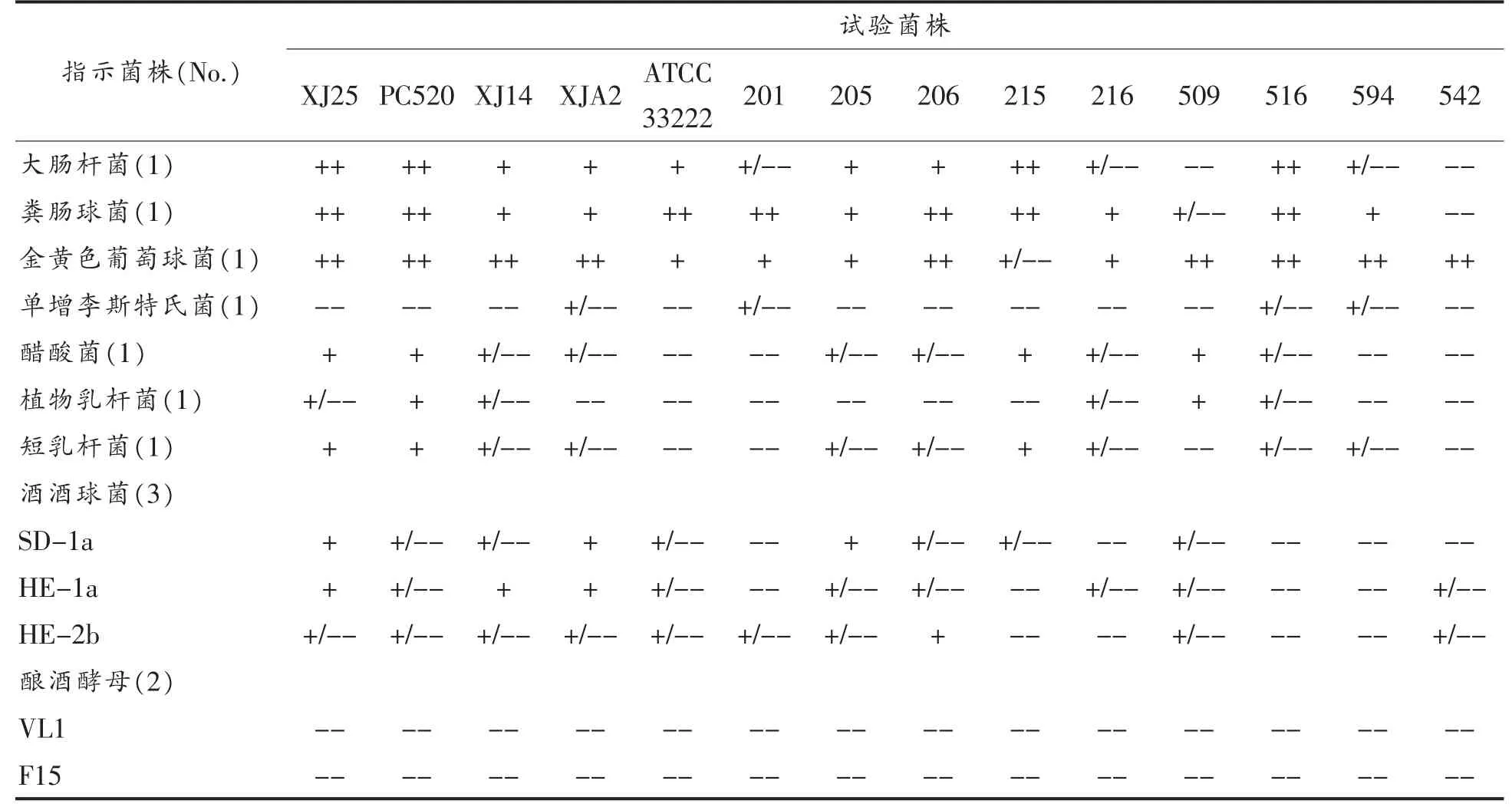
表1 Spot-on-lawn 法测得植物乳杆菌菌株XJ25 和PC520 抑菌活性Table 1 Antimicrobial activity of L.plantarum XJ25 and PC520 by the “spot-on-the-lawn” method
2.2 共培养诱导
进行共培养诱导时,用于诱导的菌株粪肠球菌ATCC25923 不能使植物乳杆菌XJ25 和PC520 产生抑菌活性,表明了诱导菌株具有一定的选择性,不同菌株诱导能力有所不同,这与之前研究相符[12]。结果进一步表明,植物乳杆菌XJ25、PC520,诱导菌株粪肠球菌XJ26M、ATCC25923 单独培养时,对指示菌株无抑制性,而与粪肠球菌XJ26M 共培养,成功诱导XJ25 和PC520 产生抑菌性。如图1所示,植物乳杆菌XJ25 和PC520 在共培养生长条件下,在生长对数期(4~25 h)产生抑菌活性,并在10 h 后,抑菌活性高达220 AU/mL。在即将进入稳定期前,抑菌物质产量低至15 AU/mL。并且,菌株XJ26M 经高温灭活后,试验菌株XJ25 和PC520 均无抑菌性,灭活菌株XJ26M 失去了诱导能力。这表明植物乳杆菌XJ25 和PC520,在外环境刺激(活的粪肠球菌XJ26M)下,才可诱导产生抑菌性。

图1 植物乳杆菌XJ25,PC520 和粪肠球菌XJ26M共培养生长和共培养诱导上清液抑菌活性曲线图Fig.1 Growth curves of L.plantarum strain XJ25 and PC520 co-cultivated with E.faecalis XJ26M and production of inducible antimicrobial activity of cell-free supernatants
共培养诱导上清液进一步进行蛋白酶K 等处理,失去了抑菌活性,进一步确定了抑菌活性物质为蛋白类物质——细菌素。因此,试验成功筛选出两株与粪肠球菌XJ26M 共培养,产生细菌素的植物乳杆菌XJ25 和PC520。
2.3 植物乳杆菌XJ25 和PC520 的pln 基因座遗传分析
植物乳杆菌XJ25 和PC520 的pln 基因座,分别由一段22 383 bp 和20 983 bp 核苷酸序列组成,并获得其pln 基因座遗传图谱(如图2);同时,两株菌pln 基因座中的orfs,与植物乳杆菌NC8[16],J23[20]进行相似度比较及编码蛋白功能预测(表2)。
结果表明,菌株XJ25 和PC520 的pln 基因座,均有6 个操纵子(plnEFI、plnJKLR、plnGHSTUVW、plnABCD、plnMNOP、plnWXY)组成,还有一个新的未知功能的orf1;与NC8 和J23 的pln 基因座比较,XJ25 和PC520 的pln 基因座十分完整,并且两株菌的基因座核苷酸序列较长。
操纵子plnGHSTUV 具有高度保守性;由表2可知,不同菌株间,转运操纵子plnGHSTUV 的基因相似度高达99%~100%。由其中基因编码蛋白功能可知,此操纵子功能与细菌素的转运相关。菌株PC520 中plnS 基因发生了缺失,这可能影响细菌素的转运功能。
操纵子plnEFI 和plnRLJK,是细菌素的结构基因,编码细菌素PlnE、PlnF、PlnJ、PlnK;其中,PlnL 和PlnI 为免疫蛋白。这两个操纵子相对保守,但与菌株NC8 和J23 的plnF 基因进行序列比对时,发现试验菌株XJ25 的plnF 基因,有两个位点突变,从而导致编码蛋白PlnF 分别在14 位(AS)和42 位(V-I),产生两个氨基酸突变(图3A),而之前研究并没有发现plnF 基因突变,而对plnE基因研究发现两个氨基酸的缺失,导致其功能的改变[25]。
由表2可知,操纵子plnMNOP,其中编码的蛋白功能主要体现在免疫方面,并且相较以上的结构基因编码的细菌素,PlnN 蛋白无任何细菌素活性,但是,菌株XJ25 的plnM 基因与NC8 的相似度只有95%。
操纵子plnWXY 中,plnX 和plnY 分别编 码HigB、HigA 毒性蛋白,他们在pln 基因座中的功能还未知,但是结果发现,菌株PC520 的plnY 基因发生了缺失。

图2 植物乳杆菌XJ25 和PC520 细菌素基因座遗传图谱Fig.2 Genetic map of the pln loci in L.plantarum XJ25 and L.plantarum PC520

表2 植物乳杆菌XJ25 和PC520 细菌素基因座编码蛋白及其相似度比较Table 2 Proteins encoded by pln loci of two strains and their similarity to each other’s counterparts
植物乳杆菌XJ25 和PC520,调控操纵子是三组分plnABCD(图2),但是两株菌的plnB 和plnC基因,相似度只有97%左右,其中分别有38 个与17 个碱基不同,说明调控子的复杂多变性。而与植物乳杆菌NC8 和J23 的调控子plnNC8IFNC8HK-D 相较,基因差异很大,导致功能发生改变[23]。plnNC8IF 基因编码蛋白自诱导肽(AIP)与plnA 基因编码的蛋白PlnA 诱导肽相较,其诱导能力更强。plnB 和plnNC8HK 基因,均编码产生组氨酸蛋白激酶,但基因序列差异很大,这可能导致组氨酸蛋白激酶的活性的改变。而研究表明,菌株NC8 的自诱导能力与其调控子相关,特别是自诱导肽的存在,导致自诱导现象产生[16]。而试验菌株XJ25 和PC520 不能进行自诱导,说明调控子plnABCD 与plnNC8IF-NC8HK-D 从基因差异可能导致功能的改变。
同时,在XJ25 和PC520 的pln 基因座中发现了1 个未知的orf1(图3B)。其中,orf1 编码的假设蛋白包括30 个氨基酸,其功能有待进一步研究。
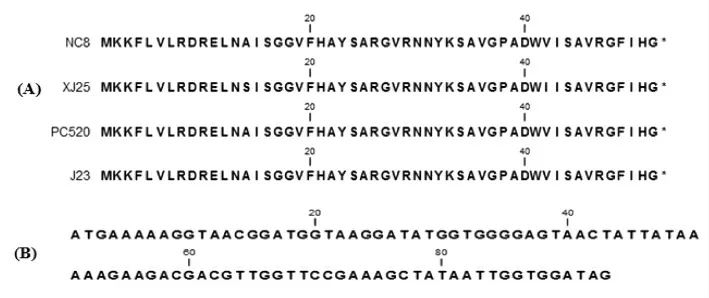
图3 细菌素PlnF 蛋白序列比对及orf1 的核苷酸序列Fig.3 The sequence alignments of bacteriocin PlnF protein and orf1 DNA sequence
在植物乳杆菌XJ25 和PC520 共培养过程中,粪肠球菌XJ26M 是诱导其细菌素产生的不可或缺的环境因素。而植物乳杆菌细菌素的产生不仅受外在环境刺激,更有内在25~26 个基因的共同调控。其中,pln 基因簇控制植物乳杆菌细菌素的合成,转运,免疫,分泌及调控等。植物乳杆菌XJ25 和PC520,基于全基因组重测序,对其进行pln 基因座遗传比较分析发现6 个操纵子,与目前研究的pln 基因簇相似。多数保守基因的序列比对结果,相似度在98%~100%,其编码的蛋白功能基本不变。并且分析表明,个别基因(plnF、plnB、plnT、plnY)发生了突变或缺失,这可能导致编码蛋白功能的改变,从而影响植物乳杆菌细菌素的产生,这有待进一步研究。
同样地,植物乳杆菌NC8 和J23 也只能通过共培养诱导产生细菌素。与试验菌株进行pln 基因座分析比较,发现pln 基因间的差异非常大。植物乳杆菌NC8 和J23 的pln 基因座中,调节操纵子是三组分plnNC8IF-NC8HK-D,可编码产生自诱导肽,菌株XJ25 和PC520 也可诱导其产生细菌素,调控子是plnABCD,不能产生子诱导肽。因此,共培养条件下诱导产生细菌素,由两种不同的调控操纵子发挥作用,这与Maldonado 等人[12]的研究相符。
3 结论
植物乳杆菌中,共培养现象是普遍存在的。植物乳杆菌XJ25 和PC520,通过与活菌粪肠球菌XJ26M 共培养,诱导产生细菌素。而植物乳杆菌素的产生受多个基因的共同调控,其中植物乳杆菌XJ25 和PC520 的pln 基因座,均有6 个操纵子组成;但个别基因(plnF、plnY、plnT)发生了突变或缺失,这可能导致其编码蛋白功能的改变或丧失,最终可能影响植物乳杆菌细菌素表达。植物乳杆菌的pln 基因座虽然相似,但仍有新的orf 出现,功能也有待进一步研究。
