瑞士乳杆菌与木糖葡萄球菌对发酵香肠蛋白质分解和游离脂肪酸释放的影响
2019-05-18田建军张开屏景智波杨明阳
田建军 张开屏 景智波 杨明阳 靳 烨*
(1 内蒙古农业大学食品科学与工程学院 呼和浩特010018 2 内蒙古商贸职业学院食品工程系 呼和浩特010070)
低pH 香肠是在我国传统自然发酵肉制品的基础上,通过添加微生物发酵剂使其快速产酸,降低香肠的pH 值,在发酵结束时香肠的pH 值达到规定安全酸度5.3 以下,香肠成品色泽呈玫瑰红色,风味独特,货架期变长[1-3]。pH 值、风味物质等变化离不开糖类、 脂肪、 蛋白质等物质的分解氧化,pH 值的变化主要是由乳酸菌对糖类物质分解产生乳酸等小分子有机酸所致,通过添加乳酸菌发酵剂可缩短香肠发酵周期,并且低酸度有利于抑制香肠中腐败菌和致病菌的生长,影响营养物质与水分子结合能力和亚硝酸盐等酶类活性,因此添加乳酸菌发酵剂对发酵肉制品加工具有重大益处[4-5]。香肠干燥成熟过程为游离脂肪酸释放的关键时期,游离脂肪酸进一步被氧化分解为醇、醛、酮等风味物质,脂肪氧化分解是香肠风味物质的主要来源[6-7]。蛋白质主要被分解为核苷、核苷酸及游离氨基酸等,这些小分子物质被称为非蛋白质。有研究表明,香肠中蛋白质水解反应主要由内源蛋白酶催化,这些酶包括组织蛋白酶与钙激活蛋白酶,多数情况下微生物产生的酶类对蛋白质不起作用[8]。在干燥成熟期间,蛋白质和脂肪进入氧化分解高峰期。本试验设置3 个试验组,分别为自然发酵对照组、 单一组瑞士乳杆菌组和瑞士乳杆菌与木糖葡萄球菌复配组,通过这3 组对比说明微生物发酵剂和内源组织酶对蛋白质和游离脂肪酸释放的影响。
1 材料与方法
1.1 试验材料与设备
1.1.1 主要原辅料 原料肉:羊肉(内蒙古蒙羊公司提供,肥瘦比为1∶4)。肠衣:25 mm 羊小肠。辅料:食盐、抗坏血酸。发酵剂:瑞士乳杆菌(Lactobacillus helveticus)和木糖葡萄球菌(Staphylococcus xylosus),由内蒙古农业大学食品科学与工程学院肉品科学技术团队提供。
1.1.2 主要药品 葡萄糖、蔗糖、硝酸钠、亚硝酸钠、正己烷、三氟化硼-乙醚、氯化钠、氢氧化钠均为分析纯;甲醇、三氯甲烷、丙酮、37 种游离脂肪酸标准品。
1.1.3 主要仪器 F-11 pH 计,香港兴万电子仪器有限公司;HD-3A 智能水分活度测量仪,上海精密仪器仪表公司;LRH-250-HS 恒温恒湿培养箱,天津市福元铭仪器设备有限公司;SXT-02 索氏抽提器,上海洪纪仪器设备有限公司;GZX-9246MBE 数显式鼓风干燥箱,上海博迅实业有限公司医疗设备厂;RE-52AA 旋转蒸发器,上海亚荣生化仪器厂;GC2014 岛津气相色谱仪,日本岛津公司。
1.2 试验方法
1.2.1 香肠工艺 配方:瘦肉80%、肥膘20%、蔗糖0.5%、葡萄糖0.5%、食盐2.5%、硝酸钠100 mg/kg、亚硝酸钠70 mg/kg、抗坏血酸0.05%、发酵剂108CFU/g。
工艺流程:原料肉→瘦肉绞碎,肥肉切丁→搅拌腌制(4 ℃,12 h)→灌肠→排气→发酵 (25 ℃,RH=90%~95%,60 h)→干燥→成熟→成品。
工艺条件:
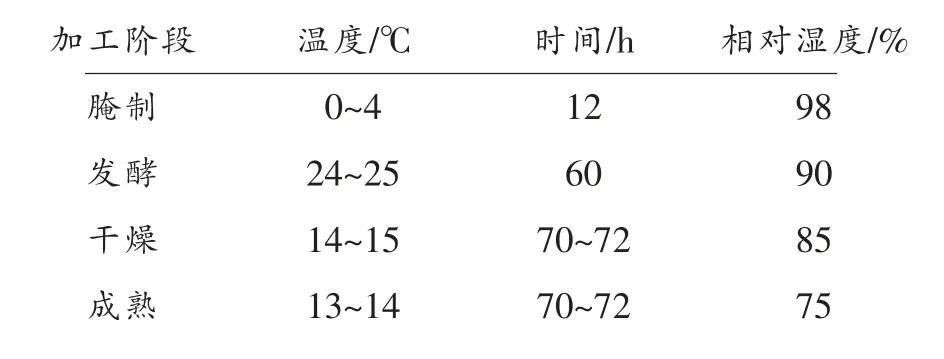
表1 发酵香肠工艺条件Table 1 Fermented sausage processing conditions
1.2.2 试验设计 在采用预试验以及单因素模拟试验基础上,发酵剂瑞士乳杆菌与木糖葡萄球菌最佳复配比为1 ∶2。本试验共分3 组,第1 组为对照组 (即不添加发酵剂),第2 组为瑞士乳杆菌(Lactobacillus helveticus)单一组,第3 组为瑞士乳杆菌(Lactobacillus helveticus)和木糖葡萄球菌(Staphylococcus xylosus)发酵剂复配组(1 ∶2)。分别于灌肠后(0 d)、腌制(0.5 d)、发酵结束(3 d)、干燥中期(6 d)、干燥结束即成熟(9 d)、后熟24 d、37 d 等工艺点测定香肠理化指标。
1.2.3 理化指标测定
1.2.3.1 pH 的测定 参照GB9695.5-2008 的方法,将25 g 样品粉碎后加入225 mL 蒸馏水锥形瓶中,磁力搅拌0.5 h,待稳定用pH 计测定。
1.2.3.2 Aw 的测定 采用TESTO650 水分活度仪,将样品切碎并平铺放于称放皿中,测定10min,记录结果,重复3 次。
1.2.3.3 亚硝酸盐测定 依据GB 5009-33-2010测定。
1.2.3.4 蛋白质分解指数测定 将2 g 肉样加到盛18 mL 蒸馏水的50 mL 离心管中,用组织破碎机均质2 min,然后在5 ℃条件下100 r/min 离心15 min,用whatman1# 过滤上清液,重复一次,称量滤液体积 (V)。取15 mL 滤液和15 mL 10%TCA,在室温下静置30 min,与上述同样条件下离心,用whatman4# 过滤上清液,取5 mL 用凯氏定氮的方法测定氮含量N1,通过N0(0.2V×N1)计算非蛋白氮含量,总氮含量为N。蛋白水解指数PI=N0/N。
1.2.3.5 脂肪酸测定 脂肪酸提取:将样品低温下粉碎,然后称取10 g 样品于250 mL 三角瓶中,加入135 mL Folch 液(三氯甲烷∶色谱级甲醇=2∶1),振摇3 h,浸泡8 h 后用G3 漏斗过滤,移取5 mL、20%的NaCl 溶液于滤液中。待静止分层后,吸取下层液体,在下层液体中加入适量无水Na2SO4脱水。稍等片刻,将液体吸入旋转蒸发瓶,在40 ℃的水浴条件下旋转蒸发,浓缩即得脂肪。加入0.5 mol/L 的NaOH/CH3OH 溶液5 mL,70 ℃下回流5 min。加入5 mL 三氟化硼-乙醚和甲醇混合液(1∶3),70 ℃下回流2 min,进行甲酯化。再加3 mL 正己烷,70 ℃下回流1 min。接着加入5 mL 饱和NaCl溶液,静置10 min,移取1 mL 上层液体于1.5 mL 离心管中,放入-80 ℃冰箱中待测。
气相色谱条件:升温程序:初温为120 ℃,保持5 min,然后以4 ℃/min 的速率升至250 ℃,250℃保持28 min;进样口温度250 ℃,检测器温度280 ℃;载气为高纯氮气(99.99%),氢气流速为40 mL/min,恒定柱流速为1.1 mL/min,分流比20 ∶1;进样量1.0 μL。
脂肪酸含量计算:
脂肪酸含量计算公式(1):
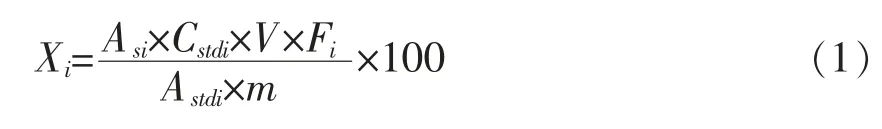
式中:Xi——100g 脂肪中各脂肪酸含量,mg/100g;Asi——试样溶液中各脂肪酸甲酯的峰面积;Cstdi——脂肪酸甲酯标准液中各脂肪酸甲酯的质量浓度,mg/mL;V——加入正己烷的体积,mL;Fi——各脂肪酸甲酯转化为脂肪酸的换算系数;Astdi——标准液中各脂肪酸甲酯的峰面积;m——10 g 香肠中的脂肪含量。
1.3 数据处理
采用Excel 和SAS9.0 对数据进行统计分析。
2 结果与分析
2.1 香肠pH
发酵肉制品pH 下降主要由于原料肉中微生物及外加乳酸菌分解糖类物质生成乳酸所致,添加乳酸菌和葡萄球菌可以产生脂肪酶与蛋白酶,对脂肪和蛋白分解会产生游离脂肪酸和氨基酸,但也伴随着脱氨等分解反应的进行,因而当产酸速率低于产氨等碱性物质生成速率时,或随着干燥成熟进行,水分含量逐渐下降及蛋白质缓冲作用等,又会使pH 逐渐回升[9-10]。
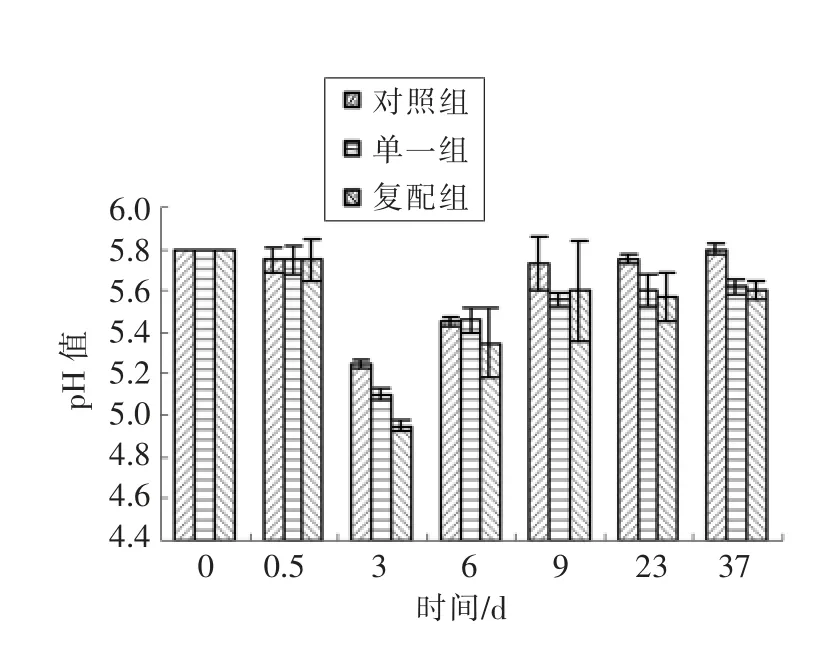
图1 不同发酵剂产酸能力对比Fig.1 Comparison of acid production capacity of different fermentation agents
如图1所示,发酵香肠在0~0.5 d 腌制期间由于温度(4 ℃)较低致使原料肉中微生物生命活动被抑制,pH 基本没有变化;腌制结束,将原料肉进行灌肠排气,然后在25 ℃、90% RH 条件下发酵,在发酵过程中3 个试验组pH 分别快速下降,发酵结束时(3 d)对照组、单一组、复配组pH 分别为5.25,5.1,4.95,对照组>单一组>复配组,3 组差异显著(P<0.05),由此可知添加复配发酵剂产酸速率>单一发酵剂>对照组,说明植物乳酸菌与木糖葡萄球菌复配可加速乳酸含量增加,也可能促使游离脂肪酸和游离氨基酸生成;在3~6 d 干燥过程中,加工环境温度和湿度(RH)急剧下降到15℃、85%,香肠水分含量也不断降低,致使乳酸菌等活性被抑制,蛋白质被分解产生碱性物质可能相对加快,促使整体pH 出现回升现象,6 d 末干燥结束时对照组、单一组、复配组3 组pH 分别为5.45,5.46,5.35;在6~9 d 成熟过程中,温度降到13 ℃、RH 降为75%,此时环境湿度急剧降低,导致香肠Aw 低于0.85,大部分微生物生命活动被抑制,酶活性也受到影响,因而氨类物质产生速率下降,成熟过程中pH 变化也变缓,最后分别升到5.73,5.56,5.60;成品在一周和两周贮藏情况下,与成熟期结束时pH 差异不显著(P>0.05)。
2.2 香肠Aw
水分活度(Aw)已经成为衡量食品保藏期长短的一个重要指标,可以说Aw 是控制食品腐败变质的重要因素。从微生物与Aw 关系来说,当Aw 大于某个临界值时,特定微生物才能得以生长,如绝大多数细菌要求Aw 大于0.9、霉菌要求Aw 大于0.8,而耐盐菌要求最低Aw 为0.75,当Aw 低于0.6 时绝大多数微生物无法生长;从酶与水分活度关系来看,Aw 高低影响酶促反应底物流动性以及酶的构象,当食品中Aw<0.85 时,酶活性大幅下降[11]。因此Aw 成为衡量食品品质和货架期的一个重要影响因素。
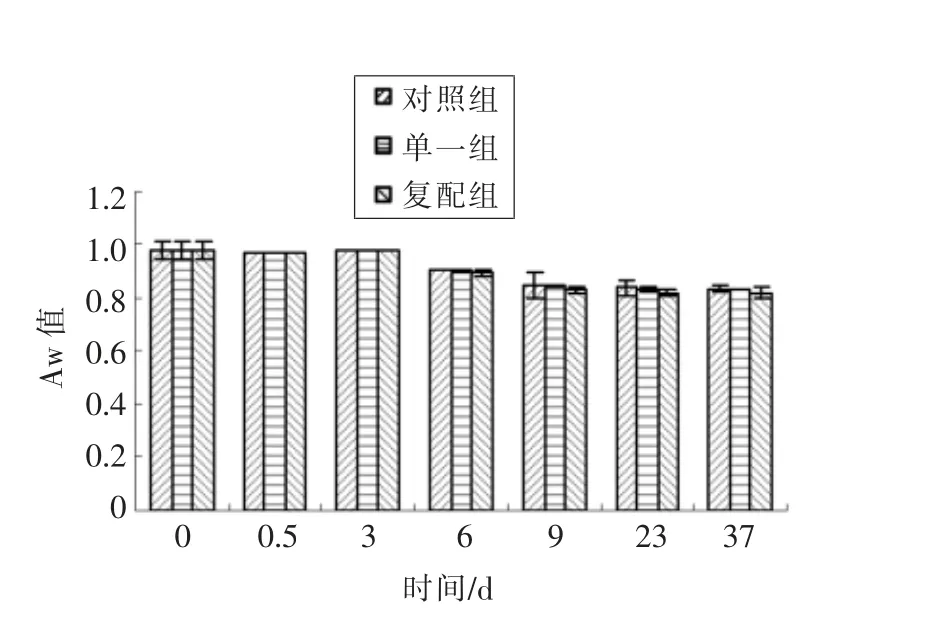
图2 不同发酵剂对低酸发酵香肠Aw 影响Fig.2 Effects of different starter cultures on Aw of low acid fermented sausages
由图2中3 组Aw 变化趋势可知,原料肉、腌制、 发酵结束3 个阶段Aw 变化微小,3 组Aw 均在0.98±0.5 范围内,且3 组差异不显著(P>0.05);3d 发酵结束香肠环境温度和湿度都随之降低,进入干燥初期,在3~6 d 干燥过程中,环境温度和RH 均低于香肠内部值,因而形成温度和湿度降低梯度,干燥初期结束时对照组、单一组、复配组Aw分别降低到0.91,0.90,0.89,与发酵结束时0.98(Aw)相比,下降速率复配组>单一组>对照组,说明添加混合发酵剂可能较单一发酵剂更有助于Aw 下降,这一现象与吴满刚等[12]研究结果相似;6~9 d 成熟过程中,各组Aw 仍急剧下降,在9 d 末对照组、单一组、复配组分别为0.85,0.84,0.83;在9~37 d 过程中,Aw 下降缓慢,在37 d 末对照组和单一组均为0.83、复配组降到组中最低0.82。
2.3 香肠中亚硝酸盐
亚硝酸盐是肉制品重要的发色剂,此外还具有抑菌防腐作用,并可消除原料肉不适风味,提高产品质量[13]。亚硝酸盐作为强氧化剂可氧化亚铁为高铁,失去携带氧气能力,产生中毒现象;当亚硝酸盐过量时,会与食品中胺类物质结合生成亚硝胺强致癌物质[14]。
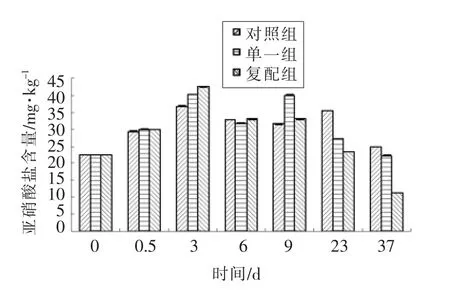
图3 不同发酵剂对低酸发酵香肠亚硝酸盐变化的影响Fig.3 Effects of different starter culture on nitrite changes of low acid fermented sausages
由图3可知,原来肉中也含有一定量亚硝酸盐,但含量符合国家规定安全合格标准,小于30 mg/kg[15];在腌制结束时相比原料肉含量有所上升,是因为在腌制过程中加入硝酸盐和亚硝酸盐;3 d末发酵结束,3 组亚硝酸盐含量急剧上升,对照组、 单一组、 复配组含量分别为36.8,40.2,42.5 mg/kg,相比腌制结束,复配组亚硝酸盐增加速率显著快于单一组(P<0.05),与含量最低对照组差异极显著(P<0.01),这一现象可能是由于复合发酵剂产生硝酸盐还原酶含量高于其他两组,加速亚硝酸盐含量上升;随着香肠进入干燥初期,环境温度和RH 的降低,Aw 下降,硝酸盐还原酶活性可能被抑制或发酵剂对亚硝酸盐分解速率加快,促使整体亚硝酸盐含量急剧下降[16];6~9 d 成熟过程,对照组和复配组含量变化差异微小;在成熟结束时复配组急剧下降,在37 d 末3 组均下降到整个过程最低值,对照组、单一组、复配组含量分别为24.8,22.3,11.330 mg/kg,低于国标规定30 mg/kg[15]。说明添加复合发酵剂可有效降低成品香肠中亚硝酸盐含量,提高产品安全性。
2.4 香肠中蛋白质分解指数(PI)
蛋白质分解指数代表香肠中蛋白质被分解程度,分解产物被称为非蛋白氮,主要为核苷、核苷酸以及游离氨基酸等。这些物质在肉制品风味贡献方面起着相当重要的作用。原料肉中蛋白质分数指数PI 为20%,腌制期间PI 降为16%;在发酵结束时,对照组PI 仍为16%,单一组上升至19%,复配组却下降到13%,可能复配组较低pH 抑制蛋白质分解酶的活性;随着发酵结束干燥过程开始,各组pH 均急剧上升,表明蛋白分解酶活性逐渐增强,在6 d 末干燥结束时3 组PI 均上升至25%;在6~9 d 时,复配组PI 以平均25%速率急剧上升,9 d 末即成熟结束时复配组PI 高达33%,高于对照组30%和单一组29%,且对照组>单一组,说明蛋白质分解主要依赖于原料肉中蛋白酶而非乳酸菌,并且加入的木糖葡萄球菌对游离氨基酸等非蛋白氮物质产生也贡献一定力量;9~23 d 的成品贮藏两周过程中PI 略有上升,但在23~37 d贮藏过程中各组PI 基本保持不变。
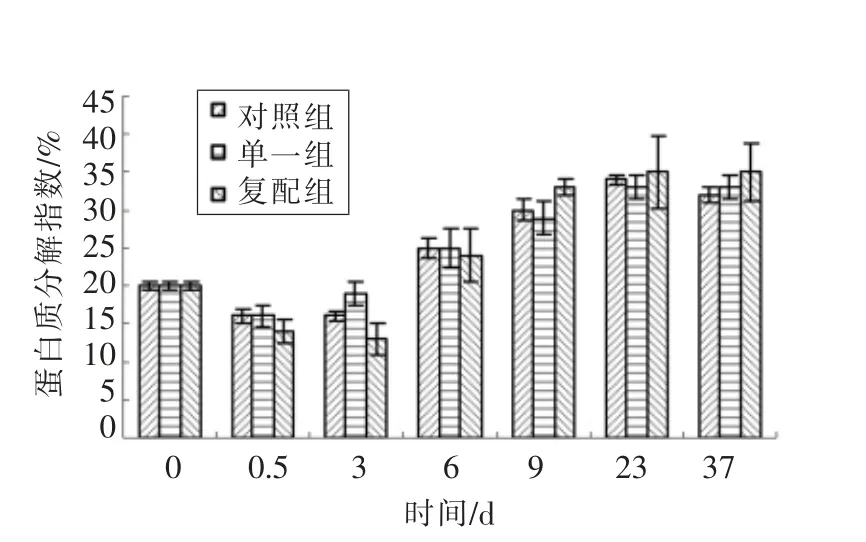
图4 肠乳中蛋白质分解指数PIFig.4 Protein decomposing index of fermented sausages
2.5 香肠中游离脂肪酸
游离脂肪酸是由脂肪氧化分解形成,此过程受到加工工艺温度、发酵pH、湿度等条件影响[17]。所添加的发酵剂乳酸菌等具有分解有机酸、 脂肪酸等酶系,可分解生成有机酸降低肉制品pH,同时也可将产品中脂肪分解为短链挥发性脂肪酸、醛、酯等赋予发酵肉制品特有风味[18],还可促进饱和脂肪降解、 加速单不饱和脂肪酸和多不饱和脂肪酸的释放[19]。
图5表明,饱和脂肪酸在原料肉中含量较高,可能原料肉中脂肪酶及微生物数量较少,已生成的饱和脂肪酸没有被及时转化或分解;随着发酵开始,接种发酵剂的单一组和复配组饱和脂肪酸含量均降低,相比单一组,复配组下降幅度较大,由原料肉中18.98 mg/kg 降至发酵结束时的6.13 mg/kg,而对照却大幅上升,发酵结束时对照组SFA 含量24.97 mg/kg 显著高于原料肉中15.13 mg/kg,可能添加的瑞士乳杆菌和木糖葡萄球菌发酵剂在发酵期间大量繁殖促使饱和脂肪酸转化或分解[20],导致复配组SFA 含量快速下降,根据饱和脂肪酸可引起高血压、高血脂和血胆固醇、低密度脂蛋白胆固醇升高等疾病,因而添加复配发酵剂可能降低这些富贵病发生机率;在3~9 d 干燥成熟过程中,各组饱和脂肪酸含量均下降,成熟结束时复配组含量显著低于单一组(P<0.01);成品贮藏14 d 后SFA 含量与成熟结束时成品相比,各组饱和脂肪酸变化不显著;但香肠被贮藏28 d 后与贮藏14 d 后的SFA 含量相比,复配组仍有小幅下降,单一组含量减少较多。
图6表明,对照组MUFA 含量呈先上升后下降趋势,在9 d 末成熟结束时含量达到最高,为52.77 mg/kg,显著高于此时单一组33.6 mg/kg 和复配组31.6 mg/kg;整个过程单一组和复配组MUFA 含量一直呈现上升趋势,与对照组成熟后期贮藏过程中MUFA 含量变化规律恰好相反;通过比较3 组MUFA 含量变化,可知在0~23 d 对照组含量一直高于单一组和复配组,且单一组和复配组MUFA 含量差异不显著(P>0.05),可能是由于内源脂肪酶对MUFA 的释放起到主要作用,这一现象与沈清武[19]研究相一致。
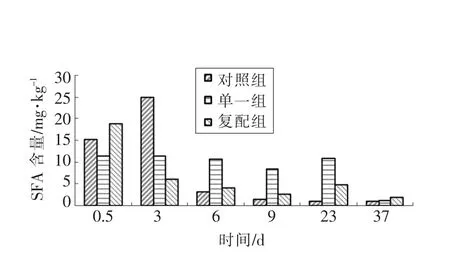
图5 不同发酵剂对低酸香肠SFA 含量影响Fig.5 Effects of different fermentation agents on the SFA of the low acid sausages
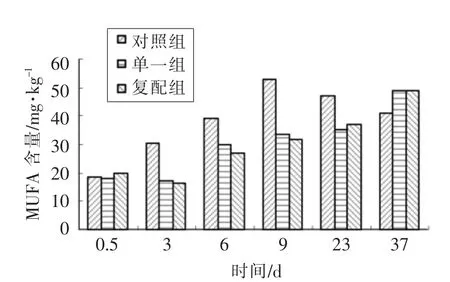
图6 不同发酵剂对低酸香肠MUFA 含量影响Fig.6 Effects of different fermentation agents on the MUFA of the low acid sausages
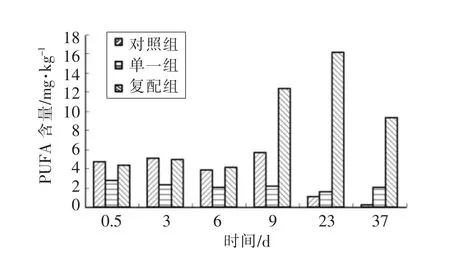
图7 不同发酵剂对低酸香肠PUFA 含量影响Fig.7 Effects of different fermentation agents on the PUFA of the low acid sausages
由图7可知,在干燥结束之前,PUFA 释放速率:对照组>复配组>单一组,说明香肠在干燥前脂肪的水解主要由内源酶引起;在成熟和后期贮藏过程中,复配组MUFA 释放速率>对照组和单一组,说明木糖葡萄球菌对脂肪水解主要发生在香肠成熟后期。由图6和图7可知,单不饱和脂肪酸(MUFA)释放速率>多不饱和脂肪酸(PUFA)。通过图5、图6和图7可知,复配组香肠在成熟后期:单不饱和脂肪酸(MUFA)含量>多不饱和脂肪酸(PUFA)>饱和脂肪酸 (SFA);单一组与对照组:MUFA 含量>SFA>PUFA。
3 结论
通过添加瑞士乳杆菌及木糖葡萄球菌,将本试验分为对照组、 瑞士乳杆菌单一发酵剂组以及瑞士乳杆菌与木糖葡萄球菌复配发酵剂组:在60 h 发酵过程中,复配组pH 快速下达到香肠安全控制范围,且复配组pH<单一组<对照组,说明添加复配发酵剂可迅速降低香肠pH、缩短香肠发酵周期;由于复配组pH 快速下降,减小蛋白质等物质对水分子的束缚能力,促使水分Aw 下降速率快于单一组和对照组;pH 下降也抑制硝酸盐还原酶活性,在香肠成熟及贮藏期降低亚硝酸盐含量,降到国标规定安全值30 mg/kg 以下。
通过探究内源酶和微生物发酵剂对蛋白质分解和游离脂肪酸释放速率可知:对照组、单一组、复配组3 组蛋白质分解指数PI 在发酵结束后呈现逐渐上升趋势,且复配组蛋白质分解指数PI>对照组>单一组,说明内源组织蛋白酶对香肠中蛋白质分解起到主要作用,木糖葡萄球菌对蛋白质分解能力>瑞士乳杆菌。添加瑞士乳杆菌与木糖葡萄球菌可有效降低香肠中饱和脂肪酸SFA 含量,在3~37d,复配组SFA 含量<单一组<对照组;对于单不饱和脂肪酸MUFA,0~23 d 对照组含量高于单一组和复配组,说明原料肉中内源脂酶对MUFA释放速率>瑞士乳杆菌和木糖葡糖球菌;在0~6 d内源脂酶对PUFA 释放速率,对照组>复配发酵剂>单一瑞士乳杆菌,在6~37 d 复配发酵剂释放PUFA 速率>对照组,说明在干燥结束后微生物脂肪对PUFA 的释放起到主要作用。成品香肠中不饱和脂肪(UFA)含量>饱和脂肪酸(SFA),且复配组香肠中不饱和脂肪酸含量显著高于对照组(P<0.05),饱和脂肪酸含量<对照组。
