淀粉对微生物的结合作用及应用研究进展
2019-05-18赵国华张蕴玉叶发银
赵国华 张蕴玉 雷 琳 叶发银*
(1 西南大学食品科学学院 重庆400715 2 重庆市甘薯工程技术研究中心 重庆400715)
微生物对食品组分或基质表面的粘附现象在食品工业及营养健康领域十分常见[1-2]。食源性致病微生物在食品表面粘附增殖是导致食品腐败,造成安全问题的首要条件[3]。解决这一问题的有效措施是减少或消除微生物粘附,而研究发现一些食品成分正好具备抗微生物粘附的活性[4]。对于食品及人体肠道中有益微生物而言,其粘附现象是有益的。乳酸菌在乳品基质中并非均匀分布,其空间分布受其与乳品中特定组分相互作用强度的影响。食品级乳酸菌鼠李糖乳杆菌(Lactobacillus rhamnosus)GG 能与β-乳球蛋白特异性结合,其结合强度受细胞表面组成成分[5]及环境pH[6]等因素的影响。在人体肠道黏膜,为更好发挥益生菌的益生作用,其粘附及定植一直以来都是研究的热点和难点[7]。采用生物活性成分或其它食品组分减弱或抑制致病微生物在胃、 肠道上皮上粘附定植是防治感染的有效措施[8]。研究表明,微生物能与多糖材料发生广泛的相互作用[9]。本文就微生物与淀粉相互作用的规律和机制进行综述,归纳二者结合作用在淀粉分离纯化、病原菌清除、益生菌包埋与保护、 淀粉基益生元及合生元加工制造等方面的应用,旨在为后续研究提供参考。
1 微生物在淀粉颗粒上的粘附现象
我国关于微生物粘附淀粉的报道最早见于酸浆法提取淀粉[13]。在传统粉丝加工工艺中,人们发现酸浆(淀粉乳自然发酵产生的酸性浆液,含有活的微生物)具有凝集淀粉颗粒的作用。1974年,北京市粉丝厂和北京大学生物系研究指出酸浆中的乳酸乳球菌(Streptococcus lactis)是对加速淀粉沉降起主要作用的因素[13]。酸浆微生物不仅对豆类淀粉具有絮凝作用,对薯类淀粉(甘薯、木薯)、粮谷类淀粉等也有粘附作用。张莉力等[14]从自然发酵甘薯酸浆中筛选到对甘薯淀粉具有高絮凝活性的乳酸菌L1,经鉴定该菌为副干酪乳杆菌副干酪亚种(Lactobacillus paracasei subsp.paracasei)。该菌为革兰氏阳性,菌落表面光滑,颜色为乳白色。Ampe 等[15]在发酵木薯淀粉中发现了对木薯淀粉具有粘附能力的乳酸细菌(图1a)。Selem 等[16]以大米淀粉为原料,通过普鲁兰酶脱枝、热压及反复冻融处理制备抗性大米淀粉,并从酸奶、香蕉及人乳中分离得到对抗性大米淀粉具有粘附能力的39株乳酸菌,其中有2 株表现出较强的粘附能力(粘附率分别为79%和77%),另有6 株具有中等强度的粘附能力(粘附率40%~70%)。Crittenden 等[17]考察了19 株双歧杆菌对马铃薯、玉米、燕麦和大麦淀粉颗粒的粘附作用,结果表明:粘附具有一定的种属特异性,其中青春双岐杆菌(Bifidobacterium.adolescentis)VTT E-001561在玉米淀粉Hylon VII上粘附最强。两株双歧杆菌在高直链玉米淀粉颗粒上的粘附分别如图1b和c所示。图1d展示了植物乳杆菌在多孔玉米淀粉上的粘附。目前发现的微生物-淀粉相互作用情况汇总于表1。

图1 微生物粘附淀粉的显微镜照片Fig.1 Micrographs of microorganisms adhered to starch samples

表1 已报道的具有粘附淀粉能力的微生物Table 1 Microorganisms showing adhesion capability towards starch granules
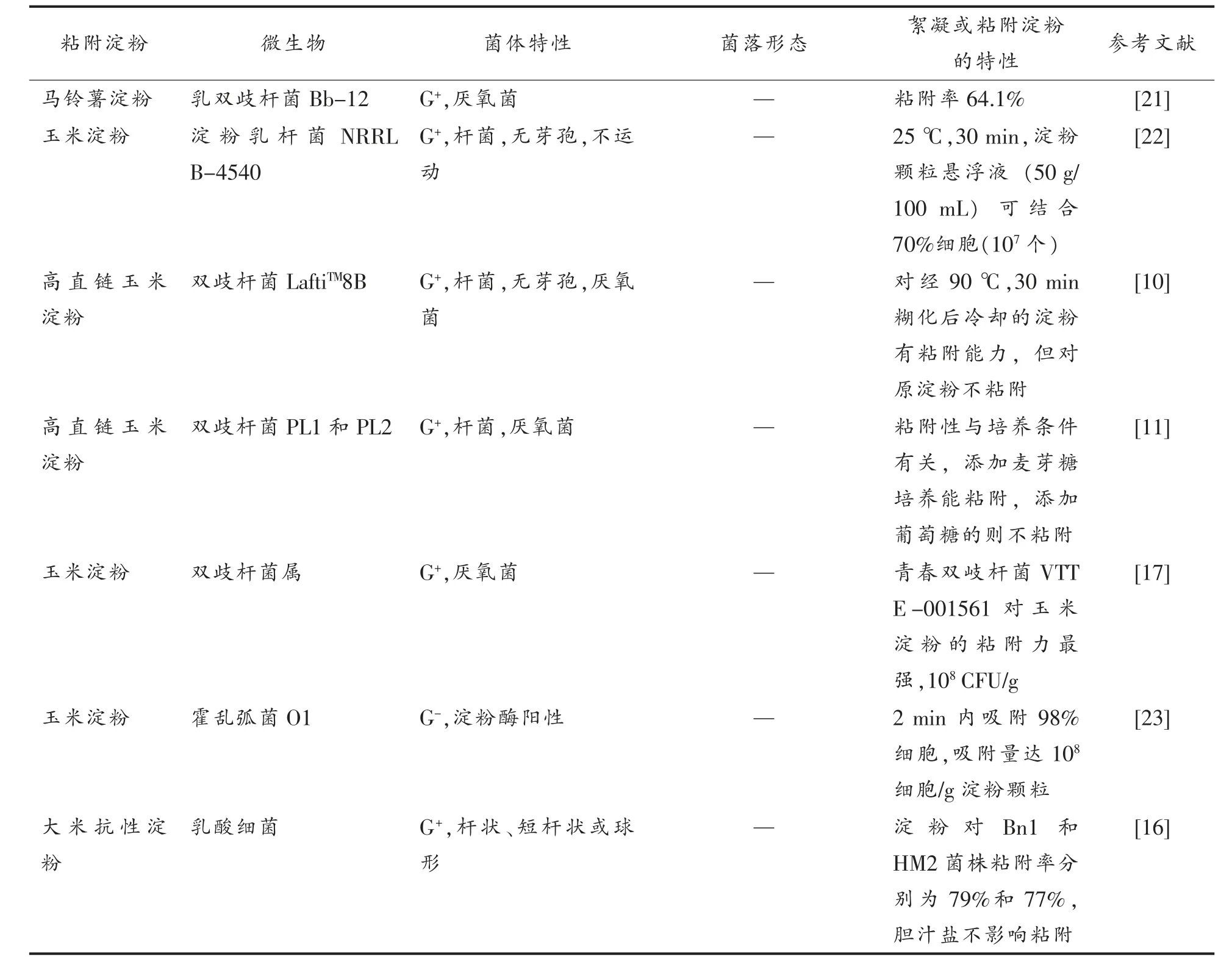
(续表1)
2 影响微生物与淀粉结合的因素
2.1 微生物生理、生化特性的影响
微生物生理、 生化特征是影响其与淀粉结合的重要因素。从表1可知,目前发现能与淀粉颗粒结合的主要为乳酸菌和双歧杆菌,均属于革兰氏阳性菌。研究表明,能否产生淀粉酶,虽然并非为与淀粉颗粒结合所必需,但结合能力强的细菌都具有产淀粉酶的能力[17,23]。吴企禾[24]研究认为,在甘薯酸浆自然发酵过程中,细菌种类呈动态变化,在发酵中期明串珠菌属占优势且为絮凝作用菌。对纯培养微生物而言,微生物在其生长的各阶段粘附淀粉颗粒的能力变化不显著[17]。
2.2 淀粉颗粒特性的影响
淀粉颗粒的来源、化学组成、颗粒大小及表面特性是影响微生物结合的重要因素。对于霍乱弧菌(Vibrio cholerae)O1 而言,大米淀粉、高直链玉米淀粉、 蜡质玉米淀粉和普通玉米淀粉颗粒对其的结合量无显著差异,并显著高于小麦淀粉和可溶性马铃薯淀粉,其结合量主要决定于淀粉的来源和化学组成,这是因为这些淀粉样品在粒度和比表面积等方面不存在重大差异[23]。另有研究[17]指出,对于双歧杆菌而言,淀粉颗粒比表面积大小与其结合量呈正相关(r=0.865),玉米淀粉Hylon VII因比表面积大而结合能力强,对假长双歧杆菌(B.pseudolongum)ATCC 25526 和青春双岐杆菌VTT E-001561 的结合量在108细胞/g 水平,相比之下,马铃薯淀粉、 大麦及燕麦淀粉颗粒因比表面积较小,其结合量相应降低;该研究还发现Hylon VII经胃蛋白酶处理后不影响粘附,由此排除了淀粉颗粒表面结合区域的蛋白质属性[17]。
2.3 外界环境条件的影响
2.3.1 温度 早期解析酸浆沉淀淀粉原理的文献[13]指出,在5~45 ℃范围,随着温度升高,活菌絮凝淀粉的速率逐渐增大,然而温度达到一定值后继续升高温度会导致菌体死亡时,絮凝淀粉的活性丧失。李新华等[25]研究发现,在30~90 ℃范围,副干酪乳杆菌对甘薯淀粉的絮凝率随温度的升高快速降低,50 ℃时絮凝活性几乎消失。Crittenden等[17]的研究则表明,青春双岐杆菌VTT E-001561经热致死(65 ℃、30 min)处理后,其对Hylon VII的粘附量与活菌相比无显著差异。
2.3.2 pH 值 pH 值是影响微生物对淀粉絮凝活性的重要因素。北京粉丝厂及北大生物系酸浆研究小组[13]研究指出,pH 6.0~6.2 范围最适合,当pH 值小于5.5 或大于8.5 则丧失絮凝活性。Crittenden 等[17]研究发现不同双歧杆菌对淀粉的粘附能力表现出不同的pH 敏感性,在pH 2~8 范围,青春双岐杆菌VTT E-001561、 假长双歧杆菌ATCC 25526 及短双歧杆菌CIP 64.48 在Hylon VII 的粘附能力随pH 值增加而增加,而乳双歧杆菌DSM 10140 则随之减小。
2.3.3 离子种类及离子强度 溶液中的离子对酸浆中微生物发挥絮凝活性有一定作用。对于乳酸链球菌,一定浓度的碱土金属离子(Ca2+、Mg2+)对絮凝活性是必需的,而碱金属离子(K+、Na+)及重金属离子则无作用[26]。研究发现,添加0.5 mol/L NaCl 对青春双岐杆菌VTT E-001561 在Hylon VII 的粘附能力无影响[17];添加0.111 mol/L NaCl对霍乱弧菌O1 在普通玉米淀粉颗粒上的粘附无影响[23]。
2.3.4 变性剂及其它化学试剂 O′riordan 等[11]研究发现,双歧杆菌PL2 经曲拉通X-100(1%,体积分数)或高碘酸钠(0.05 mol/L)溶液处理后,对高直链玉米淀粉的粘附能力未受到影响;郑玮等[27]研究表明高碘酸钠(0.3 mol/L)或三氯乙酸(3%)处理能够降低两株淀粉凝集菌对绿豆淀粉的絮凝活性。Crittenden 等[17]研究表明添加吐温80(3.0 g/L)不影响青春双岐杆菌VTT E-001561 在Hylon VII 的粘附。有趣的是,淀粉水解产物(葡萄糖、麦芽糖、麦芽糊精等)能显著抑制双歧杆菌在Hylon VII 的粘附,且抑制程度随着水解产物聚合度的增加而增加,而其它含葡萄糖结构单元又非淀粉水解物的其它糖类(如纤维二糖、海藻糖、乳糖)却无抑制效应[17]。Gancz 等[23]同样观察到糖类物质能影响霍乱弧菌O1 在玉米淀粉颗粒上的粘附,其影响因糖的种类而异。只有被霍乱弧菌O1 发酵利用的糖类物质才能产生明显抑制效应,而不被利用的则无此效应。
2.3.5 外源酶 研究表明,添加蛋白酶制剂能大幅降低甚至消除微生物对淀粉颗粒的粘附能力。副干酪乳杆菌在经胰蛋白酶处理后,对甘薯浆液中淀粉絮凝的能力迅速降低[25]。双歧杆菌活菌经蛋白酶K 或胰蛋白酶处理,其粘附淀粉颗粒的能力大幅降低甚至消失[17]。
3 微生物对淀粉颗粒的结合机制
人们对微生物粘附淀粉颗粒相关机制的揭示,是从阐明多形拟杆菌 (Bacteroides thetaiotaomicron)如何利用淀粉开始的。多形拟杆菌是人类肠道中一类数量庞大的革兰氏阴性细菌,具有降解复杂碳水化合物的能力,其水解利用淀粉的生理、生化机制已基本明晰[28]。Anderson 等[29]研究发现,多形拟杆菌能以直链淀粉或支链淀粉为唯一碳源生长,其利用淀粉的物质基础主要包括细胞外膜上的淀粉结合位点和周质空间(也称壁膜间隙)的淀粉降解酶(而非胞外酶)。另外,还涉及位于细胞质的α-葡萄糖苷酶和麦芽糖酶。通过对淀粉进行14C 标记证实了多形拟杆菌能与其结合。研究指出,这种细胞外膜与淀粉的结合作用是该菌利用淀粉的第1 步且为利用淀粉的必需步骤(因为该菌的淀粉降解酶无法外分泌),其结合淀粉位点为淀粉结合蛋白,原因之一在于结合的饱和性,原因之二在于经蛋白酶K 处理后,结合能力显著下降[29]。通过基因敲除手段能使该菌丧失结合并利用淀粉的能力,进一步证实了发挥作用的物质基础是蛋白质[30]。Tancula 等[31]分离鉴定出3个外膜蛋白质(43,65 ku 和115.3 ku)和一个质膜蛋白质(80 ku),这些蛋白质的基因编码聚集在该菌染色质的一段长度8.5 kbp 序列中,其表达受到诱导物麦芽糖的影响。另外,还有两个不受麦芽糖调节的外膜蛋白质(32 ku 和50 ku),其基因编码位于一段长度7 kbp 的DNA 序列。后续研究解析了该菌与利用淀粉有关蛋白质的基因簇(cluster),由7 个结构基因(susA-G)和1 个调节基因(susR)组成,其中淀粉降解酶由susA、susB 和susG 基因编码,均不具备结合淀粉的能力;4 种外膜蛋白质由susC、susD、susE 和susF 编码,它们均检测不出酶活力,而都是与淀粉结合有关的蛋白质[32]。研究表明,基因susC 编码相对分子质量115.3 ku 的外膜蛋白质,它含有一段长度为20~39 个氨基酸残基的信号肽;该研究确认susC 不具有淀粉酶水解活性,而为该菌利用麦芽糖和淀粉所必需[33]。相对分子质量约62.8,42.7 ku 和52.1 ku 的外膜蛋白质分别由susD、susE 和susF 编码,其中蛋白质susC 和susD 是主要的淀粉结合蛋白,不可或缺。虽然susE 和susF 对结合淀粉的贡献不及susC 和susD 重要,但是它们可能通过形成表面受体复合物(surface receptor complex)协同发挥作用[34-35]。该研究组的后续研究确证了表面受体复合物的存在,在这个复合物中,其核心是彼此结合的susC和susD,而susE 和susF 是可有可无的组分[36]。
在酸浆法生产淀粉的研究中,多项研究结果表明微生物与淀粉颗粒的结合机制涉及特异性的细胞表面蛋白质[24,27,37-39]。O′riordan 等[11]研究指出,分离自人粪便中的双歧杆菌PL1 和PL2 能粘附于高直链玉米淀粉上,其物质基础是牢牢锚定在细胞壁上的蛋白质,这类蛋白质对蛋白酶敏感,蛋白酶K 处理后该菌粘附淀粉的能力丧失。研究还表明,该菌粘附淀粉的能力虽受麦芽糖或淀粉粒的诱导,但不受葡萄糖诱导,这表明粘附蛋白质的表达受调节基因的控制。Niderman-Meyer 等[40]研究发现,革兰氏阴性菌霍乱弧菌能够粘附在玉米淀粉颗粒上,其粘附主要是通过菌体表面的外膜联淀粉结合蛋白(outer membrane-associated starchbinding proteins)。
4 相关应用
4.1 酸浆微生物用于淀粉提取
酸浆法是制取粉丝加工用淀粉的传统方法。破碎甘薯或绿豆浆液自然发酵形成的酸浆传统上用于淀粉提取,酸浆中具有絮凝淀粉活性的微生物,可特异性结合到淀粉颗粒表面,造成淀粉絮凝沉降,加速与杂质分离。Zhang 等[41]采用16S rDNA技术从甘薯酸浆中鉴定出86 种细菌、20 种酵母菌和10 种霉菌,其中仅有8 种乳酸杆菌属的细菌具有絮凝淀粉活性,其中以副干酪乳杆菌副干酪亚种L1 菌株的絮凝活性最高。将该菌加入淀粉浆液后,引起淀粉絮凝(图2a),该菌以“锁链”状粘附在相邻淀粉颗粒表面,从而形成成团的聚集颗粒(图2b)。魏凤鸣等[26]报道在制取绿豆淀粉时,酸浆中絮凝活性微生物需达到3.91×106/mL,添加量一般为每百kg 绿豆添加2.0 kg 酸浆。杜连起等[42]报道乳链球菌(8.8×107/mL)和酵母菌(1.9×108/mL)混合处理具有协同作用,可加速甘薯淀粉沉降。汪龙飞[43]研究了海藻酸钠凝胶包埋乳酸链球菌沉淀绿豆淀粉的工艺,研究指出沉淀淀粉的主要方式为微生物从凝胶中渗漏出来与淀粉作用,同时细胞包埋产生的次级代谢物质对淀粉的沉淀也发挥了作用。张明等[44]从酸浆中分离纯化得到具有絮凝活性的副干酪乳杆菌L1,结果表明纯培养酸浆制备条件能显著影响该菌絮凝淀粉的活性[45]。
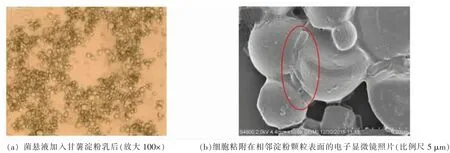
图2 甘薯淀粉浆液在添加副干酪乳杆菌副干酪亚种L1 菌悬液产生聚集的光学显微镜及扫描电镜照片Fig.2 Optical micrograph and SEM image of starch granule aggregation after the addition of L.paracasei subsp.paracasei L1 cultures to sweet potato starch milk
4.2 淀粉基益生菌包埋载体
益生菌是活的微生物制剂,如何将其以活体形态加工贮藏并递送到人体肠道相应部位是具有挑战性的技术难题[46-48]。淀粉是人体肠道有益微生物发酵的碳水化合物的来源[49]。研究发现[50],生产淀粉降解酶来水解淀粉是双歧杆菌属(Bifidobacterium spp.)、拟杆菌属(Bacteroides spp.)、梭杆菌属 (Fusobacterium spp.)以及真杆菌(Eubacterium)、梭菌(Clostridium)、链球菌(Streptococcus)和丙酸杆菌(Propionibacterium)等人体肠道微生物利用淀粉的主要方式,并且双歧杆菌属和丁酸梭菌(Clostridium butyricum)能有效利用高直链玉米淀粉颗粒,在相应培养基中具有较快生长速率。鉴于淀粉对人体有益微生物的粘附和利用特性,其作为益生菌的包埋和保护的载体具有重要开发价值[17]。目前研究报道的淀粉基益生菌保护剂主要包括原淀粉颗粒、微孔淀粉、微胶囊、可食膜等形态,这方面的总结见表2。
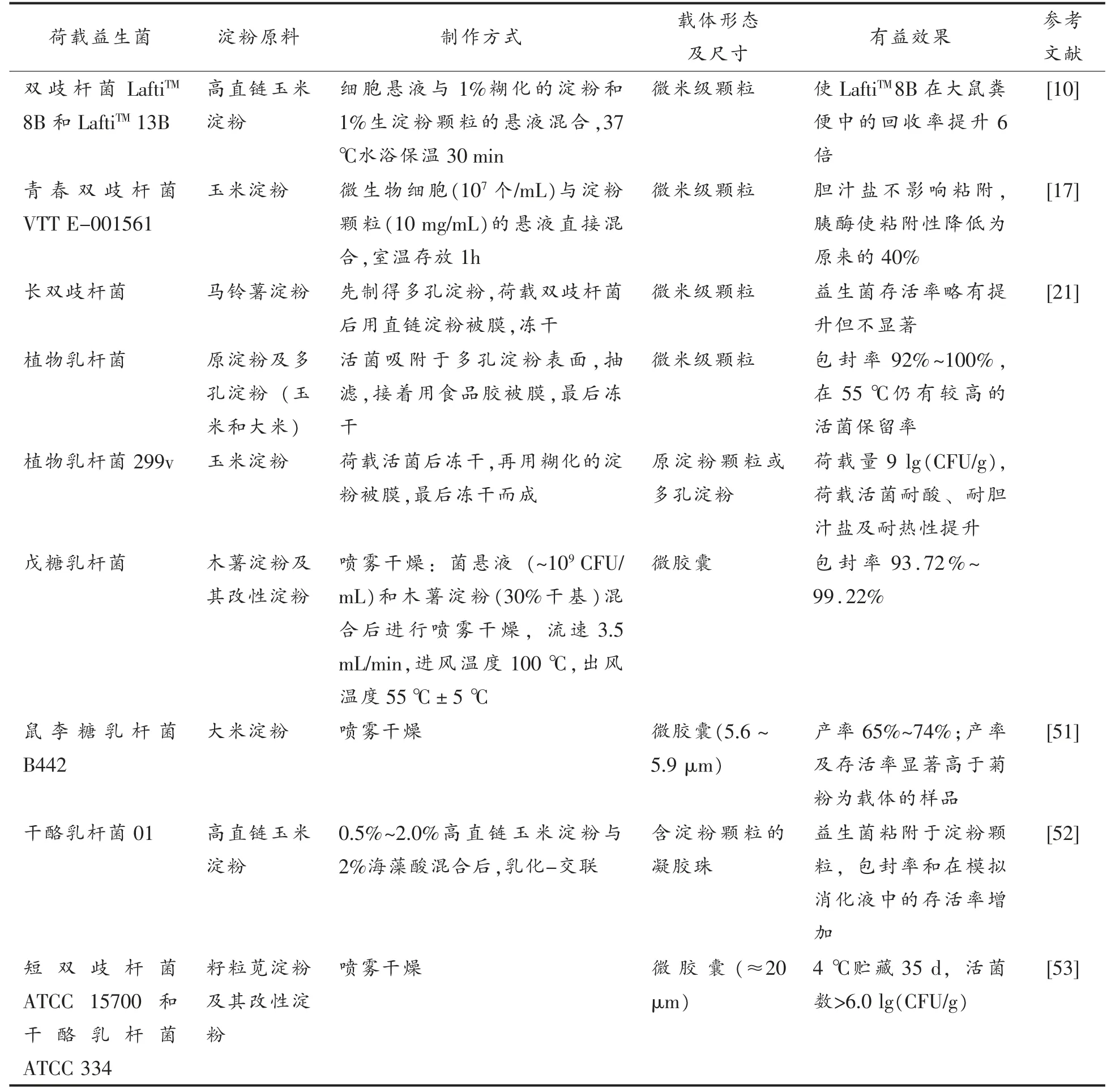
表2 淀粉基益生菌保护剂主要类型Table 2 Main types of starch-based probiotic protectants
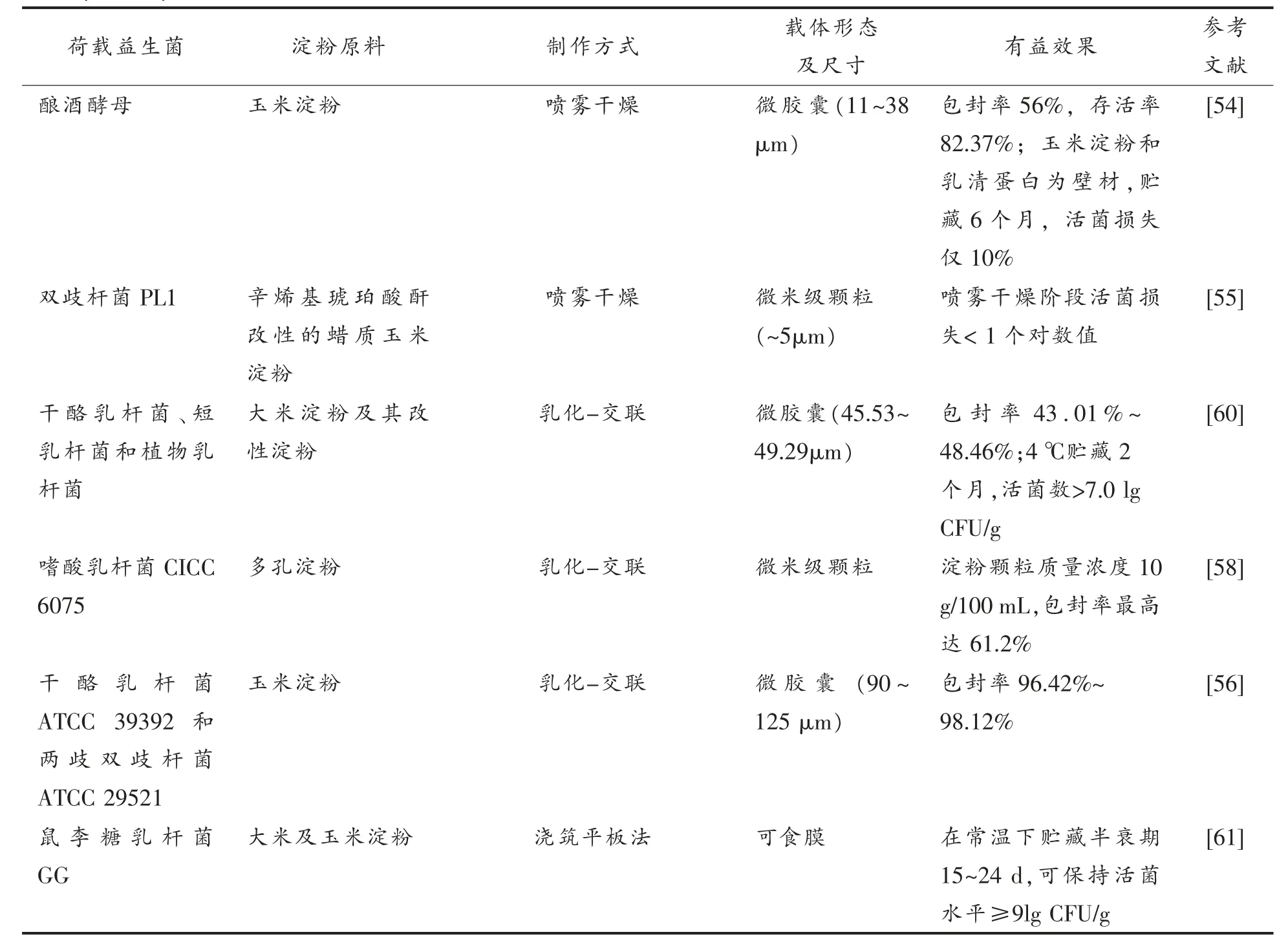
(续表2)
4.2.1 原淀粉颗粒 将微生物细胞悬液直接与生淀粉颗粒悬液混合,在室温或37 ℃条件下完成吸附,过滤掉上清,得到粘附了微生物的淀粉颗粒。研发发现,高直链玉米淀粉颗粒能显著提升双歧杆菌LaftiTM8B 和LaftiTM13B 经口进入小鼠肠道后的存活率[10]。
4.2.2 微孔淀粉 微孔淀粉因其多孔道和较大的比表面积,相比于原淀粉颗粒更具优势。Li 等[57]研究了玉米淀粉对植物乳杆菌的包埋,结果表明,采用原淀粉时,细胞粘附在淀粉颗粒表面,将玉米淀粉适度水解制得微孔淀粉后,细胞进入孔道内部,不仅包封率提高,而且细胞对酸、胆汁盐和热的耐受性得到增强。Xing 等[58]研究指出,当微孔淀粉质量浓度10 g/100 mL 时可获得最大包封率(61.2%),微孔淀粉浓度还会影响包封后细胞对酸和热的耐受性。Benavent-Gil 等[12]研究发现,将大米淀粉通过酶解加工成多孔淀粉,其对益生菌的包封率约增加10%,而玉米淀粉制备多孔淀粉后包封率的变化不大。将多孔淀粉荷载活菌后用糊化淀粉被膜,包封率(达92%~100%)和耐热性均明显提升。
4.2.3 微胶囊 微胶囊一般采用喷雾干燥法或乳化-交联法制备,其尺寸5~125 μm,将淀粉与活菌充分混合并封闭在微胶囊壁材中。Cruz-Benítez等[59]采用喷雾干燥法制备戊糖乳杆菌的微胶囊,结果普通木薯淀粉优于蜡质木薯淀粉(前者直链淀粉含量高),而经改性的木薯淀粉更适合作为壁材。相对于酸水解和辛烯基琥珀酸酐改性,蜡质木薯淀粉经酸水解和三聚磷酸钠反应、 两步改性后作为壁材,制得的微胶囊具有最大包封率(99.22%)。Ashwar 等[60]以大米淀粉为原料自制的RS4 抗性淀粉为材料,与益生菌(干酪乳杆菌、短乳杆菌和植物乳杆菌)的细胞混合制备悬液,采用吐温80 乳化(1 500 r/min,10 min)制成乳状液,将乳状液滴加到CaCl2溶液(0.1 mol/L)中交联固化,最后冻干制得微胶囊。荷载微生物在模拟胃、肠液中存活良好【7.29~8.61 lg(CFU/g)】,在4 ℃贮藏2个月活菌量基本不损失。
4.2.4 可食膜 可食膜是以多糖、 蛋白质等食品大分子为主要成膜基质,添加可食性助剂(交联剂或增塑剂),人工制备而成的薄膜结构材料。其成膜方式有干法或湿法两种。可食膜一般以包裹、涂布、浸渍或喷洒等形式覆盖于食品表面,用于保持或改善食品品质。最近,可食膜被用于荷载益生菌。Soukoulis 等[61]以大米及玉米淀粉为成膜材料,采用浇筑平板法制备包埋了鼠李糖乳杆菌(Lactobacillus rhamnosus)GG 的可食膜,在常温下贮藏半衰期为15~24 d,可保持活菌水平≥9 lg(CFU/g)。
4.3 淀粉颗粒作为病原菌吸附材料
Gancz 等[23]研究发现将生玉米淀粉颗粒添加到治疗腹泻的口服补水液中,生玉米淀粉颗粒具有对病原菌霍乱弧菌极佳的吸附能力,可在2 min 内吸附98%的病原菌细胞,其吸附量达到108细胞/g 淀粉颗粒。
4.4 其它应用
微生物来源的有些(约占10%)淀粉水解酶除有1 个催化域(catalytic domain)外,一般还有1个或以上的淀粉结合域 (starch-binding domain,SBD),这些区域不具备催化活性,而能与生淀粉颗粒或淀粉分子相结合,起到加速淀粉水解的作用[62]。有证据表明SBD 可以保持相对独立的功能,运用基因工程手段可将其整合到其它蛋白质中发挥作用。根据这一性质,至少产生3 个潜在应用,其一,通过遗传学手段,将SBD 融合到淀粉合成酶系中,从生物合成途径调整淀粉合成方式,从而得到遗传改性淀粉颗粒[63-64];其二,将SBD 整合到益生菌外膜蛋白质中,由此赋予或提升这些益生菌粘附和利用抗性淀粉的能力[65];其三,可利用淀粉颗粒作为亲和吸附或定向锚定材料,用于分离纯化或固定化带有SBD 标签的蛋白质[66]。例如,将SBD 融合到β-半乳糖苷酶中并在大肠杆菌中表达,在淀粉柱中进行分离纯化,其提纯效果甚至优于传统的亲和色谱[67]。
5 结语
综上所述,淀粉对微生物结合作用的研究近年来取得显著进展,尤其在酸浆微生物凝集淀粉以及淀粉作为益生菌保护剂或载体方面备受关注。基于当前研究现状,淀粉对微生物结合作用的研究需从以下方面加强:1)酸浆中具有絮凝淀粉活性的微生物的分离鉴定,这为酸浆法制取淀粉从经验走向科学奠定基础,同时筛选出优势菌株,探索其与淀粉结合的机制和其影响淀粉加工特性的有关规律,为进一步开展其工业应用铺平道路。2)人体肠道有益微生物在淀粉颗粒表面粘附、定植以及对淀粉降解代谢的过程机制研究。3)淀粉基益生元(抗性淀粉)理性设计和制造。4)淀粉基合生元产品开发。一方面,探究淀粉结构特征对其作为益生菌保护剂或载体的影响机制,设计出优良的淀粉载体;另一方面,提供遗传学手段提升益生菌粘附或利用淀粉的能力[68],为淀粉基合生元产品的研制奠定基础。
