血清与脑脊液炎症标记物及WBC计数在神经外科术后颅内感染的诊断价值
2019-05-18张二辉王玉珍高海波张春民方树民
张二辉 白 奎 王玉珍 高海波 张春民 杨 超 方树民
河南大学第一附属医院 1)重症医学科 2)神经外科,河南 开封 475000
颅内感染是神经外科手术后常见的严重并发症之一,治疗相当棘手,对患者的预后有着重要的影响,诊断与治疗不及时可能导致患者神经功能不可逆损害,给患者及家属带来严重的负担,让患者承受巨大的身体心理创伤以及高昂医疗花费[1-3]。术后并发颅内感染主要发生于去骨瓣开颅术后、侧脑室穿刺引流术后、颅脑严重外伤、CSF耳漏鼻漏等,重型颅脑损伤(Severe head injury,SHI)术后昏迷患者大部分存在早期免疫功能缺陷或异常也是并发颅内感染因素之一[4]。神经外科术后发生的颅内感染多考虑为细菌性脑膜炎、脑室炎,发生率约2.6%[5],病毒性或结核性颅内感染发生率低。脑脊液(cerebrospinal fluid,CSF)的细菌学培养是目前诊断颅内感染的“金标准”,指导抗菌药物合理应用有重要价值,但此项操作存在培养时间长、阳性检出率偏低等多种弊端,导致延误颅内感染诊断及特异性抗菌治疗,增加患者的病死率,严重影响患者预后。降钙素原(procalcitonin,PCT)是一个近来发现的炎症细胞因子,在诊断机体细菌性感染方面,显示出较高的灵敏度与特异度,较传统炎症因子有更大的诊断价值。在神经系统疾病方面,大多数研究在探讨CSF和血清中PCT水平测定在细菌性、病毒性、结核性、真菌性脑膜炎等诊断及鉴别诊断中的临床意义,多建议PCT可以用于细菌性颅内感染的早期诊断中,并且可以有效地区分细菌性和非细菌性颅内感染[6],PCT水平动态变化指导抗菌药物有参考意义,针对探讨神经外科术后并发的颅内感染的文献较少。本研究选择2013-01—2016-06到河南大学第一附属医院行颅脑手术的70例患者为研究对象,探讨血清与脑脊液炎症标记物(PCT、CRP)及WBC计数在神经外科术后颅内感染的检测诊断价值。
1 资料与方法
1.1一般资料选择2013-01—2016-06到河南大学第一附属医院行颅脑手术的70例患者为研究对象 经临床诊断和病理实验检查,患者确诊,符合行颅脑手术指征。该研究通过我院伦理委员会审查并同意执行,患者家属被告知同意并签署知情同意书。入选标准:(1)年龄≥18岁;(2)没有术后并发肺部感染、泌尿系等感染者;(3)符合我国卫生部于2005年制定的《医院感染诊断标准(试行)》执行[7-8]中对于颅内感染的诊断标准;(4)手术后患者生存时间>1周。排除标准:(1)合并急性脑卒中、肺栓塞、心力衰竭、肝肾衰竭等;(2)癌症终末期;(3)哺乳期及妊娠期妇女;(4)入院前1周内有细菌感染疾病、慢性疾病(如慢性腹泻、糖尿病、COPD、慢性肾炎、慢性尿路感染、类风湿性关节炎、SLE、甲亢或甲减等);全身严重多发伤、(5)长期使用激素或免疫抑制剂等情况。术后颅内感染的诊断标准是:(1)临床症状:术后体温持续升高(排除其他病因),且脑膜刺激征(+)。(2)脑脊液常规生化检查提示:脑脊液浑浊,WBC>10×106/L,蛋白定量>0.45g/L,糖定量<2.25 mmol/L,氯化物<120 mmol/L。(3)连续两次脑脊液培养呈阳性并且确定为同一菌株。凡具备第(3)条标准者即可以诊断为颅内感染(金标准),如果CSF培养阴性者则需同时具备(1)(2),否则应结合病情作全面综合评价。将其中35例术后颅内感染者作为研究组,另选术后未出现颅内感染者35例作为对照组。颅内感染组(研究组):自发性脑出血(spontaneous cerebral hemorrhage,SCH)18例(51.4%),重型颅脑损伤(severe head injury,SHI)10例(28.6%),颅内肿瘤占位7例(31.4%)(20.0%);男24例(68.6%),女11例(31.4%);年龄18~83岁,平均48.9岁。非颅内感染组(对照组):自发性脑出血17例(48.6%),重型颅脑损伤11例(31.4%),颅内肿瘤7例(20.0%);男24例(68.6%),女11例(31.4%)。2组年龄、性别等比较无统计学意义(P>0.05),具有可比性。
所有入选患者均按照临床神经系统疾病诊断及治疗常规进行检查及治疗,给予明确诊断及病理类型,积极完善术前检查、外科手术治疗、甘露醇及人血白蛋白脱水降颅压、脑保护治疗、液体复苏、机械辅助通气、控制血压及血糖、止血药物应用、清创缝合、维持内环境稳定及水电解质平衡、肠内外营养支持、气管插管、必要时气管切开治疗、定期换药处理、引流管引流及血肿腔注射尿激酶、预防相关并发症(应激性溃疡、继发性癫痫、坠积性肺炎、压疮、下肢深静脉血栓形成等)等。手术方式根据不同的疾病,选择不同手术方式,如去骨瓣减压术、侧脑室引流术、颅内血肿清除术、动脉瘤夹闭术,颅内占位切除术、腰大池穿刺置管引流术等。
1.2方法
1.2.1 标本采集:CSF标本通过下列途径方式获得:①腰椎穿刺抽液(38例,每组19例);②腰大池穿刺置管持续引流(16例,每组8例);③侧脑室穿刺置管后外持续引流(床旁及手术室全麻下)(12例,每组6例);④全麻下脑室镜检查(4例,每组2例)。CSF标本采集要求:①为无菌操作下获取,减少污染可能;②未做CSF置换操作,置换后对CSF的检测结果有干扰及严重影响;③留置如有引流管(血肿腔、脑室等),要求先排尽引流管死腔内CSF然后留取标本,由于死腔标本受到外界干扰污染可能性高,影响颅内感染的诊断。CSF标本送常规检查、生化(蛋白、糖及氯化物定量)、细菌学培养、PCT、CRP检查,同时常规外周静脉采血送检血液标本,血液标本检测血常规、PCT、CRP。
1.2.2 检测方法及仪器:PCT采用罗氏全自动电化学发光免疫分析仪及配套试剂进行测定;CRP通过西门子全自动生化分析仪及配套试剂进行测定;脑脊液白细胞数采用血球计数板显微镜下进行白细胞计数,血WBC计数通过血常规仪器检测。以上检测均由我院检验科人员严格按照实验室标准操作规程完成检测,所需仪器设备定期进行校准、维护、保养,参数符合要求。正常参考值:血清PCT<0.5 μg/L,血清CRP≤10 mg/L,血WBC计数4.0~10×109/L,CSF的细胞计数0~8×106/L,CSF的C反应蛋白0.42~5.2 μg/mL。

2 结果
2.12组CSF血清PCT、CRP、WBC计数对比颅内感染研究组CSF与血清PCT、CRP、WBC计数均较对照组中PCT、CRP、WBC计数显著升高,有显著性差异(P<0.05)。脑脊液PCT与血清中PCT水平较正常值升高明显,但无显著性差异(P>0.05)。见表1。
2.2脑脊液和血液PCT、CRP及白细胞计数的灵敏度及特异度脑脊液和血液PCT,脑脊液白细胞计数都有较高灵敏度与特异度。脑脊液及血液CRP在诊断颅内感染中灵敏度较高,但特异性较低。见表2。
3 讨论
神经外科术后颅内感染是临床以细菌性最为常见,多导致急性细菌性脑膜炎脑室炎和脑脓肿。许刚等[9]报道,神经外科手术后导致颅内感染的主要危险因素有下列几种:(1)手术时间较长,>4 h;(2)术后脑脊液漏;(3)有侧脑室外引流;(4)放置各种引流管;(5)合并糖尿病;(6)开放性颅脑损伤。虽然随着神经外科技术不断不断进步和无菌技术要求逐步提高,积极地预防并没有使发病率并无明显降低,术后颅内感染仍偶有发生。尽量手术室条件提高,无菌理念增强,减少手术时间,严密缝合防止脑脊液漏,提高手术技巧,减少侧脑室外置管引流时间,一般小于7 d,换药处理及时,减少各种引流管的放置并尽量缩短引流管置管时间等等,对减少并预防神经外科手术后并发颅外及颅内感染的发生都有积极的作用,以预防理念为主。目前临床上诊断颅内感染的流程一般为对颅内感染疑似病例进行脑脊液常规、生化检查,以及行病原学培养后确诊,但此类患者一般伴有严重颅脑损伤,血液进入脑脊液后常规及生化的指标无特异性。细菌学培养检验颅内感染非常准确,为临床颅内感染诊断的金标准,但该操作需要一定的时间,阳性率较低,而感染的控制刻不容缓,如不及时治疗,病死率可能增加[10]。找寻快捷、敏感的血清及脑脊液的炎症标志物,对神经外科术后颅内感染的早期诊断,判断预后,降低病死率有重要的临床意义。
外周血白细胞计数及分类可一定程度上鉴别细菌 、真菌及病毒感染,但特异性和敏感性差。此类患者经常有脑出血破入脑室情况,影响脑脊液WBC计数,对诊断颅内感染有负面影响。C反应蛋白参与机体局部或全身炎性反应(systemic inflammatory response,),健康状态下机体中有微量的存在,只有当机体遭遇炎症、急性创伤或感染等时,血清中CRP浓度可短时间内上升,CRP是目前临床上常用的急性时相炎症反应指标。由于CRP是机体对各种炎症或任何组织损伤的一种急性时相反应蛋白,当机体存在其他部位的细菌性感染(如皮肤、肺部、消化道、泌尿系、肝胆系等)和某些非感染性疾病(如系统性红斑狼疮SLE、风湿热、类风湿性关节炎RA、恶性肿瘤等)时,血中CRP浓度也会升高,因此血清中CRP水平检测敏感度较高,其特异度不高[11-13]。CRP对其他感染性疾病也都比较敏感,机体感染后其水平会迅速升高,且通过血-脑脊液屏障进入脑脊液,因此脑脊液CRP检测特异度也不高[14]。

表1 2组脑脊液和血液PCT、CRP及白细胞计数水平比较
注:B-PCT=血清降钙素原,C-PCT=脑脊液降钙素原,B-CRP =血清C反应蛋白,C-CRP=脑脊液C反应蛋白,B-WBC计数=血清白细胞计数,C-细胞计数=脑脊液细胞计数
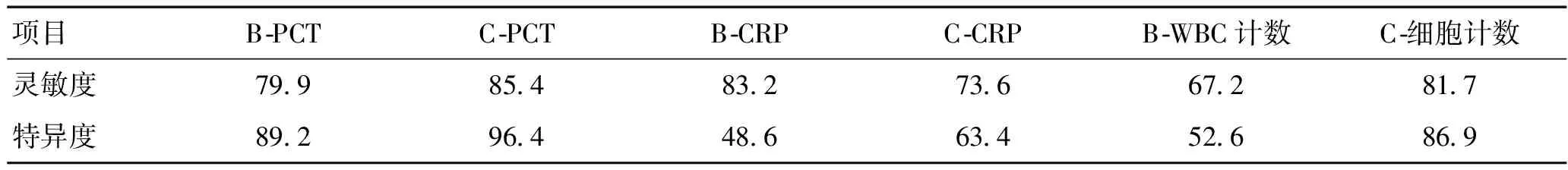
表2 脑脊液和血液PCT、CRP及白细胞计数灵敏度及特异度
PCT是一种由甲状腺细胞分泌的一无激素活性的糖蛋白,由116个氨基酸组成,分子量为13 kDa,通过水解酶水解后形成活体成分,健康人血清含量极低(<0.1 ng/mL),同时PCT半衰期长达 25~30 h,体外有强的稳定性,检测方法相对简单、方便、快捷、可靠、耗时短[15]。 PCT近来受到临床医师的广泛持续关注,研究发现只有当机体遭遇全身性细菌感染时血清PCT浓度明显升高[16-17];同时当机体病毒感染时,即使是严重的病毒感染,血清PCT浓度也可正常或只轻微升高;因此PCT对于细菌性感染性疾病有早期诊断价值,在感染严重程度、治疗效果判断、疾病预后的分析评价及抗菌药物的合理使用及调整方面成为近年来临床医师检验师及药剂师们的研究热点,PCT已经被认为是一个具有创新意义的全身细菌感染炎症诊断指标[18-23]。2012年中国急诊医学专家达成了降钙素原(PCT)急诊临床应用的专家共识[24],专家共识明确指出,PCT水平监测可临床应用于急诊常见感染性疾病尤其是脓毒症(sepsis)的诊断,并可指导抗菌药物的使用及判断预后。李建民等[25]研究报告指出,以血清PCT 0.05~0.50 ng/mL 为阈值,可有效区别细菌性脑膜炎与其他类型颅内感染,对于颅内感染的早期鉴别诊断及治疗策略的制定与实施均有着良好指导作用。国内外的多项研究均表明高水平的血清PCT被认为是早期鉴别诊断细菌性脑膜炎和病毒性脑膜炎最独立生物学预测指标[26],血清PCT对颅内感染的临床诊断具有重要意义。PCT由于分子量较大,如果颅内感染程度较轻或者不十分严重,血-脑脊液屏障(blood cerebrospinal fluid barrier)不会受到破坏,PCT将无法通过此屏障进入脑脊液。对神经外科术后颅内感染患者的脑脊液PCT水平的研究项目目前偏少,脑脊液PCT水平高低在颅内感染患者中的表达国内外的研究结果也不尽相同。脑脊液中PCT的阳性阈值目前尚无定论,文献[27]报道,脑脊液PCT 0.5 ng/mL为阈值是中枢神经系统细菌感染的可靠指标。国内周振军等研究报告中指出,对于颅内感染的诊断,脑脊液PCT水平相对脑脊液WBC计数及血清PCT水平具有更高的敏感性和特异性,有较好的临床应用前景,是诊断开颅术后颅内感染的最佳参考指标[28]。邓水香等[29]指出,动态监测血PCT水平可以作为判断单纯脑外伤患者病情及预后的有效指标。于湘友[30-33]等的研究中提示,PCT+CRP+ESR三者联合检测在神经外科术后颅内感染的诊断、临床监测、抗菌药物评估疗效及调整应用、预后判断等方面有一定的临床指导价值。神经外科颅内感染在术后早期PCT的检测比ESR、CRP都更有意义[34-41]。
本次研究中颅内感染组CSF中PCT水平、血清PCT水平及CSF中WBC计数均显著高于非感染组(P<0.05);脑脊液PCT水平和血清PCT水平、脑脊液WBC计数呈显著正相关,而与血液WBC计数无明显相关性,提示脑脊液PCT水平、血清PCT水平及脑脊液WBC计数是诊断术后颅内感染的较好指标。由于受到样本量多少、实验条件等多重因素的限制,笔者的实验结果可能有一定的偏差。在神经外科术后颅内感染的诊断及鉴别诊断中,脑脊液常规、生化、细菌培养、PCT、CRP及血常规、PCT、CRP等检测,有重要的诊断价值。但仅仅依靠1~2个炎症指标作出结论或诊断,有一定局限性,还要参考患者的史、症状、体征等,结合实验室辅助检查,综合分析判断。PCT水平的动态变化,对于指导抗生素应用及判断感染控制情况有重要的参考意义。笔者考虑脑脊液PCT水平、血清PCT水平及脑脊液WBC计数三者有更高灵敏性及特异性,是诊断神经外科术后并发颅内感染的最佳参考指标。
