hnRNPD在神经发育过程中的作用
2019-05-18孔祥东
代 鹏 孔祥东
郑州大学第一附属医院遗传与产前诊断中心,郑州 河南 450052
基因表达调控对生物体的生长发育以便适应生存环境变化至关重要。在真核细胞中,mRNA的稳定性及其正确调控表达是细胞对外界刺激作出应答的重要基础。稳定的mRNA参与调节许多原癌基因和细胞因子,以确保其正确表达,但是在疾病中的异常调控就会导致癌症、慢性炎症、心脑血管疾病等的发生[1-3]。hnRNPD(heterogeneous nuclear ribonucleoprotein D)又称AUF1,是核不均一核糖核蛋白(hnRNPs)家族成员之一,具有介导相关mRNA衰变及增强某些mRNA稳定的双重调节功能,精确而快速调控基因表达,激活相关信号通路,在DNA修复、RNA剪接、稳定端粒等许多方面发挥重要作用[4-5]。研究表明,hnRNPD是多种生物学途径的中枢调节因子,参与炎症、癌症、心血管疾病、衰老和病毒感染等多种疾病发生发展[6-7]。研究显示,hnRNPD在神经发育过程中特异性表达,调控相关基因表达参与神经元等分化成熟以及相关疾病的发生发展,但其作用机制不详。现将hnRNPD在神经发育和参与疾病中的作用及可能调控机制作一综述。
1 hnRNPD概述
hnRNPD是核不均一核糖核蛋白(hnRNPs)家族成员之一,编码基因位于4号染色体(4q21),包含10个外显子,通过可变剪接产生4个亚型(p37AUF1、p40AUF1、p42AUF1和p45AUF1)[6-8]。在大多数细胞中,p37AUF1和p40 AUF1可以在细胞核和细胞质自由穿梭,p42AUF1和p45AUF1主要分布在细胞核[6-7]。
位于基因3’端非翻译区富含A、U元件(如AUUUA)是转录后水平调节mRNA稳定性的元素之一。它兼具介导相关mRNA衰变及增强某些mRNA稳定性的作用,腺嘌呤和尿嘧啶元件(adenosine and uridine rich elements,AREs)结合蛋白在此过程中发挥关键作用。hnRNPD是被最早纯化和克隆的AREs结合蛋白(ARE-binding proteins,ARE-BPs),通过识别和结合ARE元件,在DNA修复、RNA剪接、端粒延长等许多方面发挥重要作用[6,11]。除与RNA结合外,hnRNPD对DNA中富含G链的重复序列具有高度亲和性,进而调控一些DNA参与基因表达[11]。AUF1在不同RNA上发挥独特功能可能与RNA序列、局部RNA结构环境、蛋白转译后修饰、协作性RNA结合蛋白、microRNA以及竞争性反式因子相关[7,12]。YOON等[13]利用光活性增强核糖核苷交联和免疫共沉淀(PAR-CLIP)技术揭示了hnRNPD能够结合大量富含U-/GU的序列,调控编码基因和非编码基因(如microRNA、lncRNA)表达,参与细胞增殖、分化、衰老、免疫和应急反应。hnRNPD介导相关mRNA衰变或稳定的机制还不太清楚,需要深入探索,但初步研究表明,hnRNPD在含有ARE序列的基因上形成大的多亚单位复合物,包括hnRNPD以及由帽子结构依赖的翻译起始因子和热休克伴侣蛋白所组成的信号转导调控复合物(ASTRC)介导相关mRNA衰变或稳定。
作为基因转录表达的重要调控因子,hnRNPD具有双重调节功能,精确而快速调控基因表达水平,激活相关信号通路。若细胞中hnRNPD基因表达异常将会影响其下游大量基因的表达水平,从而介导多种疾病的发生与发展,如炎症、癌症、心血管疾病和病毒感染[14-18]。
2 hnRNPD基因敲除鼠
hnRNPD基因敲除鼠揭示了hnRNPD对众多生物学通路具有中心调节作用[6]。小鼠在hnRNPD缺失后会表现出具有组织、细胞或者环境特异性的复杂表型[6]。许多情况下表型的复杂性是在特定的组织背景下,不同hnRNPD亚型功能不同以及异常调节的mRNA参与众多不同的功能造成的[6,7]。
hnRNPD基因敲除小鼠发现hnRNPD在调节炎症反应中非常重要[19-21]。当受到内毒素侵害时,hnRNPD基因敲除鼠表现出严重的感染性休克症状,甚至出现器官衰竭和死亡,原因是hnRNPD纯合子缺失和无法削弱通过其诱导ARE-mRNA去稳定的增强而造成炎性细胞因子表达的结果[21],但杂合缺失hnRNPD敲除小鼠在受到内毒素刺激后表现为慢性内毒素血症但不会死亡,提示基因剂量在hnRNPD功能和单倍体缺失中的重要性。hnRNPD基因敲除鼠还表现出和成人银屑病类似的慢性异位性皮炎[20]。hnRNPD基因敲除鼠表现出发育落后、早衰和肿瘤等相关疾病,证明了hnRNPD在生长发育、维持端粒和肿瘤发生过程中发挥重要作用(图1)[19,21]。尽管hnRNPD被认为是炎症反应的弱化子,炎症反应与DNA损伤和细胞衰老相关联,但是单独这些无法解释基因敲除鼠复杂的早衰表型和发育落后。因此,hnRNPD缺失会造成人体严重而复杂的多种疾病和综合征。hnRNPD在人体和小鼠不同组织表达的相似性提示小鼠体内由于hnRNPD缺乏而导致的生理病理过程很有可能代表了人体的疾病情况[19],但需要进一步阐述hnRNPD在人体系统疾病过程中发挥的功能。
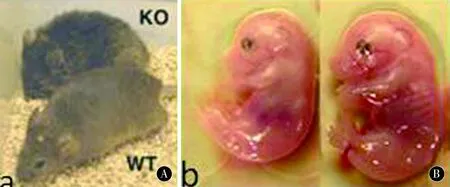
图1 hnRNPD基因敲除鼠表现发育落后的特征Figure1 Characteristics of hnRNPD knockout mice showing developmental backwardness
3 hnRNPD与神经发育
基因协调表达对机体正常发育至关重要,受遗传和表观遗传因素的影响,转录后调控是调节神经发育的关键控制点。相关文献报道hnRNPD异构体在整个神经发育过程中特异性表达[6,22]。hnRNPD异构体均在大脑发育过程中表达,其中p40AUF1和p42AUF1表达水平最高[23]。大鼠模型中,第14天的胚胎神经祖细胞中就能检测到hnRNPD,发育第18天的皮质所有细胞表达hnRNPD[24]。研究表明,hnRNPD在小脑形成过程中,p37AUF1、p40AUF1和p42AUF1的mRNA以及蛋白水平在小脑发育过程中基本保持不变,但p45AUF1逐渐增加。此外,所有hnRNPD异构体在出生后第2天(p2)稳定下降,最终在p28的脑中表达水平最低[22]。在大脑皮质发育过程中,hnRNPD表达于早期皮质神经形成,且主要位于脑室和脑下室壁区域。除了hnRNPD异构体及其表达模式在神经发育中发挥重要作用,hnRNPD表达受NMDA受体( N-甲基-D-天冬氨酸受体,N-methyl-D-aspartic acid receptor)激活的调控[25]。NMDA受体激活会导致一系列细胞内的级联效应,调控神经细胞存活、分化和可塑性。在小脑颗粒细胞中,NMDA受体的激活会导致AUF1异构体的蛋白质衰减和编码鸟苷酸环化酶α2亚基的mRNA增加,从而影响鸟苷酸环化酶的定位和神经元细胞的分化。
另有研究表明,hnRNPD能够与组蛋白脱乙酰化酶1(HDAC1)和转移相关蛋白2(MTA2)相互作用,通过招募染色质重塑分子结合到富含AU的DNA元件,调节神经元不同阶段的基因表达[24]。研究显示,hnRNPD异构体在调节脑啡肽(ENK)基因表达过程中发挥不同的功能,如大脑中只有p37AUF1、p40AUF1和p42AUF1可以结合富含AT的dsDNA进而调节ENK基因的细胞特异性表达[23]。hnRNPD在神经发育的研究主要集中在hnRNPD异构体在整个神经发育过程中特异性表达水平以及表达模式,而其表达水平和功能与神经元功能、表观遗传间关联性以及分子机制的研究报道甚少。
4 hnRNPD与4q21.2微缺失/微重复综合征
染色体4q21.2微缺失/微重复综合征是由4号染色体长臂中段1.35~20 Mb长度不等的缺失/重复,导致患者智力低下、发育迟缓、精神运动障碍、肌张力减退、面容畸形、语言障碍等临床表现的综合征[26-28]。1980年英国遗传学家MCDERMOTT首次描述了4号染色体长臂4q13-4q22区段缺失,临床表现为严重的生长迟缓、肌张力减低、发育迟缓和智力障碍[29]。智力障碍与发育迟缓在4q21缺失综合征的严重程度与染色体缺失的相对长度有关,患儿在生后往往因呼吸抑制、复杂先天性心脏病、心跳骤停等死亡[30]。男女均可发病,据报道男女比例7∶5[30]。近年来,芯片和测序技术的飞速发展,其通量高、快速和高效等优势,为遗传性疾病的研究带来重大变革[31]。目前国内外研究将芯片和高通量测序技术用于智力障碍/发育迟缓(intellectual/developmental disabilities,ID/DD)研究,明确导致ID/DD的病因,如染色体数目及结构异常、拷贝数变异、基因突变等[32]。关于4q21.2微缺失/微重复综合征已有文献报道,但多数是描述缺失区域的大小及相关基因[26-27,30,33-37]。BONNETT等[36]利用array-CGH芯片研究了9例4q21缺失综合征的患者,发现1个1.37 Mb的缺失重叠区域与患者共有的表型相关,此区域包含PRKG2、RASGEF1B、hnRNPD、hnRNPDL和ENOPH1等基因。LEBEDEV等[27]利用aCGH芯片报道了1例伴发育迟缓、肌张力减退、面容畸形、语言障碍等临床表现的患者,结果显示存在1.61 Mb的重复区域,包含BMP3、PRKG2、RASGEF1B、hnRNPD、hnRPDL、ENOPH1、TMEM150C、LINC00575和SCD5等9个基因,与4q21.2缺失综合征的1.37 Mb缺失区域重叠。HU等[33]利用aCGH芯片研究了3例4q21缺失综合征的患者,并结合DECIPHER和ClinVar数据库收集4q21缺失综合征的病例报道,结果显示存在1个761 kb(包含HNRNPD、HNRNPDL、ENOPH1和TMEM150C)的重叠区域,并提示该区域与患者的发育迟缓、肌张力减退和语言障碍表型相关。ZARREI等[26]整合分析了DECIPHER和ClinVar数据库以及已发表相关文献的4q21.2微缺失/微重复综合征的缺失/重复区域包含的基因,结果发现1个171 kb的最小缺失/重复重叠区域,且这个区域仅包含hnRNPD基因(图2),提示hnRNPD可能是4q21.2微缺失/微重复综合征的关键致病基因。LEBEDEV等[38]报道1例5.4岁女童发育迟缓、语言障碍、肌张力高、畸形巨头,前额宽阔,额部隆起和四肢相对细长,并伴有恶性血管瘤以及乙状结肠,aCGH结果显示在4号染色体的4q21.21-q21.22区域包含1.61Mb的微重复片段,包括9个基因(BMP3,PRKG2,RASGEF1B,HNRNPD,HNRPDL,ENOPH1,TMEM150C,LINC00575,和SCD5)。这个微重复片段与4q21微缺失综合征的最小临界区域重叠,且患者的临床特征与4q21微缺失综合征患者相似。以上报道说明hnRNPD在神经发育以及神经相关疾病发生过程中发挥重要作用。
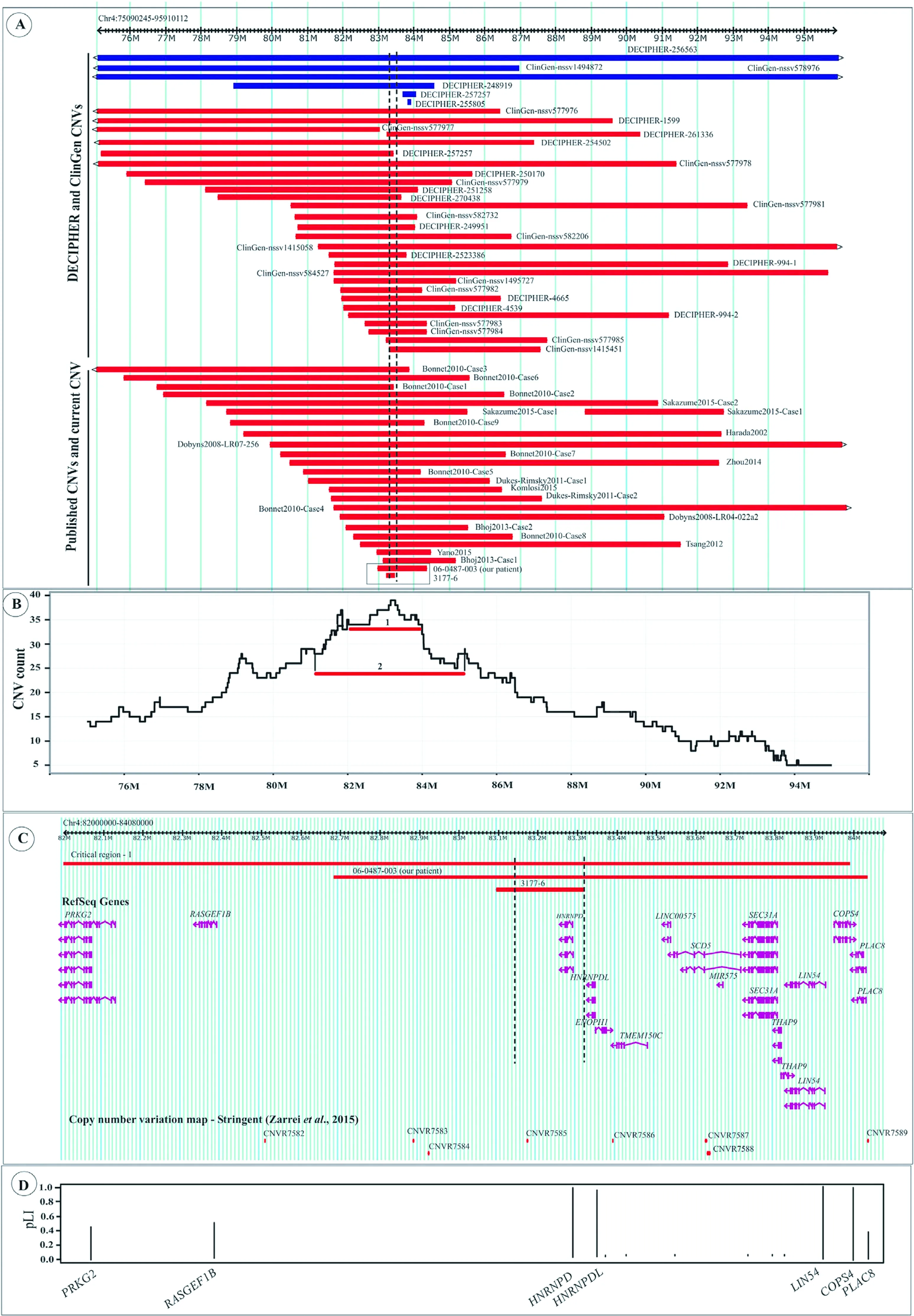
图2 4q21.2微缺失/微重复综合征的最小重叠区域 红色代表缺失综合征病例,蓝色代表重复综合征病例,虚线代表最小重叠区域Figure2 The smallest overlap region of the4q21.2microdeletion/microrepetition syndrome.Red represents the case of the missing syndrome,blue represents the case of repeat syndrome,and the dotted line represents the smallest overlap region
5 展望
hnRNPD作为多种生物学途径的中枢调节因子,在神经发育过程中特异性表达,且是4q21.2微缺失/微重复综合征致病关键基因以及参与机体生长发育、维持端粒稳定等过程。目前研究显示,hnRNPD具有双重调节功能,表达异常能够影响到其下游大量基因的表达水平,激活相关信号通路,参与多种疾病的发生与发展,如炎症、癌症、心血管疾病和病毒感染,但hnRNPD在神经发育或神经相关疾病致病过程调控的相关基因以及参与信号转导通路报道甚少,hnRNPD单倍型剂量不足导致ID/DD的致病机制亟待阐述。研究和揭示hnRNPD在神经发育过程中发挥生物学效应的分子机制以及相应的信号通路,解释相关疾病的发生机制。
