三阴性乳腺癌BRCA1的表达与临床病理特征及预后的相关性
2019-05-16郑桂兰宋翠萍窦雅琳刘媛媛李建梅
张 宁 郑桂兰 冀 东 宋翠萍 窦雅琳 刘媛媛 苏 楠 赵 月 李建梅
乳腺癌是临床上最常见的女性恶性肿瘤之一,近年来我国乳腺癌的发病率与死亡率也有逐年增加的趋势[1]。三阴性乳腺癌(triple negative breast cancer,TNBC) 是乳腺癌的一种特殊亚型,具有发病年龄轻、预后差的特点,占乳腺癌总数的15%~20%[2]。乳腺癌易感基因1(breast cancer susceptibilitygene 1,BRCA1)作为抑癌基因之一,其抑癌作用的发挥主要通过参与细胞内DNA修复、mRNA 转录以及调节细胞周期、蛋白质的合成等机制。研究表明,多种肿瘤的发生与BRCA1基因突变有关[3]。目前关于BRCA1与TNBC临床病理特征及预后的相关研究较少,因而本研究对其进行了探讨,现报告如下。
1 材料与方法
1.1 一般资料
收集 2010年1月至2013年12月我院收治的190例TNBC患者为研究对象,纳入标准:①年龄>35岁;②女性;③经免疫组化检查证实,且经2名病理科专家证实为TNBC;④手术治疗,且术前未接受放、化疗及增强免疫力等方案治疗者;⑤临床及病理资料完整。入选的TNBC患者年龄26~72岁,平均(48.2±15.6)岁。选择同期我院诊治的非三阴性乳腺癌190例纳入对照组,年龄25~77岁,平均(49.7±12.3)岁。
1.2 研究方法
本研究所使用BRCA1兔抗人单克隆抗体、p53鼠抗人抗体浓缩型以及SP免疫组化检测试剂盒均由北京中杉金桥公司提供,检测操作步骤均按照试剂盒说明书要求进行,阴性对照为PBS代替一抗,阳性对照为已知阳性表达组织。BRCA1采用1∶50稀释,p53采用1∶100稀释,显色采用DAB。结果判读:光学显微镜下对每张切片选取5个高倍视野进行观察,其中每个视野计数100 个细胞,观察其免疫组化染色的情况。p53蛋白在细胞核表达,以观察到棕黄色颗粒为阳性细胞,其中阳性细胞占全部细胞比例≥10%判定为阳性,否则为阴性。BRCA1则定位于细胞核和胞质,观察到棕黄色颗粒则为阳性细胞。结果判读以染色强度及阳性细胞比例为准。阳性细胞≤5%、>5%~25%、>25%~50%、>50%~75%、>75%则分别判定为0分、1分、2分、3分、4分;染色强度无着色、淡棕黄色、棕黄色、深棕红色分别为0分、1分、2分、3分。两项得分相乘以>2分者判断为阳性,否则为阴性。
1.3 观察指标
比较2组患者BRCA1、p53阳性表达率。记录TNBC组患者的年龄、肿瘤大小、淋巴结转移状态、病理类型、组织学分级、TNM分期等资料。同时对患者进行随访,观察患者的总生存期及复发转移情况,总生存时间指患者从手术日至末次随访或死亡时间。
1.4 统计学方法
使用SPSS17.0统计学软件,计数资料的比较采用χ2检验,采用Kaplan-Meier法进行生存分析,采用Log-Rank检验进行组间曲线比较。
2 结果
2.1 2组患者p53、BRCA1阳性表达率的比较
TNBC组p53阳性表达率明显高于对照组,BRCA1阳性表达率则低于对照组,差异有统计学意义(P<0.05)。见表1。
2.2 三阴性乳腺癌BRCA1的表达与临床病理特征的关系
本研究显示年龄<35岁、无淋巴结转移、TNM T1+T2及p53阳性者其BRCA1阳性率较高,差异有统计学意义(P<0.05);本研究未发现BRCA1阳性率与绝经状态、肿块大小、病理类型及组织学分级有关(P>0.05)。见表2。
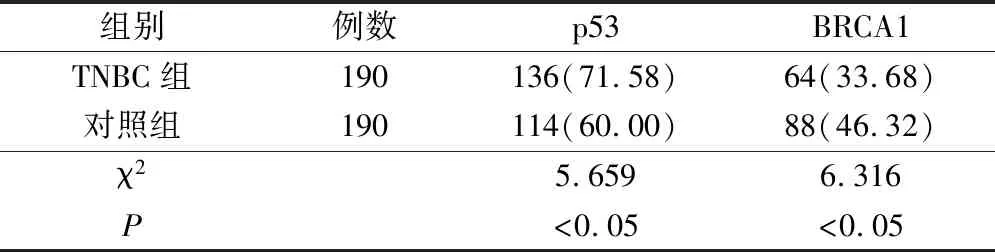
表1 TNBC组与对照组患者p53、BRCA1阳性表达率的比较(例,%)
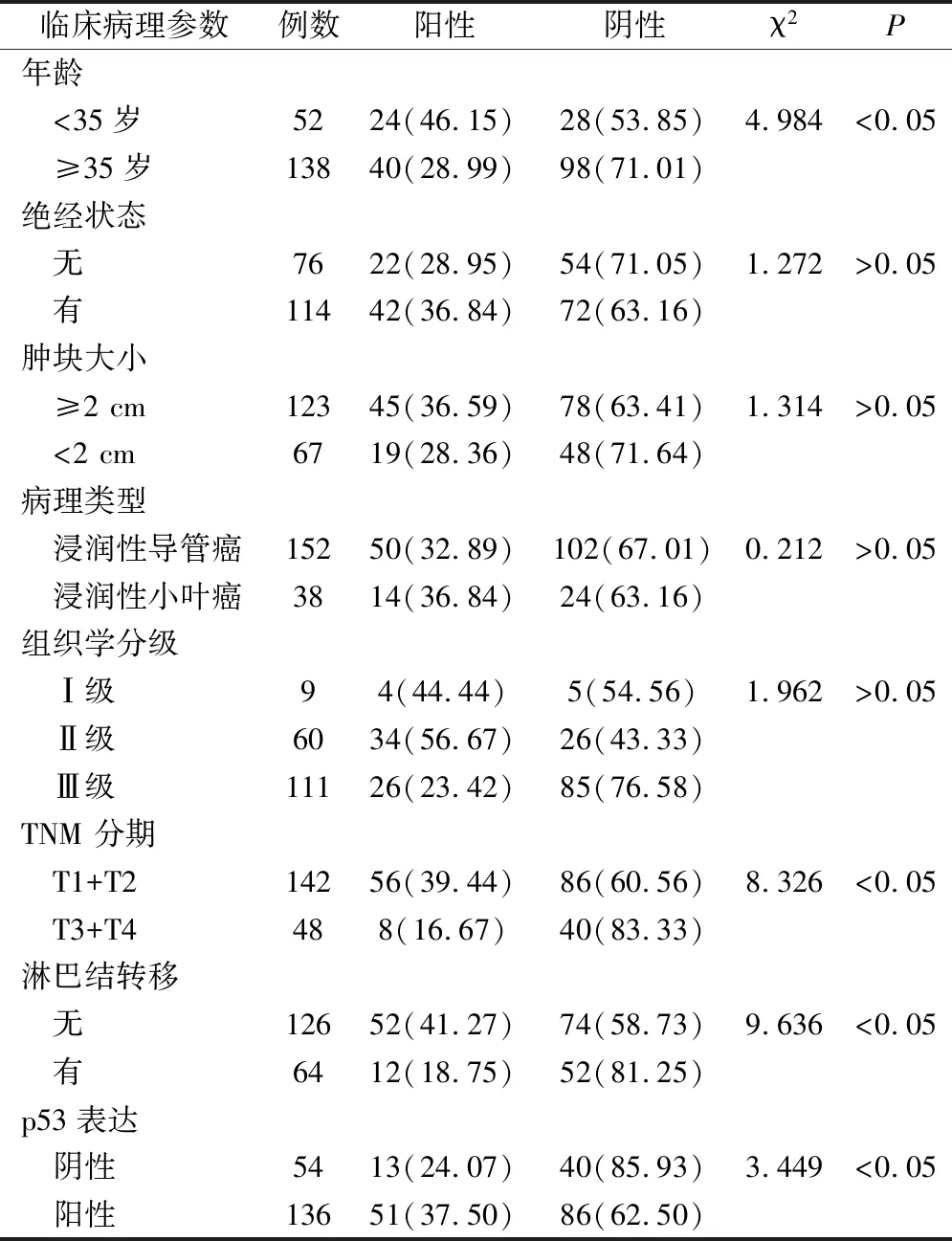
表2 三阴性乳腺癌BRCA1的表达与临床病理特征的关系(例,%)
2.3 三阴性乳腺癌BRCA1的表达与预后的关系
BRCA1阳性者5年生存率75.00%,高于阴性者的61.90%,差异有统计学意义(P<0.05)。见图1。
3 讨论
乳腺癌在世界范围内都是严重威胁女性健康最常见的恶性肿瘤之一,仅 2012 年新发乳腺癌病例就高达1700 万,其中死亡例数达到52万[4]。乳腺癌是一组具有高度异质性的肿瘤,包含多种独特病理学特征和生物学行为,即使患者具有相同的临床分期、组织学类型及治疗模式,其预后也存在着较大的差异[5]。三阴性乳腺癌更加特殊,具有较强的侵袭性生物学行为,与非三阴性乳腺癌比较,其早期复发及远处转移的风险较大,无病生存率和总生存率低于后者,患者的预后也更差[6]。由于TNBC不表达雌、孕激素受体以及人表皮生长因子受体-2,与相同分期的其他类型的乳腺癌比较,缺乏了相应的治疗靶点,对内分泌及曲妥珠单抗等治疗均不敏感。

图1 三阴性乳腺癌BRCA1的表达与预后的关系
TNBC多见于50岁以下的年轻女性,尤其是以伴有BRCA基因突变者多见。BRCA1 基因是最被熟知的乳腺癌肿瘤抑制基因,定位于17q21,在正常乳腺上皮细胞核中存在[7]。BRCA1主要作用包括调控细胞周期及基因转录、抑制细胞生长、修复DNA损伤以维护基因稳定性细胞活动,并且在细胞凋亡及细胞中心体复制过程中也起着重要作用。所以如果机体BRCA1基因发生突变或者其表达量减少,则其抑制细胞分裂的作用会明显减弱,进而引起细胞增殖失去控制,导致肿瘤的发生、发展[8]。BRCA1被认为是基因组的保护者,其重要作用之一即参与基因修复,但是如果损伤比较严重而无法修复时,此时便发挥诱发细胞凋亡的作用。Marcus等[9]的研究发现乳腺癌细胞与正常上皮细胞相比,其 BRCA1 的表达水平显著下降。三阴乳腺癌与 BRCA1 相关乳腺癌有许多相似之处,尤其表现在分子和表型特征,且免疫组化结果提示 BRCA1 相关乳腺癌绝大部分均为TNBC,说明BRCA1对TNBC具有重要的研究价值[10]。本研究发现 BRCA1 蛋白表达在TNBC患者中的阳性率显著低于对照组,其表达与年龄、淋巴结转移、TNM分期及P53有关。年轻乳腺癌患者生长代谢旺盛,其乳腺腺体体积较大、丰富致密,肿瘤生长速度较快。刘锦平等[11]的研究结果也提示BRCA1 蛋白的表达与年龄呈负相关,即年龄越轻则BRCA1蛋白的表达水平也就越高。P53是一种研究最为深入的抑癌基因之一,其基因编码产物参与转录调节,起到调控细胞周期、修复DNA损伤和诱导凋亡的作用。研究显示BRCA1可以与P53相互作用,增强后者的依赖性转录。本研究结果显示p53阳性表达组的BRCA1阳性率更高,与朱亚宁等[12]的研究结果一致。此外,本研究发现BRCA1指标阳性者较阴性者有较高的生存率。
综上所述,BRCA-1的表达与三阴性乳腺癌患者年龄、淋巴结转移,TNM临床分期及P53有关,并且可以影响患者的预后。
