版纳微型猪近交系B4GALNT2基因真核表达载体构建及亚细胞定位分析
2019-05-15王淑燕霍海龙张永云李罗刚王雪飞霍金龙
王淑燕,宋 雪,王 配,霍海龙,张 霞,张永云,李罗刚,王雪飞,霍金龙*
(1.云南农业大学动物科学技术学院/云南省版纳微型猪近交系重点实验室,昆明 650201;2.云南农业职业技术学院教务处,昆明 650031;3.云南农业大学农科专业基础实验教学示范中心,昆明 650201)
猪到人异种器官移植是解决临床移植供体来源不足的理想途径,许多学者认为,小型猪体型小且性成熟早,在解剖、生理、代谢和疾病发生机理等方面与人极其相似,是理想的异种器官移植供体[1-3]。当前科学家主要通过敲除供体的免疫排斥抗原基因或导入受体补体途径上的关键抗原来改造供体动物,从而克服异种器官移植过程中的超急性排斥反应(hyperacute rejection,HAR)。血管异种移植物的排斥主要由抗体介导的过程所主导,包括补体介导的损伤和内皮细胞的激活,导致异种移植排斥反应,表现为广泛的微血管血栓形成和凝固性坏死[4]。该过程中除了α-1,3-半乳糖(α-Gal)作为关键的异种移植物排斥抗原[5],还存在一种潜在的非Gal 免疫原Sda,它是一种血型抗原,跟大部分血型抗原一样,都是存在于组织和体液中的碳水化合物结构,有助于定义个体免疫表型[6]。该抗原起初在红细胞表面被检测到的,后来也发现在其他组织中广泛分布[7],因此被命名为“组织血型”抗原[8]。
B4GALNT2 是Sda 抗原合成关键催化酶,它属于糖基转移家族,被鉴定为GalNAc-转移酶,也称为β-1,4-N-乙酰半乳糖胺转移酶2,其催化N-乙酰半乳糖胺的末端添加到唾液酸修饰的乳糖胺,以产生GalNAcβ4 [Neu5Acα2,3]Galβ4GlcNAcβ3Gal(Sda 血型抗原)[9]。有研究表明,B4GALNT2 基因在人胚肾293 细胞(HEK)中表达会导致抗体与B4GALNT2 酶的连接增加,当猪的心脏移植到灵长类动物体内后,由于受到灵长类血清的刺激,HEKB4GALNT2 细胞会显示出补体介导的裂解敏感性增加[10]。G.W.Byrne 等[11-12]使用猪到狒狒心脏异种移植后获得的血清,研究鉴定了43 种潜在的非Gal靶抗原,包括从猪主动脉内皮细胞(PAEC)表达文库分离的6 种cDNA,当这些cDNA 在HEK 细胞上表达时,各自产生与狒狒非Gal IgG 结合的猪抗原。这些cDNA 经BLAST 搜索,其中一个被鉴定为与Bos Tauru(牛)β1,4N-乙酰半乳糖胺转移酶(B4GALNT2)序列同源的猪糖基转移酶[11]。Sda 抗原可作为不同细胞或微生物的特异性配体或受体[13],与其生物合成酶β1,4-N-乙酰半乳糖胺转移酶2(B4GALNT2)在各种生理和病理情况下发挥生物学作用。B4GALNT2 引起抑制素的非典型糖基化是导致Lacaune 母绵羊高排卵率的主要分子调控机制[14];在小鼠中研究发现,Sda 抗原可以充当宿主和微生物群之间的中间体,敲除B4GALNT2 基因导致肠道微生物群的变化[15],Sda 还涉及预防肌营养不良症的发生[16-17];M.D.Montiel 等研究发现B4GALNT2 基因可能是人结肠细胞分化的标志物[18],增加Sda 在人胃肠癌细胞表面的表达可抑制癌细胞转移[19];Sda还可能介导猪原始胚胎细胞参与胚胎附着[20]。
版纳微型猪近交系(BMI)不仅具有小型猪的特点,而且基因高度纯合、遗传背景清楚,在基因敲除、转基因、异种器官移植等一系列基础研究和临床试验等方面具有独特的优势。本研究构建目的基因(B4GALNT2)和报告基因(绿色荧光蛋白基因,EGFP)的重组真核表达载体pEGFP-C1-B4GALNT2,并将其转染猪肾上皮细胞(PK15),来检测细胞中绿色荧光表达,并用双荧光染料分别对细胞核和线粒体进行染色,确定BMI B4GALNT2 在真核细胞内的表达定位。
1 材料和方法
1.1 试验材料及主要试剂
RT-PCR 方法获得的B4GALNT2 基因cDNA 序列(组织样品来自耳号为413、417 和0847 的BMI),猪肾上皮PK15 细胞、EX Taq 酶、pMD18-T 载体、限制性内切酶(Q.CUTEcoR Ⅰ和Q.CUTBamH Ⅰ)、pEGFP-C1 真核表达载体、Lipofectamine 2000、DMEM 高糖培养基、胎牛血清FBS、胰蛋白酶、Mito Tracker 和Hoechst33342 染料。
1.2 设计真核表达引物
根据BMI B4GALNT2 基因的CDS 序列内部限制性酶切位点及pEGFP-C1 绿色荧光蛋白真核表达载体多克隆位点的情况,设计引物F/R,在CDS上下游引物的5'端分别加入EcoRⅠ和BamHⅠ酶切位点(酶切位点序列用下划线标识)。引物如下:
F:GAATTCATGACTTCGTACAGCCCTAG
R:GGATCCTTAGGTGACACATTGGAGAT
1.3 PCR 扩增及产物检测
以BMI cDNA 为模板,用1.2 中设计的真核表达引物F/R 扩增B4GALNT2 真核表达序列。PCR 扩增体系25 μL:ddH2O 5.75 μL,2×GC buffer I 12.5 μL,dNTPs(2.5 mmol/L)4 μL,引物F/R(10 μmol/L)各0.5 μL,cDNA 模板(50 ng/μL)1.5 μL,Ex Taq 聚合酶(5 U/μL)0.25 μL。PCR 运行条件设置:预变性(94 ℃,5 min);变性(94 ℃,30 s),退火(59 ℃,30 s),延伸(72 ℃,2 min),35 次循环;后延伸(72 ℃,10 min)。PCR 产物进行电泳检测。
1.4 BMI B4GALNT2 基因克隆
目的片段回收纯化后与克隆载体pMD18-T 连接,16 ℃过夜连接。将连接产物转化、复苏、培养使其形成单菌落。挑取阳性单菌落,37 ℃200 r/min 振荡培养,16 h 后以0.2 μL 菌液为模板,进行菌液PCR 鉴定。将鉴定为阳性的菌液进行序列测定,选取测序结果无突变的菌液提取pMD18-T-B4GALNT2 重组质粒。
1.5 B4GALNT2 基因真核重组表达载体构建
用Q.CUTEcoRⅠ和Q.CUTBamHⅠ同时双酶切pMD18-T-B4GALNT2 重组质粒与pEGFP-C1 载体,双酶切体系(50 μL):重组质粒/载体4 μL;10×buffer 5 μL;双酶各1 μL;水39 μL。回收目的基因B4GALNT2 片段及pEGFP-C1 的大片段并于16 ℃过夜连接。将连接产物转化DH5a、复苏、培养使其形成单菌落。进行菌液PCR 鉴定及测序,步骤同1.4。测序结果无突变的菌液提取pEGFP-C1-B4GALNT2 重组质粒。
1.6 PK15 细胞培养及B4GALNT2 亚细胞定位
1.6.1 细胞复苏
将冻存于液氮中的PK15 细胞取出37 ℃迅速解冻,与适量5%细胞培养液混匀后离心,弃上清,用15%细胞培养液重悬细胞沉淀,转移至培养瓶,置于37 ℃、5% CO2培养箱中培养,每隔12 h 观察记录细胞生长情况,24 h 更换培养液。
1.6.2 传代培养
细胞生长至对数增长期(即汇合率达80%~90%)时进行传代培养。弃去培养液,PBS 冲洗,加入胰酶消化1~3 min,待细胞呈圆形、游离状态时,终止消化,离心,弃上清,加入10%细胞培养液重悬,转移至新的培养瓶,完成一次细胞传代。
1.6.3 转染、染色及成像
转染前一天将细胞接种至六孔板中,待细胞达到30%~40%汇合率时进行转染。将BMI pEGFPC1-B4GALNT2 真核表达重组质粒以及pEGFP-C1空质粒分别转染PK15 细胞,同时以未转染的PK15空细胞作为空白对照,以转染了pEGFP-C1 空载体的PK15 细胞作为阴性对照。将质粒和脂质体混合均匀后,参照脂质体转染说明书,进行转染,每孔细胞中加入500 μL 转染液和1 mL DMEM 培养液,培养箱中培养6 h 后更换为10%FBS 的细胞培养液,继续培养18~48 h 后检测绿色荧光,以确定转染成功及正常表达。先后用Mito Tracker 和Hoechst33342分别对细胞进行染色,倒置荧光显微镜观察并采集图像。
2 结果与分析
2.1 B4GALNT2 真核表达序列扩增结果
引物F/R 扩增B4GALNT2 真核表达序列电泳结果见图1,片段大小为1 521 bp,包括完全编码区1 509 bp 和两端添加的EcoRⅠ和BamHⅠ各6 bp的酶切位点。

图1 BMI B4GALNT2 真核表达PCR 产物电泳结果Figure 1 The agarose gel electrophoresis result of eukaryocyte expression PCR products of BMI B4GALNT2
2.2 重组质粒的鉴定
用EcoR Ⅰ和BamH Ⅰ双限制性内切酶对提取的pMD18-T-B4GALNT2 和pEGFP-C1-B4GALNT2质粒进行鉴定,电泳条带分别为2 698/1 521 bp 和4 700/1 521 bp,结果符合预期,表明克隆质粒pMD18-T-B4GALNT2 和真核表达质粒pEGFP-C1-B4GALNT2 构建成功,如图2所示。
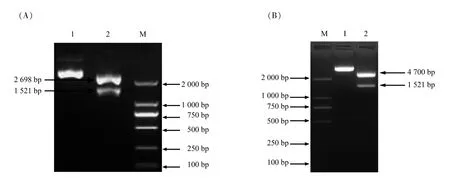
图2 pMD18-T-B4GALNT2(A)和pEGFP-C1-B4GALNT2(B)重组质粒鉴定结果Figure 2 Identification of the pMD18T-B4GALNT2(A)and pEGFP-C1-B4GALNT2(B)recombinant plasmids
2.3 pEGFP-C1-B4GALNT2 在PK15 细胞中的表达与定位
将转染后的PK15 细胞培养24~48 h 用蔡司倒置荧光显微镜进行观察,结果能够检测到明显的绿色荧光,证明转染成功。对线粒体和细胞核进行染色后继续观察,蓝色荧光部分代表细胞核,红色荧光部分代表细胞质。绿色荧光的位置与红色荧光重叠,由此确定目的蛋白B4GALNT2 主要在细胞质中表达(图3)。通过PSORTⅡserver(http://psort.hgc.jp/)对B4GALNT2 蛋白进行亚细胞定位预测,预测结果44.4%定位在内质网,22.2%定位在线粒体,22.2%定位在高尔基体,另有11.1%定位在细胞质。已知内质网、线粒体和高尔基体都是位于细胞质基质中的细胞器,因此网站预测结果与本试验结果一致。

图3 pEGFP-C1-B4GALNT2 重组质粒在PK15 细胞中亚细胞定位Figure 3 Subcellular localization of pEGFP-C1-B4GALNT2 recombinant plasmids in PK15 cell
3 讨论与结论
在灵长类动物中预先形成的对人血清产生细胞毒性的非Gal 抗体会引发早期异种心脏移植损伤,并足以在低浓度下诱导超急性排斥反应[21]。J.L.Estrada 等[22]同时敲除α-1,3-半乳糖基转移酶(GGTA1)、胞苷单磷酸-N-乙酰神经氨酸羟化酶(CMAH)和β-1,4-N-乙酰半乳糖胺转移酶2(B4GALNT2)的基因,克隆出具有3 种抗原缺陷基因的GGTA1/CMAH/B4GALNT2-KO 猪,与只有两种抗原GGTA1/CMAH 缺陷基因的猪相比,发现从3 种基因都缺失的猪中分离出的外周血单核细胞(PBMC)与人IgM/IgG 的结合明显减少,且在人和狒狒血清中显示出了低水平的抗体反应性。J.R.Butler 等[23]通过沉默猪B4GALNT2 基因,发现与人血清中IgG 和IgM 抗体结合分别减少49.1%和43.2%,而同时沉默猪中的GGTA1、CMAH 和B4GALNT2 基因可显著降低猪对人的抗性。因此改变猪的碳水化合物结构可以有效地减少人抗体介导的补体依赖性细胞毒性以及抗体介导的排斥反应,将有助于异种器官移植临床的实现。
B4GALNT2 蛋白具有质膜和细胞质两种不同的细胞定位,细胞质包括高尔基体,内质网等细胞器和其他结构。如果一个糖基转移酶在蛋白质或脂质的翻译后修饰中发挥作用,那么它应该位于高尔基体上[24]。将小鼠B4GALNT2-GFP 嵌合体转染囊胚滋养外胚层细胞,显示目的蛋白定位在质膜上;在怀孕小鼠的子宫组织中,B4GALNT2 蛋白则定位于细胞质而不是质膜上[24]。抗B4GALNT2 和凝集素抑制试验证实B4GALNT2 和Sda 抗原通过小鼠系统和人子宫内膜细胞系在体外和体内参与胚胎附着[25],结合之前关于雌性小鼠生殖系统中B4GALNT2 基因调控的研究[26]进一步表明B4GALNT2 和Sda 抗原是胚胎植入所必需的,B4GALNT2 是一种参与胚胎植入的质膜蛋白。
在本研究中,我们采用RT-PCR 扩增了带有酶切位点的编码区,构建了BMI B4GALNT2 与绿色荧光蛋白的融合表达载体。BMI B4GALNT2 的亚细胞定位通过在PK15 细胞中瞬时表达的绿色荧光蛋白融合表达载体pEGFP-C1-B4GALNT2 来确定。通过非病毒感染的脂质体介导法,将构建的重组质粒载体pEGFP-C1-B4GALNT2 成功转染PK15 细胞,以绿色荧光蛋白(EGFP)作为标签蛋白来示踪B4GALNT2 在PK15 细胞中的表达和定位情况。结合亚细胞定位的试验结果和PSORTⅡserver 网站的预测表明,B4GALNT2 蛋白主要定位于细胞质,揭示该蛋白在细胞质中发挥其功能作用。绿色荧光蛋白真核表达载体的成功构建,将为进一步探索BMI B4GALNT2 基因在细胞内的作用机制奠定基础。
B4GALNT2 基因有一个十分罕见的特征,它不仅能产生两个具有不同转录位点的转录本,而且还能产生两个具有不同N-末端的蛋白异构体[18]。长转录本编码的蛋白质由66 个氨基酸残基组成异常长的胞质尾,而短转录本翻译的蛋白质具有与小鼠序列同源的非常短(6 个氨基酸残基)的胞质尾[27]。长和短的蛋白异构体都具有酶促活性[28],并且能够在转染的细胞中合成Sda 抗原。其中长蛋白异构属于最长的糖基转移酶之一,参与细胞内定位等特定的功能。Sda 抗原序列合成的研究表明,β1,4-GalNA的加入是发生在加入α2,3-唾液酸之后[29],所以B4GALNT2 必须(或至少部分)定位在不含α2,3-唾液酸转移酶的高尔基体中[6]。位于高尔基体中的真核生物糖基转移酶通常由一个短N 末端胞质尾部,一个跨膜结构域,一个可变长度的茎区和一个大的C 末端球状催化结构域组成[30]。预测的B4GALNT2蛋白的一级序列具有与其他糖基转移酶相似的II型跨膜蛋白的特征。
人们普遍认为B4GALNT2 是唯一能够合成Sda抗原的酶,并且该酶是单一遗传基因座的产物。因此,B4GALNT2 实现组织特异性酶表达的最有可能的机制,是交替使用不同转录因子调控的两个不同B4GALNT2 基因启动子[5]。未来的转录调控研究将有助于阐明由两个密集的启动子产生的每个转录本的生物学意义,这为我们后续更加深入地探索B4GALNT2 基因的功能提供了研究方向。
