大鼠肺部侵袭性光滑假丝酵母菌感染过程中Dectin-1蛋白和IL-17、IL-23的含量变化及意义
2019-05-15骆雪萍吴呈霖
黄 婷,骆雪萍,赵 莹,吴呈霖
(1. 桂林医学院第二附属医院重症医学科,广西 桂林 541001; 2. 十堰市太和医院呼吸内科,湖北 十堰 442000)
侵袭性念珠菌病(incasive candidiasis,IC)是指真菌侵入人体内脏、血液或表皮角质层以下深部组织结构引起的感染。过去IC最常见的病原体是白假丝酵母菌,近年来随着重症监护病房中高龄、免疫缺陷或免疫功能低下患者的增多,以及机械通气、动静脉穿刺、持续床旁血液透析、体外膜肺氧合等各种侵入性操作的增加,我国光滑假丝酵母菌血症已仅次于白假丝酵母菌,在全部假丝酵母菌感染中上升至第4位[1]。光滑假丝酵母菌对氟康唑敏感性低,对一线治疗药物棘白菌素的耐药率也在逐年增加,从而导致光滑假丝酵母菌感染发病率高,预后差,病死率高[2]。
β-葡聚糖是真菌致病的重要成分,树突状细胞相关C型凝集素-1(Dectin-1)受体在抗真菌感染免疫以及 β- 葡聚糖介导的机体固有免疫调节中起着至关重要的作用。白细胞介素(IL)-17是新近发现的TH17细胞所分泌的效应因子,具有强大的促炎作用。IL-23 是维持 TH17 细胞亚群分化和稳定的重要因子,对IL-17的生成至关重要,同时本身也是一种促炎症因子。研究[3]证实,白假丝酵母菌感染时宿主通过免疫系统激活TH17细胞,产生IL-17、IL-22 等细胞因子,募集中性粒细胞杀灭真菌孢子。以往对光滑假丝酵母菌及其β-葡聚糖信号通路、下游相关细胞因子的研究相对较少,本研究采用经气管内灌注光滑假丝酵母菌菌液复制光滑假丝酵母菌肺部感染的动物模型,通过观察大鼠肺组织病理改变,肺组织中Dectin-1蛋白表达量的变化,血清及肺泡灌洗液中IL-17及IL-23含量的动态变化,从而进一步探讨Dectin-1通路对侵袭性肺部热处理光滑假丝酵母菌感染的识别,以及IL-17、IL-23表达和变化的意义,为光滑假丝酵母菌感染的发病机制、治疗提供理论和实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康清洁级雌性SD大鼠54只,体重180~220 g,由桂林医学院实验动物中心提供。动物合格证号 SCXK桂2013-0001,按清洁级标准正常饲养。
1.1.2 主要实验试剂 光滑假丝酵母菌标准株(编号为9627)购于上海酶联生物科技有限公司,BCA蛋白定量试剂盒购自上海碧云天生物科技有限公司,PVDF膜购自北京索莱宝科技有限公司,兔抗鼠 Dectin-1一抗购自美国ABCAM公司,山羊抗兔二抗购自北京中杉金桥生物技术公司,β-actin一抗、二抗及ELC发光液均购自武汉Proteintech公司,IL-17及IL-23酶联接免疫吸附测定(ELISA)试剂盒均购自美国eBioscience公司。
1.1.3 热处理光滑假丝酵母菌悬液的制备 将光滑假丝酵母菌菌株接种于沙堡琼脂培养基,置于真菌培养箱培养48 h后,用细菌接种环挑取菌落,用灭菌生理盐水冲洗2次后再用生理盐水稀释成菌悬液,采取比浊法将其含菌量定量至5×107CFU/mL,按照文献[4]进行热处理(95℃水浴热处理30 min),备用。
1.2 实验方法
1.2.1 动物分组和模型制备 健康雌性 SD 大鼠 54 只,所有大鼠均适应性喂养3 d后,采用随机数字表法分为空白对照组(A 组)、直接感染组(B 组)和免疫抑制感染组(C组),每组 18 只。A组全程正常饲养,C组大鼠连续5 d腹腔注射地塞米松(0.6 mg/kg),B组腹腔注射等剂量生理盐水。5 d后B组及C组大鼠予10%水合氯醛(3 mL/kg)腹腔注射麻醉后,仰卧固定于鼠板,用小型压舌板将舌体推开,在透射光源下观察到大鼠会厌和声带的运动后,以16 G静脉留置针作为气管导管在明视下进行气管插管,B组及C组大鼠在气管插管后一次性快速灌注制备好的热处理菌悬液0.3 mL,连续感染3 d,灌注后立即竖立鼠板,水平摇晃3 min使菌液在双肺内均匀分布。
1.2.2 大鼠处死以及血清、肺泡灌洗液的收集 三组大鼠分别于第3次感染后第1、3、5 天,每组随机选取6只大鼠,麻醉后固定于鼠板上,经膈肌心脏放血处死大鼠并收集血液1 mL,4℃ 4 000 r/min离心20 min收集血清;消毒颈部皮肤,暴露颈部气管,用5 mL灭菌注射器针头呈30°角轻柔插入气管1/2处,随后水平进针约2.5 cm并固定,结扎右侧肺门,将5 mL 4℃预冷灭菌生理盐水灌入左肺,间隔1 min后缓慢回抽,反复3次为灌洗1次,共灌洗2次,收集所有的肺泡灌洗液,4℃ 1 500 r/min离心10 min收集上清,与血清一起置于-80℃冰箱保存,备用。
1.2.3 大鼠肺组织的收集 分离肺组织,取右上、中叶肺组织于-80℃保存,用于蛋白印迹法检测Dectin-1蛋白的表达量;取右下肺置于10%多聚甲醛固定、脱水,石蜡包埋,常规切片HE染色。
1.2.4 IL-17、IL-23含量的检测 采用ELISA法检测。取3组大鼠血清及肺泡灌洗液的上清液标本各100 μL,所有标本均设2个复孔检测,严格按照IL-17、IL-23试剂盒说明书的操作步骤检测标本中IL-17、IL-23含量,得到的结果以pg/mL表示。
1.2.5 Dectin-1蛋白表达量的检测 采用Western Blot法进行。取冻存的肺组织50 mg进行组织匀浆,离心后取上清即为总蛋白,用BCA蛋白浓度定量试剂盒进行蛋白定量,用8%聚丙烯酰胺凝胶进行SDS-PAGA电泳,PVDF膜湿转,室温封闭2 h后分别加入Dectin-1一抗(1∶2 000)、β-actin一抗(1∶4 000) 4°C孵育过夜,洗涤3次后加入二抗室温孵育1 h,洗涤3次后用ECL化学试剂发光,用ChemiDo-eXRS图像采集系统采集图像,Image J软件检测条带灰度值,以Dectin-1蛋白目的条带与内参蛋白β-actin条带的灰度比值作为Dectin-1蛋白的相对表达量。

2 结果
2.1 大鼠一般情况及病情观察 实验过程中,A组大鼠全程进食、饮水及活动无明显改变,精神好,较活跃,毛发光亮。B组大鼠活动在气管给药结束后第1天无明显改变,第3天及第5天逐渐有大鼠出现进食及饮水减少,精神稍差,活动较前减少,体重逐渐下降。C组大鼠从给药结束后第1天即开始出现食欲下降,进食及饮水明显减少,精神差,嗜睡,活动明显减少,口鼻部位出现淤血点,粪便软烂,体重明显下降,并且上述症状随时间加重。大鼠平均体重变化情况见图1。
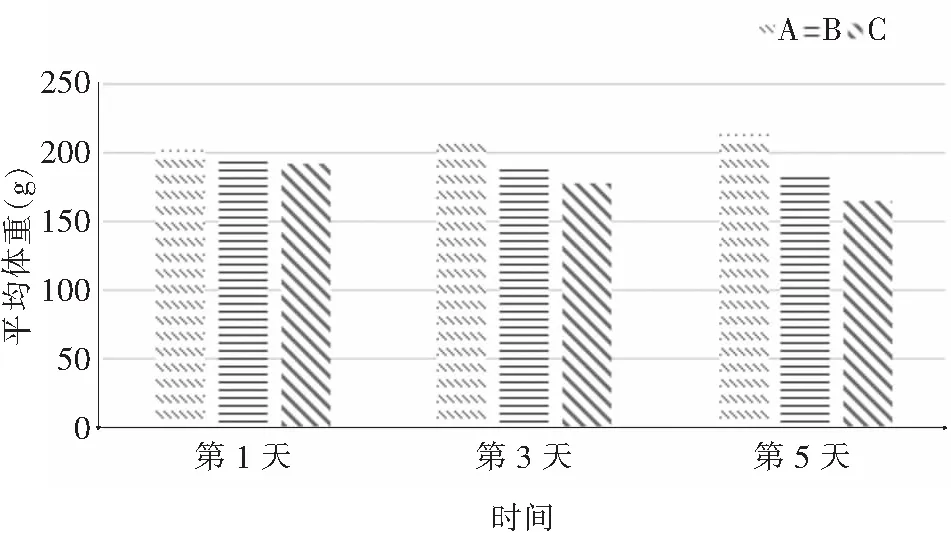
图1 三组大鼠平均体重变化情况
Figure1Changes in average body weight of three groups of rats
2.2 肺组织病理学改变
2.2.1 肉眼观察 肉眼见A组大鼠肺组织形态正常,质软,表面光滑呈粉红色,无充血、水肿,边缘锐薄。B组大鼠肺组织第1天稍肿胀,第3天及第5天可见充血、水肿,表面有散在质韧的灰白色病灶,第5天较第3天充血、水肿明显。C组大鼠肺组织病变最严重,充血、水肿明显,触之较硬、弹性差,表面有大小不一的灰白色病灶,病变程度随时间逐渐加重。
2.2.2 HE染色观察 显微镜下可见A组大鼠肺泡结构清晰,肺间隔完整,无充血或炎性细胞浸润,第1、3、5天无明显改变。B组大鼠部分肺泡塌陷,肺泡腔及肺间隔可见炎性细胞浸润,可见肺组织出血,病变严重程度随时间进行性加重。C组大鼠肺组织病变最严重,大部分肺泡塌陷,界限不清晰,病灶之间有大量炎性细胞浸润,肺组织出血、坏死明显,病变严重程度随时间进行性加重。见图2。
A1.1(×200 倍) 及A1.2(×400 倍)为空白对照组;B1.1、B2.1、B3.1(×200 倍)及B1.2、B2.2、B3.2(×400 倍)分别为B组第1、3、5天;C1.1、C2.1、C3.1(×200 倍)及C1.2、C2.2、C3.2(×400 倍)分别为C组第1、3、5天
图2三组大鼠肺组织病理检查结果
Figure2Pathological examination results of lung tissue in three groups of rats
2.3 三组大鼠血清中IL-17、IL-23的含量及影响因素比较 A组大鼠血清中IL-17、IL-23含量在三组中均最低,B组和C组大鼠血清中IL-17、IL-23含量均随时间增高,同时IL-17、IL-23含量在各个时间点均是C组最高,B组次之,A组最低。采用多元回归分析得到对大鼠进行免疫抑制、大鼠真菌感染及感染后的时间长短均分别对血清中IL-17、IL-23含量有影响,其中应用免疫抑制剂对血清中IL-17、IL-23含量影响均最大;对血清中IL-17含量而言感染后的时间影响次之,真菌感染影响程度最低;对血清中IL-23含量而言,真菌感染影响程度次之,感染后时间影响程度最低。见表1、2。

表1 各时间点三组大鼠血清中IL-17、IL-23含量(pg/mL,n=6)

表2 血清中IL-17 、IL-23浓度的影响因素
2.4 三组肺泡灌洗中IL-17、IL-23含量及及影响因素比较 A组肺泡灌洗液中IL-17、IL-23含量在三组中均最低,B组和C组大鼠肺泡灌洗液中IL-17、IL-23含量均随时间增高,同时IL-17、IL-23含量在各个时间点均是C组最高,B组次之,A组最低。采用多元回归分析得到对大鼠进行免疫抑制、大鼠真菌感染及感染后的时间长短均分别对肺泡灌洗液中IL-17及IL-23含量有影响,其中应用免疫抑制剂对两种炎症因子含量影响程度最大,进行真菌感染影响程度次之,感染后时间长短影响程度最低。以上差异均有统计学意义(P<0.05)。见表3、4。
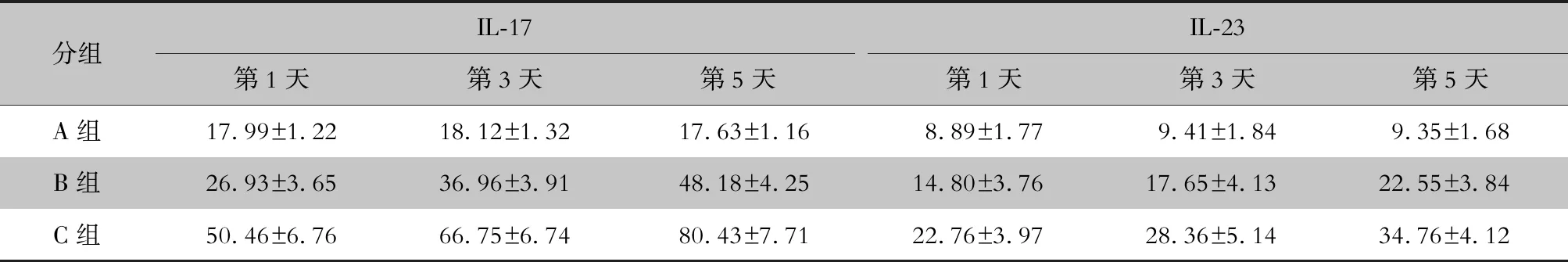
表3 各时间点三组大鼠肺泡灌洗液中IL-17、IL-23浓度(pg/mL,n=6)
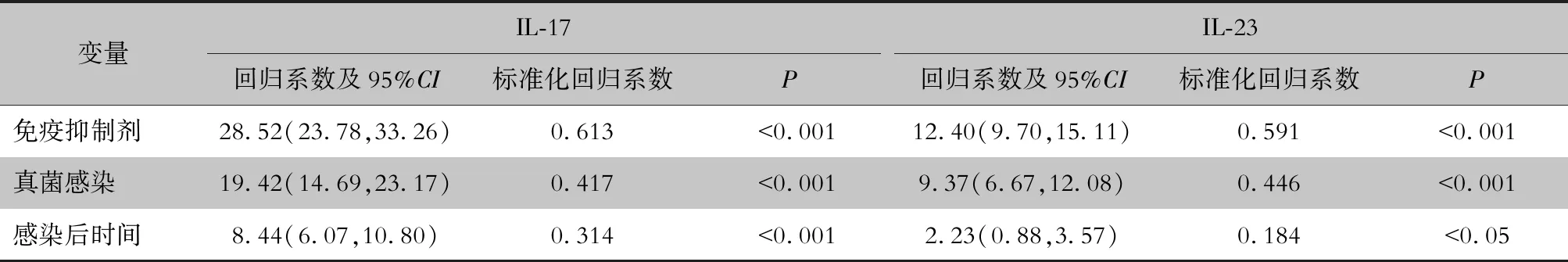
表4 肺泡灌洗液中IL-17、IL-23浓度的影响因素
2.5 相关性分析 经Pearson相关发现,B组:(1)血清中IL23和IL17呈正相关;(2)肺泡灌洗液中IL23和IL17两个因子也呈正相关(r分别为0.885、0.849,均P<0.05)。C组:(1)血清中IL23和IL17呈正相关;(2)肺泡灌洗液中IL23和IL17两个因子也呈正相关(r分别为0.675、0.680,均P<0.05)。IL-17在大鼠血清及肺泡灌洗液中的表达呈正相关(r=0.967,P<0.05),IL-23在大鼠血清及肺泡灌洗液中的表达也呈正相关(r=0.886,P<0.05)。
2.6 三组大鼠肺组织 Dectin-1 蛋白表达量及影响因素分析 A组第1、3、5天Dectin-1蛋白表达均很低。B组和C组大鼠肺组织 Dectin-1 蛋白表达量随感染时间增加而增高,第1、3、5天均是C组蛋白表达量最高,B组次之,A组表达量最低。采用多元回归分析得到对大鼠进行免疫抑制、大鼠真菌感染及感染后的时间长短均分别对肺组织 Dectin-1 蛋白表达量含量有影响,其中应用免疫抑制剂对Dectin-1 蛋白表达量影响程度最大,真菌感染影响程度次之,感染后时间长短影响程度最低。以上差异均有统计学意义(P<0.05)。见图3及表5、6。
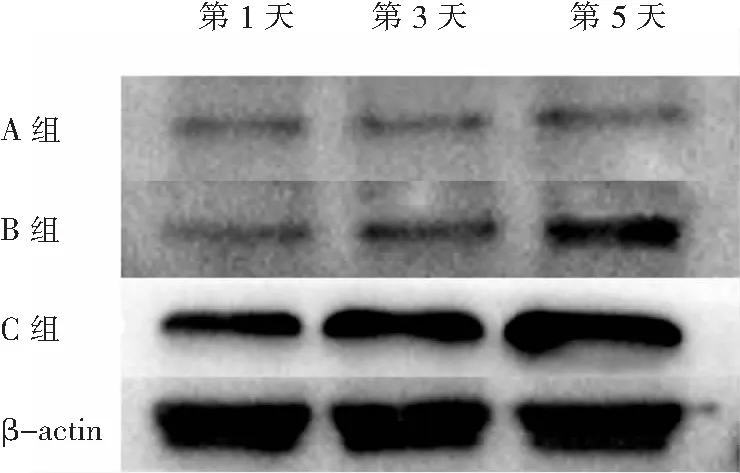
图3 各时间点三组大鼠肺组织Dectin-1蛋白的表达情况
Figure3Expression of Dectin-1 protein in lung tissue in three groups of rats at different time points
表5各时间点三组大鼠肺组织Dectin-1蛋白的相对表达量(n=3)
Table5Relative expression of Dectin-1 protein of lung tissue in three groups of rats at different time points(n=3)

分组第1天第3天第5天A组0.16±0.010.15±0.020.17±0.01B组0.20±0.030.32±0.050.46±0.05C组0.49±0.080.63±1.100.77±0.07
表6大鼠肺组织Dectin-1蛋白相对表达含量的影响因素
Table6Influencing factors for relative expression of Dectin-1 protein in lung tissue

变量回归系数及95%CI标准化回归系数P免疫抑制剂0.30(0.23,0.37)0.653<0.001真菌感染0.16(0.10,0.24)0.360<0.001感染后时间0.09(0.06,0.13)0.345<0.05
3 讨论
人体的免疫系统分为固有免疫系统(innate immunity)和适应性免疫系统(adaptive immunity),当病原微生物入侵机体时首要面对的是机体固有免疫系统。在固有免疫中,对机体而言最大的挑战就是通过有限的受体迅速识别大量不同的病原体并作出应答。系统性念珠菌病的宿主防御主要依靠吞噬细胞(中性粒细胞、单核细胞和巨噬细胞)对真菌细胞的摄取和杀死。
机体固有免疫系统通过病原模式识别受体(PRRs)识别入侵真菌的病原体相关分子模式(PAMP),激活免疫应答。真菌细胞壁作为最外层的细胞结构,在真菌的致病性中起着重要作用[5]。真菌细胞壁是由β-葡聚糖、几丁质和甘露糖蛋白组成的复杂结构,而β-葡聚糖是真菌细胞壁最内层结构,作为重要的PAMP被外层的甘露糖-甘露聚糖蛋白层覆盖,从而阻止了PRRs对β-葡聚糖的直接识别[6]。Goodridge等[7]发现通过热处理能破坏白假丝酵母菌菌细胞壁外层的甘露聚糖-甘露糖蛋白结构,使细胞壁内层的β-葡聚糖得以暴露,从而被C型凝集素受体家族识别,进而启动固有免疫开始发挥抗真菌作用。而本课题组前期研究[8]发现,经过热处理的光滑假丝酵母菌与活光滑假丝酵母菌同样具有较强的致病性。本研究先建立大鼠免疫抑制状态再经气管感染热处理光滑假丝酵母菌,发现免疫抑制感染组大鼠较直接感染组大鼠一般情况更差,病情更严重,肺组织的炎性细胞浸润、充血及肺泡结构破坏等炎性病变更显著,说明成功建立了大鼠热侵袭性热处理光滑假丝酵母菌肺部感染模型,同时可以推测光滑假丝酵母菌通过热处理同样可以破坏了光滑假丝酵母菌细胞壁外层结构甘露聚糖-甘露糖蛋白结构,使细胞壁内层的β-葡聚糖得以暴露从而被PRRs识别,进而启动固有免疫开始发挥抗真菌作用。
C型凝集素受体(CCRs)属于PRRs家族,C型凝集素(如MR、Dectin.1、Dectin-2、DC-SIGN、Min-cle),可以介导宿主细胞对真菌的黏附和吞噬,并激活细胞内信号通路产生抗真菌效应,包括细胞因子的产生和氧化应激。Dectin-1受体通过识别真菌细胞壁表面的β-葡聚糖,激活酪氨酸激酶(SyK)和Raf-1途径,诱导产生多种细胞因子和趋化因子如肿瘤坏死因子(TNF)-α、IL-2、IL-6、IL-10、IL-23等,在真菌的识别和免疫应答中起到重要作用,并且参与影响THl、TH17的分化[9]。本研究通过Western Blot方法检测大鼠肺组织中Dectin-1蛋白的表达量及通过回归分析影响蛋白含量的因素,可以看出真菌感染的B组和C组的大鼠Dectin-1蛋白表达量较未感染的A组明显增高,同时真菌感染的B组和C组中的蛋白表达量均随感染时间增加而增高,说明当热处理光滑假丝酵母菌感染机体后,单核/巨噬细胞、中性粒细胞等抗原提呈细胞上的Dectin-1受体通过直接识别真菌细胞壁表面的β-葡聚糖,激活机体天然免疫产生大量的细胞因子和趋化因子对抗真菌感染。而免疫抑制感染组大鼠Dectin-1蛋白表达量从感染后第1天开始就较对照组及直接感染组明显增高,肺组织病理改变更严重,并且经过回归分析得到进行免疫抑制对Dectin-1蛋白含量影响最大,提示在等量致病菌感染机体时,免疫抑制状态下的大鼠较未免疫抑制的大鼠在光滑假丝酵母菌感染早期Dectin-1通路就被更多地激活,并产生大量的炎症因子及趋化因子,诱发更强烈的肺部炎症反应。
辅助性17细胞(Th17细胞)是近年来发现的一种CD4+效应T细胞,能分泌多种细胞因子,包括IL-17、IL-21、IL-22和粒细胞巨噬细胞集落刺激因子(GM-CSF),在维持黏膜内环境稳定中起着关键作用,有助于对抗细菌和真菌等病原体的入侵[10]。IL-17具有强大的促炎作用,能促进巨噬细胞、上皮细胞和成纤维细胞产生趋化因子将吞噬细胞募集到免疫反应部位,增强机体对抗真菌感染的保护性免疫作用。在原发肺曲霉菌感染患者中,能检测到T细胞TH17型表型特异性表达[11];IL-17缺陷小鼠比正常小鼠更易患系统性念珠菌病,在白假丝酵母菌感染后,TH17细胞能在感染后早期产生IL-17,在获得性免疫建立之前发挥重要作用[12]。而IL-23不仅能刺激并维持TH17细胞分化,促进IL-17因子大量表达,同时IL-23本身还能通过记忆T细胞的扩增产生大量巨噬细胞集落刺激因子来促进单核细胞分化,与IL-17一起参与炎症反应[13]。已有研究[14-16]证实,在白假丝酵母菌感染及黄曲霉菌引起的超敏性肺炎中,Dectin-1通过诱导由IL-12的p19和p40亚基组成的IL-23等Th17驱动细胞因子来调节Th17细胞的应答。本研究通过ELISA法检测大鼠血清和肺泡灌洗液中IL-17、IL-23含量的变化,发现3个时间点均是C组IL-17及IL-23的含量最高,B组含量次之,A组含量最低且无明显变化,对血清及肺泡灌洗液中两种炎症因子含量的影响因素进行回归分析可以得出,真菌感染的B组和C组的大鼠血清及肺泡灌洗液中IL-17、IL-23两种炎症因子含量均较未感染的A高,并且B组和C组两种因子随感染时间增加而增高,同时B组和C组大鼠血清和肺泡灌洗液中IL-23的浓度均与IL-17浓度呈正相关,提示光滑假丝酵母菌模型建立成功后,IL-17、IL-23全程参与抗光滑假丝酵母菌免疫过程,并且两种炎性因子的增长趋势与Dectin-1蛋白变化趋势与文献[17-19]研究的结果一致,可以推测在大鼠侵袭性肺部光滑假丝酵母菌感染过程中,感染早期Dectin-1通路被激活后同样刺激IL-23分泌,IL-23 不仅参与诱导原始CD4+T细胞向TH17细胞分化并产生大量IL-17,之后IL-23还与IL-17共同发挥促炎作用,促进巨噬细胞、上皮细胞和成纤维细胞产生趋化因子,将吞噬细胞募集到免疫反应部位,增强机体对抗真菌感染的保护性免疫作用。
同时本实验还发现,在处于免疫抑制状态的免疫抑制感染组各时间点Dectin-1蛋白和IL-17、IL-23两种炎性因子的含量均较直接感染组高,差异具有统计学意义,同时免疫抑制感染组大鼠肺组织较直接感染组有更多的炎性细胞浸润,肺组织结构破坏更严重,推测当机体处于免疫力低下或者免疫抑制状态时,Dectin-1通路被过多激活产生更多下游炎性因子,过量表达的IL-17、IL-23募集过量炎性因子反而可能加重肺组织损伤。本研究还发现免疫抑制感染组、直接感染组大鼠肺泡灌洗液中IL-17、IL-23含量均比同组相同时间点的血清中高,结合本课题组前期对大鼠气道上皮细胞感染光滑假丝酵母菌的研究[20],推测通过气管插管给予热处理光滑假丝酵母菌感染时,大鼠气道上皮细胞首先受到感染,其Dectin-1受体最先被激活,诱发IL-23的等炎症因子释放,促使TH17细胞分化并产生IL-17,首先引起肺部感染进而引起全身炎症反应,使肺泡灌洗液中IL-17、IL-23含量高于血清,而当存在免疫抑制时,更严重的肺部炎症病变使这种差距更明显。结合上述研究结果可将对机体抗念珠菌病的炎症反应设想为双刃剑,过度增强的炎症反应反而可能加重机体损伤,因此,Dectin-1信号应由许多负性调节因子严格控制,以终止免疫和炎症反应并防止过度炎症反应发生。
综上所述,在大鼠肺部感染热处理光滑假丝酵母菌后,Dectin-1通路早期被激活并产生IL-6、IL-23等细胞因子,其中IL-23参与诱导TH17细胞分化并促进IL-17产生,之后IL-17、IL-23与Dectin-1通路产生的其他炎性因子一起共同参与抗真菌的免疫过程,并且过强的IL-17、IL-23表达还可能参与介导肺组织损伤,若能使用Dectin-1受体抑制剂可能对减轻肺部炎症有一定作用。应当指出,目前关于Th17应答的大多数结果均来自于实验动物模型,人类Th17的分化过程可能与大鼠Th17的分化不完全相同,尚需进一步研究。而本研究从分子水平探索光滑假丝酵母菌及其PRR的致病性以及宿主免疫应答过程,希望能为今后临床上侵袭性光滑假丝酵母菌的感染及免疫治疗提供新思路和理论依据。
