柱前衍生毛细管电泳-电致化学发光法测定瓜瓤组织中的瓜氨酸含量
2019-05-14王苏霞马永钧
杨 宁,周 敏,王 荣,刘 芬,王苏霞,马永钧
(西北师范大学 化学化工学院 甘肃省生物电化学与环境分析重点实验室,甘肃 兰州 730070)
瓜氨酸是一种最先从西瓜汁中发现的非蛋白类氨基酸,在一些葫芦科植物生物组织中的含量较为丰富。西瓜、甜瓜、籽瓜和哈密瓜都是我国重要的经济类作物,尤其红瓤西瓜组织内含有多种维生素、微量元素、番茄素和瓜氨酸[1-2],人们通过鲜食瓜瓤组织即可直接摄取这些营养物质从而获得保健作用[3-4]。从人体生理学角度看,瓜氨酸是人体中参与尿素代谢的一个重要中间物,适度摄入瓜氨酸可以增强人体的免疫力,促进血液循环,保护心血管;瓜氨酸还可以作为一种有效化学成分用于生产保健食品和护肤、去斑美容化妆品[5-6]。此外,瓜氨酸在一些疾病的防治方面也扮演着重要角色,可用于阿尔兹海默综合症和由暂发性脑血管缺血导致的失忆症的辅助治疗,对罹患高血压绝经妇女的主动脉硬化和肌肉机能改善也有良好的功效[7-8]。
瓜氨酸又称为氨基甲酰鸟氨酸[5],其分子结构式见图1。目前,瓜氨酸的分析方法主要有高效液相色谱法[9-10]、生物酶法[11]、气相色谱-质谱联用法[12]、荧光猝灭法[13]、间接核磁共振法[14]等。这些方法中,将瓜氨酸化学衍生化后再进行分析的方式非常普遍[9-10,12-13],样品预处理环节也相对较复杂,仪器成本高。因而简化衍生反应,尽量减少样品预处理过程中的繁琐操作,并降低整个分析过程的时间成本和仪器使用成本都是开发新方法必须考虑的因素。近年来,毛细管电泳法因具有分离效率高、分析速度快、进样量小以及分析成本低等优势,在复杂生物样品中氨基酸类化合物的定量分析方面得到了广泛应用[15-17]。
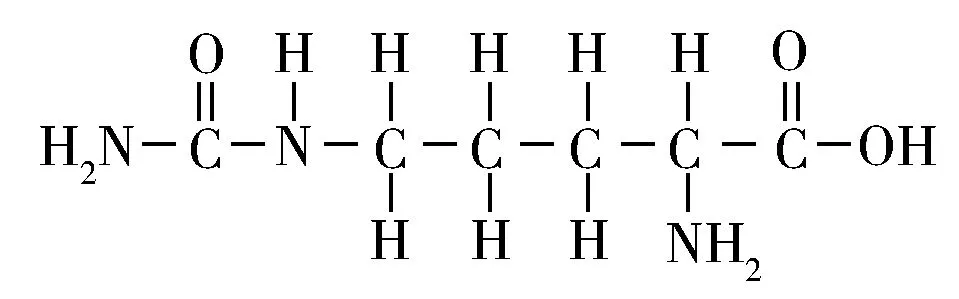
图1 瓜氨酸的化学结构式Fig.1 Chemical structure of citrulline molecule
另一方面,电致化学发光法(ECL)具有高灵敏度、高选择性和高信噪比响应等优势,毛细管电泳-电致化学发光联用分析法(CE-ECL)也得到了长足的发展[18-19]。众所周知,二氯三联吡啶合钌(Ru(bpy)3Cl2)及其衍生物是一类重要的电致化学发光探针试剂[20-22],可与胺类共发光物产生特殊的共发光效应,且胺类化合物的ECL强度按叔胺﹥仲胺﹥伯胺有依次下降的趋势[23-24]。基于该原理,本文参照此前的文献[25-26]对柱前衍生氨基酸的方法做了改进,以甲醛和硼氢化钠为主要衍生试剂,将瓜氨酸分子中与α-碳原子相连的伯氨基进行彻底N-甲基化形成叔胺基团,从而极大地增加了电致化学发光法检测瓜氨酸的灵敏度,据此建立了一种柱前衍生CE-ECL法测定瓜瓤组织中瓜氨酸含量的新方法。
1 实验部分
1.1 仪器与试剂
MPI-A型多参数分析测试系统(西安瑞迈电子科技有限公司);CHI 760B电化学工作站(上海辰华仪器公司);熔融石英毛细管(47.5 cm×75.0 μm i.d.河北永年光导纤维厂);pH-10型酸度计(德国赛多利斯);化学发光检测采用三电极系统:工作电极采用参照文献制备[27]的含稀土类普鲁士蓝(Er-PBAs)修饰的铂盘电极(Φ=0.3 mm),辅助电极为铂丝,参比电极为Ag/AgCl(1.0 mol/L KCl)电极。
L-瓜氨酸(含量>99.0%)、二氯三联吡啶钌(Ru(bpy)3Cl2·6H2O,含量>99.95%)和壳聚糖(脱乙酰度>95%)均购自百灵威科技有限公司;甲基-β-环糊精、环己烯二酸(含量>98%)(上海阿拉丁试剂有限公司);顺丁烯二酸(含量>98%,山东西亚化学工业有限公司)。其余试剂均为分析纯,实验用水为超纯水(>18 MΩ·cm)。
1.2 电泳测定条件
分析毛细管采用壳聚糖做内壁修饰处理剂[28]。将0.25 mol/L的氢氧化钠打入新毛细管内处理0.5 h后,以清水冲洗;再将含有12.0 mmol/L 十二烷基硫酸钠+10.0 mmol/L的硼酸+10.0 mmol/L的醋酸钠+4.0 mmol/L环己烯二酸+1.1 mmol/L戊二醛的混合溶液打入毛细管内,放置50 min后用氩气排空;再打入含10.0 mg/mL壳聚糖的稀冰醋酸溶液(1%,体积分数)静置1 h,用氩气排空后立即在65 ℃烘箱中加热90 min;最后用1.0 mol/L甲醛溶液和0.01 mol/L氢氧化钠溶液依次打入毛细管内并各停留数十秒后排空,再置于烘箱中以65 ℃热处理10 min,取出冷却至室温,备用。
1.3 标准溶液与试样溶液的制备与衍生步骤
配制含250 mmol/L磷酸盐缓冲溶液(pH 5.95)以及含有10%甲醇的2.00 mmol/LL-瓜氨基酸标准溶液并置于4 ℃冰箱中保存,备用。
分别称取1.000 0 g 去籽并捣碎的西瓜、甜瓜、籽瓜、哈密瓜的鲜瓜瓤样品于100 mL小烧杯中,各加入20.00 mL含有10%甲醇的蒸馏水,置于超声波器中振荡提取10 min,搅匀后静置片刻,取上层清液备用。
在10 mL比色管中先加入1.00 mL 250 mmol/L的磷酸盐缓冲溶液(pH 5.95),用移液管准确加入一定体积的瓜瓤组织浸取液或L-瓜氨酸标准溶液(要求样品的总体积< 2.0 mL),再加入0.80 mL 0.5 mol/L的甲醛溶液并用超纯水稀释至5.0 mL后于常温下反应60 min;此后,在该比色管中连续加入0.40 mL 0.2 mol/L的氢氧化钠、0.60 mL 0.01 mol/L的顺丁烯二酸和0.16 mL 0.1 mol/L的咪唑溶液,摇匀后置于 57 ℃恒温水浴中加热反应50 min;最后,向该比色管中依次加入0.25 mL 0.1 mol/L醋酸铵、1.00 mL 0.25 mol/L硼氢化钠(使用时临时配制)以及0.50 mL 0.2 mol/L的硼酸。这3种试剂的加入反应时间间隔依次保持为10、20、10 min。最后稀释至10.0 mL,取此溶液适量,经滤膜过滤后进样测定,也可于冰箱中保存,在2周内进行测定。
2 结果与讨论
2.1 L-瓜氨酸衍生产物的电致化学发光响应特征
对比L-瓜氨酸标准物及其衍生产物的CE-ECL电泳图,结果显示,未经衍生的L-瓜氨酸进样后几乎看不到任何明显的发光信号峰,而经衍生后,L-瓜氨酸样品出现了两个明显的电泳信号峰(图2)。通过加标验证实验,确定1号峰源于反应剩余甲醛的发光衍生物,而2号峰源于L-瓜氨酸衍生产物中唯一具有发光活性的组分。对比曲线a和b在峰2处的强度可知,L-瓜氨酸衍生物相比未衍生L-瓜氨酸的发光强度至少增敏了200多倍,且无其它杂质峰出现。由图1结构式可知,瓜氨酸是具有α-伯胺基的氨基酸,衍生反应将瓜氨酸分子中与α-C相连的氨基彻底N-甲基化形成含α-叔胺基的分子结构,得到ECL发光信号更强的衍生物结构,且瓜氨酸在柱前衍生反应中会发生消旋化现象[29],因此含叔胺基的衍生产物的ECL发光信号强度值将不会受到被测样品中瓜氨酸分子旋光性的影响。由此可知,通过控制柱前衍生反应条件可使L-瓜氨酸或D-瓜氨酸都转化成发光产物,得到峰形对称的单一的CE-ECL电泳峰,进而可实现对瓜氨酸总量的高选择性定量测定。
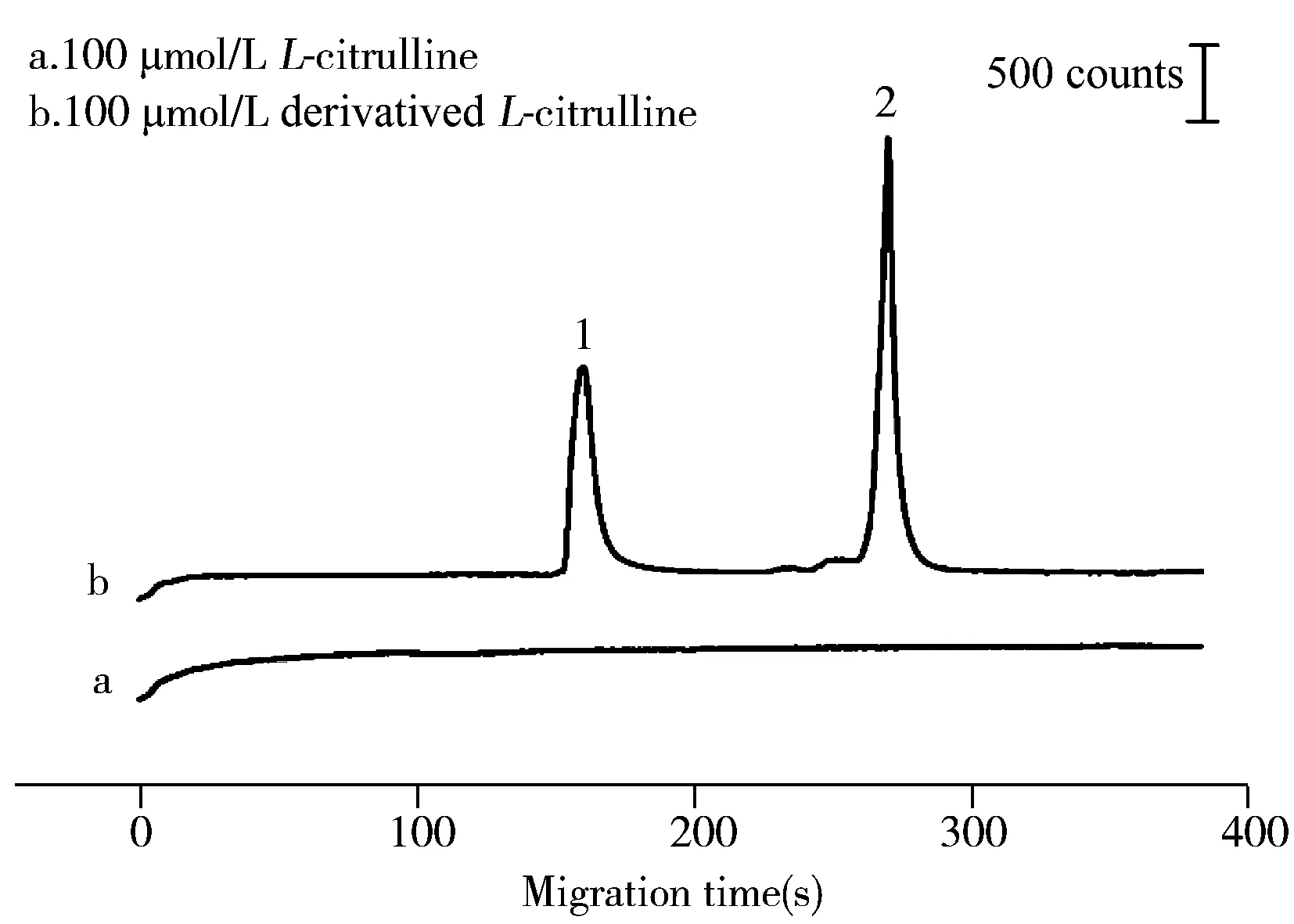
图2 L-瓜氨酸纯品(a)和L-瓜氨酸衍生物(b)的电泳图Fig.2 Electropherograms of L-citrulline(a) and its derivative product(b)ECL peak 1 and 2 are attributed to the derivative product from formaldehyde and L-citrulline,respectively
2.2 柱前衍生反应条件的优化
按照对α-伯胺基进行柱前N-甲基化衍生反应的有机反应途径[25-26],将瓜氨酸转化为含α-叔胺基的衍生产物主要分3个步骤:首先,在室温下与甲醛反应1 h使α-伯胺基通过亲核加成形成氨基醇中间体;其次,通过加入NaOH将体系的pH值调至7.5左右,使氨基醇中间体在57 ℃的恒温水浴中脱水形成亚胺中间体;第3步是将亚胺中间体再用硼氢化钠化学还原成氨基酸的N-甲基化衍生产物。实验过程中发现,体系的pH值和脱水温度对瓜氨酸衍生物的ECL峰高和峰形都有较大的影响。因此,本研究以100 μmol/L的L-瓜氨酸标准样进行柱前衍生反应制备测试样,再根据其CE-ECL电泳图的峰强度值对NaOH的加入量和衍生反应温度进行优化。
2.2.1 氢氧化钠加入量的优化实验发现,当加入的NaOH为0.08 mmol时,L-瓜氨酸衍生物的CE-ECL峰强度最大,此时体系的pH值为7.5,L-瓜氨酸衍生物电泳峰的峰形对称,半峰宽值最小。而当NaOH加入量大于0.08 mmol时,电泳峰强度下降且L-瓜氨酸衍生物的电泳峰出现分叉、峰形展宽的现象。因此选择加入0.08 mmol 的NaOH。
2.2.2 衍生反应温度的优化在整个衍生反应过程中,适当的脱水温度有利于亚胺中间体的生成,且不会过多产生其它的副反应中间体。实验结果显示,当衍生反应温度控制在57 ℃左右时,L-瓜氨酸衍生物的电泳峰峰强度达到最大;而继续升高反应温度时,其发光强度有所减小。更重要的是,若以过高的温度进行L-瓜氨酸衍生反应,会出现多个具有不同迁移时间的新发光信号峰,即有多个发光的副产物形成,进而将造成被测试样中L-瓜氨酸初始浓度值与其衍生产物ECL强度值之间的线性响应关系发生偏离。由此,确定最佳的衍生反应温度为57 ℃。
2.2.3 电泳分离添加剂的优化由于瓜瓤组织的化学成分比较复杂,有其它氨基酸类物质存在,为保证瓜氨酸衍生产物的电泳峰不受共存杂质的干扰,本实验采用壳聚糖内壁修饰毛细管为分离毛细管,并在分离运行液中添加多种分离添加剂,以保证瓜氨酸的衍生峰与相邻杂质峰能达到基线分离。图3的内插图是实际籽瓜样品的柱前衍生CE-ECL电泳图,可见该籽瓜样品中瓜氨酸衍生物电泳峰的峰形尖锐、峰高明显、出峰时间适宜,且与其它成分电泳峰之间的分离效果良好。以此实际样品为测试物,对实际运行液中各添加组分的最佳浓度值进行优化。最终选取32.0 mmol/L硼砂缓冲溶液(pH 8.0)为基本缓冲溶液,再添加5.0 mmol/L的SDBS、9.0 mmol/L的STPP、3.5 mmol/L的β-甲基-环糊精和4 %的甲醇组成分离运行缓冲溶液。需要注意的是,由于运行缓冲溶液中SDBS的加入量对待测物发光强度和分离度影响较大,须精确控制其加入量至5.0 mmol/L。
2.2.4 柱前衍生电致化学发光法测定瓜氨酸的分析性能在上述优化实验条件下,用不同浓度的L-瓜氨酸标准溶液进行柱前衍生,再分别纪录其CE-ECL电泳图。实验结果表明:当瓜氨酸反应初始浓度为9.0~250 μmol/L时,其衍生物的电泳峰强度值与浓度之间呈现良好的线性关系,线性回归方程为IECL=-42.3+29.9ccitrulline(r2=0.999 6),计算得检出限为3.2 μmol/L(S/N=3)。该结果明显优于采用毛细管电泳-紫外吸收光谱联用检测法(CE-UV-Vis)的灵敏度[15]。此外,对含100 μmol/LL-瓜氨酸的衍生标样平行进样6次,测得其电泳峰强度值和迁移时间值的相对标准偏差分别为2.6%和0.92%,表明本法的精密度良好。

图3 用标准加入法测定实际瓜瓤样品的CE-ECL电泳图Fig.3 Electropherograms of a real melon sample by using the standard addition method spiked L-citrulline(a-e):0.0,40,80,120,160 μmol/L
2.3 实际样品测定
实际籽瓜样品的加标实验结果如图3所示。在籽瓜瓜瓤样品中加入不同量的L-瓜氨酸标准溶液并进行柱前衍生后,分别纪录其CE-ECL电泳图,仅发现2号峰位置处各加标样的电泳峰强度值随着加标量的增加而逐渐增大,且此电泳峰的迁移时间和峰形均基本保持稳定,无其他干扰峰或杂质峰出现。
采用标准加入法对一组样品如西瓜、籽瓜、甜瓜、哈密瓜4种瓜瓤组织中的瓜氨酸分别进行定量测定,并将测得值按瓜瓤组织鲜重为计量单位进行换算,结果见表1。可知上述几种瓜瓤组织中瓜氨酸含量略有不同,其中西瓜瓤中瓜氨酸含量为最高,鲜重含量达到2.75 mg/g,与文献报道值完全符合[12]。另取一组实际样品进行加标回收实验,得其加标回收率为91.4%~106%。表明用本法测定瓜氨酸的精密度和回收率均令人满意。

表1 几种实际样品中瓜氨酸含量的测定结果Table 1 Determination results of citrulline content in the several real samples
3 结 论
本文基于N-甲基化衍生反应可将瓜氨酸分子中的α-伯氨基成功转化为α-叔氨基,从而极大增加其电致化学发光检测灵敏度的分析原理,利用壳聚糖内壁修饰毛细管为分离毛细管并辅以分离添加剂,成功建立了柱前衍生毛细管电泳-电致化学发光法测定瓜氨酸含量的通用性分析方法。实验证明:此衍生方法简单、易操作,衍生产物单一、稳定,经过衍生的瓜氨酸的ECL强度能提高200余倍。同时,该测定方法还具有选择性好、灵敏度高、衍生试剂价格低廉等优点,完全适用于不同种类瓜瓤组织中瓜氨酸含量的分析。
