直立冬青愈伤组织诱导及其分化研究
2019-05-13杨玉洁张德健张冬林
杨玉洁,张德健,张冬林
(1.长江大学,湖北 荆州 434025;2.乔治亚大学,美国 乔治亚 雅典 30602)
直立冬青Ilex crenata‘Sky Pencil’为冬青科冬青属齿叶冬青的选育品种之一,为常绿灌木,外形别具一格,枝叶繁茂,分枝多且直立向上,无需修剪便可自然成柱形。在园林绿化中,是省工省地、耐寒耐旱且适种范围广的优良庭院观赏和绿化节约型树种[1]。但冬青属植物种子发芽十分困难,由于坚硬的种皮和未成熟合子胚的双重休眠,致使种子具有隔年发芽的特性,且常规播种繁殖生长缓慢,后代形状分离,不能保持母本的优良性状[2]。因此,为了克服远缘杂交不亲和性,获得远缘杂交品种,打破种子休眠,缩短其育种周期,采用组织培养技术进行直立冬青种苗的快速繁殖,对直立冬青的推广利用具有一定的实践意义。
利用组织培养等技术可以在短时期内获得大量的优良无性系植株,有关冬青属植物的组织培养已取得了一定的成果。尽管冬青属其他种植物的组织培养已有报道,如Ilex khasiana[3]、光滑冬青Ilex glabra[4]、Ilex dumosa[5]、巴拉圭冬青Ilex paraguariensis[6-8]、欧洲冬青Ilex aquifolium[9]、红果冬青Ilex purpurea[10]、大叶冬青Ilex latifolia[11]、金叶日本冬青Ilex crenata[12]、 北美冬青Ilex verticillata[13-14]、铁冬青Ilex rotunda[15]等,但是以直立冬青幼胚为外植体,诱导愈伤组织及不定芽,获得完整植株的方法未见报道。本研究通过对直立冬青未成熟合子胚的诱导培养,获得诱导愈伤组织和分化不定芽的最佳植物生长调节剂的配比和最佳采种时间,以期为直立冬青的快速繁殖提供参考,更为进一步建立遗传再生体系和工厂化育苗提供坚实的基础。
1 材料与方法
1.1 试验植物材料
采集直立冬青果实作为试验材料,将直立冬青的果实用流水冲洗20 min,去除表面污垢。转移至超净工作台上,放入无菌烧杯中,用无菌水润洗1 次。种子的表面消毒先用75%的酒精浸泡5 min,再用8%次氯酸钠浸泡15 min,最后用无菌水冲洗5 ~6 次,放入无菌水中待用。通过对果实表面进行消毒处理后,对果实进行解剖,获得幼胚,即试验的外植体。
1.2 试验方法与设计
1.2.1 愈伤组织诱导培养基的选择
从美国乔治亚大学园艺农场采集8年生直立冬青苗木的成熟果实,置于透明封口袋中,带回实验室。对外植体成熟果实进行表面消毒灭菌。将消毒灭菌好的种子置于立体显微镜下进行解剖,取出幼胚。将幼胚置于不同基本培养基(1/4 MS、1/2 MS、MS 和WPM)上,封好封口膜后置于培养箱内进行暗培养。基本培养基均添加0.1 mg/L 6-BA、1.5 mg/L 2,4-D、30 g/L 蔗糖和6.5 g/L 琼脂;在加入琼脂前,用氢氧化钠或盐酸将pH 值调至5.8±0.05。将配制好的培养基放入高温灭菌锅灭菌40 min。每个处理3 个6 cm 的培养皿,每个培养皿放4 个幼胚,重复3 次,共144个幼胚。4个星期后,统计愈伤组织启动率及褐化率。
1.2.2 不同生长素及质量浓度对幼胚的影响
在筛选出来的最适基本培养基上,添加2,4-D、NAA 和IBA 3 种生长激素,探讨不同生长激素的种类和质量浓度对幼胚的影响。2,4-D、NAA 和IBA 3 种生长激素均设置4 个水平,分别为0.1、0.5、1.0 和2.0 mg/L,以不添加任何生长激素作为对照(CK),共13 个处理。每处理3 个培养皿,每皿4 个幼胚,重复3 次。30 d 后统计幼胚生长情况。
1.2.3 不同细胞分裂素及质量浓度对幼胚的影响
在筛选出来的最适基本培养基上,添加6-BA、KT、ZT、TDZ 和2-ip 5 种细胞分裂素,探讨不同细胞分裂素的种类和质量浓度对幼胚的影响。6-BA、KT、ZT、TDZ 和2-ip 5 种细胞分裂素均设置4 个水平,分别为0.1、0.5、1.0 和2.0 mg/L,以不添加任何细胞分裂素作为对照(CK),共21个处理。每处理3 个培养皿,每皿4 个幼胚,重复3 次。30 d 后统计幼胚生长情况。
1.2.4 果实的不同成熟阶段对愈伤组织诱导的影响
该试验采集不同时间段的直立冬青果实作为试验材料,消毒灭菌后,在立体显微镜下解剖果实种子,取出幼胚接种于筛选出的最适愈伤基本诱导培养基上。采种时间分别是2014年7月15日、8月15日、9月15日、10月15日。共4 个处理,每处理9 个幼胚,重复3 次。试验结果均在接种6周后统计愈伤组织诱导率和污染率。
1.2.5 不同生长素及质量浓度对幼胚愈伤组织分化的影响
将经过初代诱导出的愈伤组织切成约1.0 cm× 1.0 cm 的小块,接种到含2,4-D、NAA、IBA 3 种生长素的分化培养基上分化不定芽。分化基本培养基为:1/4 MS+3% 蔗糖+0.65% 琼脂。试验设计均设置4 个质量浓度水平,分别为0.1、0.5、1.0和2.0 mg/L,以不添加任何生长激素作为对照(CK)共13个处理。每处理9瓶,每瓶接种3块,重复3次。40 d 后统计分化情况。
1.2.6 不同细胞分裂素及质量浓度对幼胚愈伤组织分化的影响
在基本分化培养基1/4 MS + 3%蔗糖 + 0.65% 琼脂上,添加6-BA、KT、ZT、TDZ 和2-ip 5 种细胞分裂素,探讨不同细胞分裂素的种类和质量浓度对幼胚愈伤组织分化的影响。6-BA、KT、ZT、TDZ 和2-ip 5 种细胞分裂素均设置4 个水平,分别为0.1、0.5、1.0 和2.0 mg/L,以不添加任何细胞分裂素作为对照(CK),共21 个处理。每处理3 个培养皿,每皿4 个幼胚,重复3 次。40 d后统计愈伤组织分化情况。
1.3 数据统计与分析
所有试验采用完全随机区组设计。采用Microsoft Excel 和SAS 统计分析软件进行分析。
相关指标的统计方法如下:
污染率=(污染的株数/接种总数)×100%;
褐化率=(褐化的株数/接种总数)×100%;
存活率=(存活的株数/接种的株数)×100%;
发芽率=(发芽的株数/存活的总株数)×100%;
愈伤组织诱导率=(诱导出愈伤组织数/接种 的株数)×100%;
分化率=(分化的株数/存活的总株数)×100%。
2 结果与分析
2.1 基本培养基对幼胚诱导愈伤组织的影响
直立冬青幼胚接种于不同诱导基本培养基上,培养4 周后,对愈伤组织诱导率进行统计,结果见图1所示。
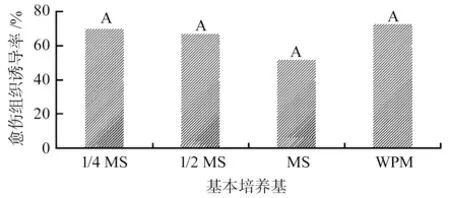
图1 基本培养基对直立冬青幼胚诱导愈伤组织的影响Fig.1 Effect of basic medium on Ilex crenata callus induction in immature embryos
由图1可知,4 种培养基均可以诱导直立冬青幼胚长出愈伤组织,1/4MS、1/2MS、MS 以及WPM 培养基的愈伤组织诱导率分别为69.44%、66.67%、51.39%、72.22%;这4 种培养基之间的愈伤组织诱导率并不存在显著差异,且诱导出的愈伤组织均呈透明色,质地松软。由此可见,直立冬青幼胚诱导愈伤组织的成功率极高,有利于快速繁殖技术的生产应用。
2.2 不同植物生长激素及质量浓度对幼胚的影响
以未成熟幼胚作为外植体,接种于附加2,4-D、NAA、IBA 3 种植物生长激素不同质量浓度的1/4MS 培养基上,研究不同生长激素对幼胚生长的影响。30 d后,统计发芽率、愈伤组织诱导率,结果见表1。
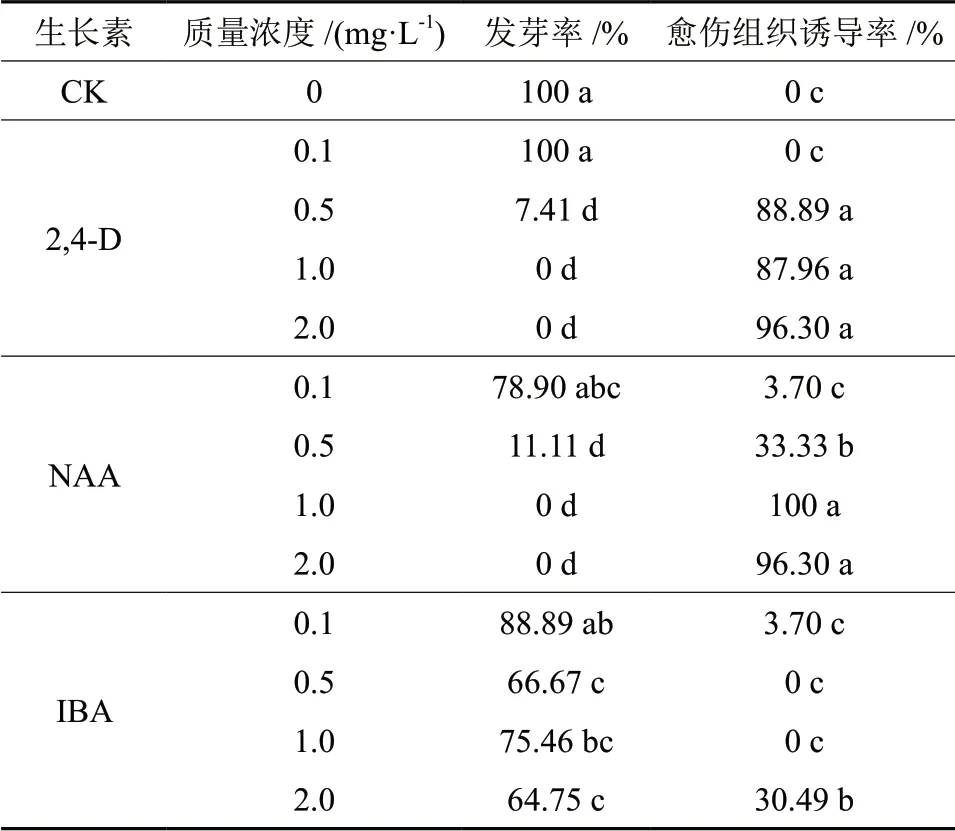
表1 植物生长激素对直立冬青子代幼胚的影响†Table1 Effect of auxins on embryo of I.crenata seedlings
从表1可以看出,2,4-D、NAA、IBA 3 种生长素对幼胚的发育具有一定的影响,对幼胚的发育方向起着不同的引导作用。从发芽率来看,发芽率最高的处理是对照和0.1 mg/L 2,4-D,为100%;其次为0.1 mg/L IBA,为88.89%;第三为0.1 mg/L NAA,为78.89%。因此,低质量浓度的生长素有利于未成熟合子胚的发芽。以3 种生长素来看,2,4-D 和NAA 的发芽率趋势是随着生长素质量浓度的增加,其发芽率逐渐降低;而IBA的发芽率与质量浓度之间的关系并没有明显的规律可循,发芽率均在60%以上,促进幼胚发芽的效果比较稳定。由此可见,幼胚的发芽不需要外源生长素的调节。从愈伤组织诱导率来看,未添加生长素(对照)的处理,未成熟合子胚愈伤组织诱导率最低,仅为0,与2,4-D 0.1 mg/L、NAA 0.1 mg/L 和IBA0.1 ~1.0 mg/L 处理的愈伤组织诱导率不存在差异显著性,与其它的处理都存在差异显著性。随着2,4-D 质量浓度的增加,愈伤组织的诱导率也随着升高。2,4-D 质量浓度为2.0 mg/L 时,未成熟合子胚的愈伤组织诱导率最高,为96.3%。随着NAA 质量浓度的增加,愈伤组织的诱导率呈现先升后降的趋势。说明低质量浓度和高质量浓度的NAA 对幼胚愈伤组织的诱导都有抑制作用,但是NAA 质量浓度为1.0 mg/L和2.0 mg/L 时,愈伤组织的诱导率都高达90%以上,分别为100%和96.3%,两者之间不存在显著性差异。IBA 质量浓度为2.0 mg/L 时,愈伤组织的诱导率最高,为30.49%。与其余2 种生长素相比,IBA 对未成熟合子胚的愈伤组织的诱导作用并不明显。因此,当基本诱导培养基上添加2,4-D 0.5 ~2.0 mg/L 或者NAA 1.0 mg/L 和2.0 mg/L 时,最 有利于幼胚愈伤组织的诱导。
2.3 不同细胞分裂素及质量浓度对幼胚愈伤组织诱导的影响
以未成熟合子胚作为外植体,接种于添加6-BA,KT,ZT,TDZ 和2-ip 5 种细胞分裂素的1/4MS 培养基上,研究探讨不同细胞分裂素的种类和质量浓度对幼胚生长的影响。30 d 后,统计发芽率、愈伤组织诱导率,结果见表2。
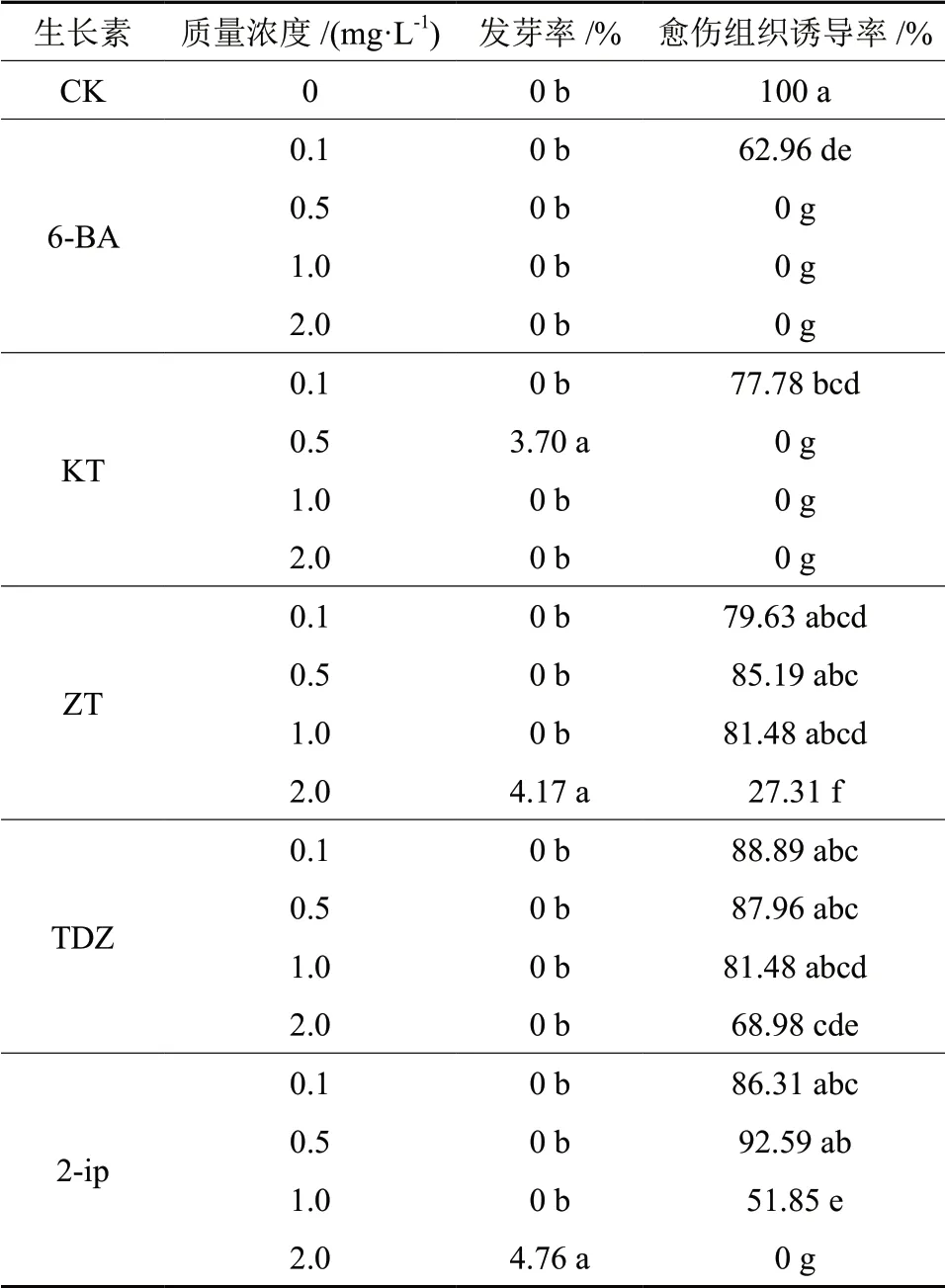
表2 细胞分裂素对直立冬青子代幼胚的影响Table2 Effect of cytokinins on embryo of I.crenata
从表2可知,从6-BA、KT、ZT、TDZ 和2-ip 5 种细胞分裂素4 个质量浓度水平的愈伤组织诱导结果来看,只有KT0.5 mg/L、ZT 2.0 mg/L 以及2-ip2.0 mg/L 诱导出了愈伤组织,虽然愈伤组织的诱导率并不高,但是与其他处理具有显著性差异。从发芽率来看,未添加任何细胞分裂素的对照,发芽率最高,为100%。6-BA 以及KT 质量浓度为0.1 mg/L 时,发芽率分别为62.96%和77.78%,其他质量浓度均未出现萌发现象。由此可知,6-BA和KT 对幼胚的萌发具有抑制作用。随着ZT 质量浓度的增加,发芽率呈现先升后降的趋势。当ZT 质量浓度为0.5 mg/L 时,发芽率达到最高,为85.19%,与质量浓度为2.0 mg/L 时差异显著。随着TDZ 质量浓度的增加,发芽率逐渐降低,但4 个质量浓度水平之间差异并不显著。发芽率随着2-ip 质量浓度的增加呈现先升后降的趋势,较低质量浓度的2-ip 对发芽率的抑制作用较小。质量浓度越高,抑制作用越大。由此可见,细胞分裂素对幼胚愈伤组织的诱导以及发芽率均没有积极的促进作用。一般情况下,细胞分裂素通常与生长激素搭配使用,才能发挥其促进细胞分裂和控制形态发生的作用。
2.4 果实的不同成熟阶段对愈伤组织诱导的影响
将不同采种时间的幼胚外植体置于1/4MS 培养基上,添加0.1 mg/L 6-BA+1.5 mg/L 2,4-D,6 个星期后,统计愈伤组织的诱导率和污染率,所得的结果见表3。随着采种时间的推移,果实颜色逐渐加深,果实逐渐成熟,污染率也逐渐升高,愈伤组织诱导率呈现先升后降的趋势。9月与10月份采集的果实,污染率与7月和8月的果实存在显著差异。愈伤组织诱导率的最高值出现在8月,高达100%,与7月和10月的愈伤诱导率之间的差异显著。
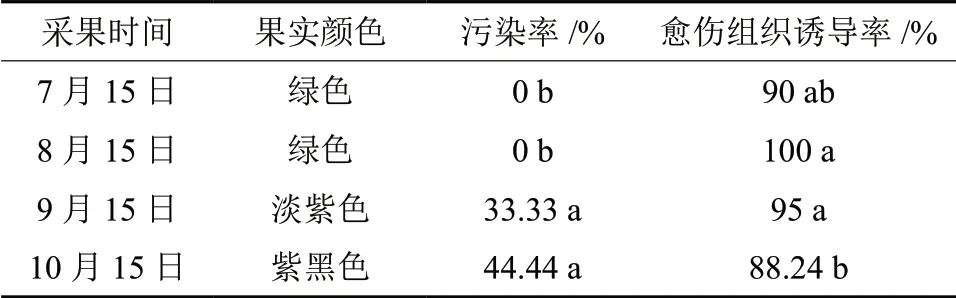
表3 果实的不同成熟阶段对愈伤组织诱导的影响Table3 Effect of harvest time on callus induction of I.crenata
2.5 不同生长素及质量浓度对幼胚愈伤组织分化的影响
诱导出的愈伤组织培养30 d 后,培养基的养分和水分都不充分,需要将愈伤组织进行继代培养。继代时剔除死去和生长状况不好的组织,将细胞生长旺盛的组织切成约1.0 cm2的小块接种在与原来培养基成分相同的新的培养基中,直至愈伤组织结构和形态趋于稳定,再转接至分化培养基上进行分化培养。挑取结构疏松、未褐化、生长状况良好的愈伤组织,分别将其转入添加2,4-D、NAA、IBA 3 种生长素的培养基上,试验结果见表4。
由表4可知,愈伤组织在添加不同生长素的分化培养基上能分化出不定芽,其中分化率最高的是添加生长素2,4-D 0.5 mg/L 处理,达到了70.37%,与其他处理具有显著性差异;其次是在NAA 质量浓度为0.5 mg/L 时,分化率为48.15%。当在分化培养基上添加2,4-D 时,在较低(0.1 mg/L)和较高质量浓度(2.0 mg/L)的情况下,未见有愈伤组织的分化。在NAA 质量浓度为1.0 mg/L 时,出现分化,但分化率不高,仅为3.5%;随着NAA 质量浓度的增加,分化率呈现先升后降的趋势;在质量浓度为0.5 mg/L 时,达到最高,为48.15%。在添加IBA 的分化培养基上,均出现分化芽,但是分化率不高。
2.6 不同细胞分裂素及质量浓度对幼胚愈伤组织分化的影响
将经过继代培养过的生长状况良好的愈伤组织转接至添加6-BA、KT、ZT、TDZ 和2-ip 的分化培养基上,经过30 d 的培养,结果如表5所示。
由表5可知,愈伤组织在添加不同细胞分裂素的分化培养基上能够分化出不定芽,最高分化率出现在ZT 质量浓度为2.0 mg/L 时,为58.15%,与其他处理之间存在显著性差异;其次为6-BA 质量浓度0.1 mg/L,分化率为37.04%。分化率随着6-BA 质量浓度的增高呈现逐渐降低的趋势,而TDZ 反之,呈现逐渐升高的趋势。KT 只有在质量浓度为0.1mg/L 时出现了分化,其他处理的愈伤组织均未出现分化。
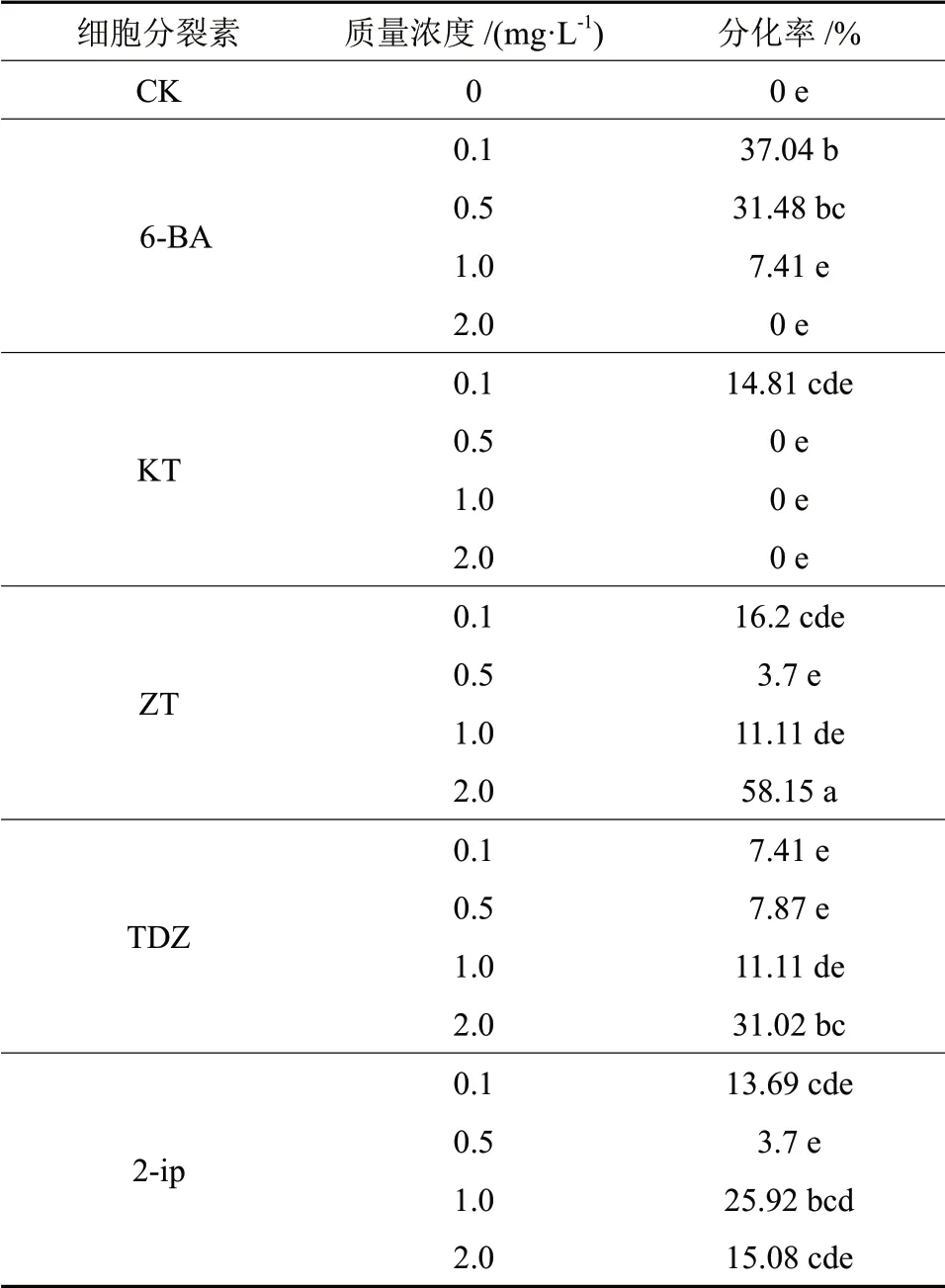
表5 不同细胞分裂素及浓度对幼胚愈伤组织分化的影响Table5 Effects of cytokinins source and concentration on callus differentiation
3 结论与讨论
在植物组织培养过程中,基本培养基的选择对其诱导分化以及器官再生都至关重要。因此,在本试验中采用4 种基本培养基对直立冬青未成熟合子胚进行愈伤组织诱导,而试验结果表明基本培养基并不影响对直立冬青未成熟合子胚的愈伤组织诱导。这一结果与轮生冬青[14]、铁冬青[15]的基本培养基的选择结果不同,与直立冬青[16]萌发结果一致,可能是由于轮生冬青与铁冬青组培所用外植体为茎段,而本试验所用外植体为未成熟合子胚。
在本试验中,果实的采种时间以及植物生长调节剂对直立冬青未成熟合子胚愈伤组织的诱导起着重要作用。7、8月份取材的外植体的污染率比9、10月份的高,愈伤组织诱导率在10月份时低于其他处理。由此可见,当果实达到成熟时,果皮、果肉疏松,空气增多,细菌和病菌极其容易进入,导致表面消毒灭菌困难,污染率高。冬青幼胚存在生理后熟现象,当果实成熟,幼胚仍然处于心形胚阶段,随着果实的成熟,胚乳失水逐渐紧致,未成熟合子胚进入休眠阶段。因此,促使未成熟合子胚启动会愈加困难,愈伤组织诱导率稍低于其他处理。
植物生长调节剂被广泛地应用于植物组织培养中,通常是营养基质的组成部分。在细胞水平上,生长素控制着基础生长,例如细胞的分裂和细胞的伸长生长。培养基中加入生长调节剂可以改变和影响外植体的内源激素水平,从而导致外植体在添加不同质量浓度植物生长调节物质的培养基中产生诱导分化能力上的差异[17]。在本试验中,当基本诱导培养基上添加生长素2,4-D 质量浓度为0.5 ~2.0 mg/L 或者NAA 质量浓度为1.0 mg/L和2.0 mg/L 时,最有利于未成熟合子胚愈伤组织的诱导。而细胞分裂素单独使用时,对未成熟合子胚愈伤组织的诱导不能起到积极作用。直立冬青未成熟合子胚愈伤组织的分化培养试验表明,在培养基1/4MS+0.5 mg/L 2,4-D上的分化率最高,达70.37%。在添加细胞分裂素2.0 mg/LZT 的培养基上,分化率最高,达到了58.15%。
本研究中,虽然单种植物生长调节剂对直立冬青的愈伤组织诱导和分化都获得了较好的效果,但是植物的生长发育通常都是多种激素共同作用的结果,因此,优化培养基中植物生长调节剂的配比将是进一步深入研究的重点。
