从VEGF和sVEGFR2探究分子靶向药物舒尼替尼治疗转移性肾癌的机制
2019-05-06刘畅,张宁
刘 畅,张 宁
(1.鹤壁市人民医院泌尿外科,河南鹤壁 458030;2.北京大学肿瘤医院泌尿外科,北京 100020)
肾细胞癌是泌尿外科常见恶性肿瘤,发病率在泌尿生殖系统肿瘤中排名第二[1]。该病起源于肾脏中泌尿小管上皮系统,发病随年龄增加[2];男性发病率高于女性,多发于40至55岁的男性患者[3];主要临床表现为血尿、发热、贫血、肿块和腰疼等[4]。目前发病机制尚不明确,可能与职业、生活习惯、饮食及其他疾病相关[5],临床治疗手段有手术治疗、化学治疗、免疫治疗和分子靶向治疗[6]。靶向治疗已成为转移性肾癌的有效辅助治疗手段,可提升患者的生存率[7]。激酶抑制剂舒尼替尼(Sunitinib)是临床最常见的治疗肾癌的药物[8],其治疗晚期肾癌的药物,作用机制明确。而肾门淋巴结对肾癌的转移有指示性意义。本研究通过血管内皮生长因子(vascular endothelial growth factor,VEGF)和可溶性血管内皮生长因子受体2(solubility vascular endothelial growth factor receptor 2,sVEGFR2)两种生物标志物,解析分子靶向药物Sunitinib在治疗转移性肾癌过程中的作用机制,探究分子靶向治疗过程的关键因素。
1 资料与方法
1.1 一般资料选取2015年6月至2017年6月间在鹤壁市人民医院泌尿外科住院治疗的100例转移性肾癌患者作为研究对象,按照不同治疗方案,分为服用Sunitinib辅助治疗组(Sunitinib组,n=50)和未服用Sunitinib辅助治疗组(不服药组,n=50)。
1.2 纳入和排除标准纳入标准:① 年龄40~60岁的患者;②根据WHO《肾细胞癌的病理分类和诊断标准(2004版)》[9]确诊为转移性肾癌;③经影像学/病理学确认已转移并至少有1处可测量病灶,TNM分期为T1~3N0~1M0期;④Karnofsky功能状态评分[10]在60~90分之间;⑤未接受过系统治疗。排除标准:①心、肝、肾等重要脏器功能衰竭或移植者;②严重自身免疫性疾病者;③伴有其他恶性肿瘤者;④过敏体质及对研究用药过敏者;⑤有认知功能障碍或精神异常,无法配合完成研究者。伦理学考量:①患者签署参知情同意书;②保障患者的医疗安全和隐私权;③试验遵循《渥太华工作组关于临床试验注册的声明》。
1.3 服药情况Sunitinib(美国辉瑞公司,批准文号:H2013025,规格:12.5 mg×28 s)按照标准的4/2治疗方案,每天1次口服50 mg,服药4周停药2周为1个周期[11]。每周评估患者的不良反应,根据具体情况给予药物减量至下一剂量水平或停药。
1.4 疗效评价治疗4个周期后进行评价,直至治疗结束。按实体瘤疗效评价标准(response evaluation criteria in solid tumour,RECIST)进行评价。完全缓解(complete regression,CR):所有靶病灶消失;部分缓解(partial regression,PR):靶病灶最长径之和与基线状态比较,缩小≥ 30%;病变进展(progressive disease,PD):靶病灶最长径之和与治疗开始后所记录到的最小靶病灶最长径之和比较,增加≥20%,或者出现1个或多个新病灶。病情稳定(stable disease,SD):缩小未达PR,增加未达PD。
1.5 评估治疗后的不良反应情况根据肿瘤化疗药物不良反应评价标准[12](Common Terminoloy Criteria adverse Events Version 3.0,CTCAE v3.0),评估电解质紊乱、发热、肾功能减退、胃肠道反应(恶心、腹泻、呕吐)、中重度贫血、左室射血分数降低等不良反应。
1.6 VEGF和sVEGFR2检测使用VEGF和sVEGFR2试剂盒(美国RB公司),按照试剂盒说明书进行严格操作,使用ELISA方法,检测患者血清中两种生物标记物的浓度。检测使用多功能酶标仪进行(日本Thermo公司),检测波长450 nm,每个样品进行6次重复试验,计算平均值,利用不同生物标记物的标准曲线测定不同标记物的浓度。
1.7 测量肾癌转移前哨淋巴结(hilar lymph nodes,HLN)的数值采用电子计算机断层扫描(computed tomography,CT)测量肾癌转移前哨淋巴结HLN的总径值,推测病灶的缩小比例。

2 结 果
2.1 受试者一般情况首先,对本研究中的各组受试者的一般情况进行比较,结果显示两组患者的年龄、性别比例、体质量指数(body mass index,BMI)和病程均无统计学差异(P0.05)。此外,研究过程中所有受试者均完成了全部试验,无中途退出者,亦无改用其他疗法者(表1)。
表1 受试者一般情况(n=100)
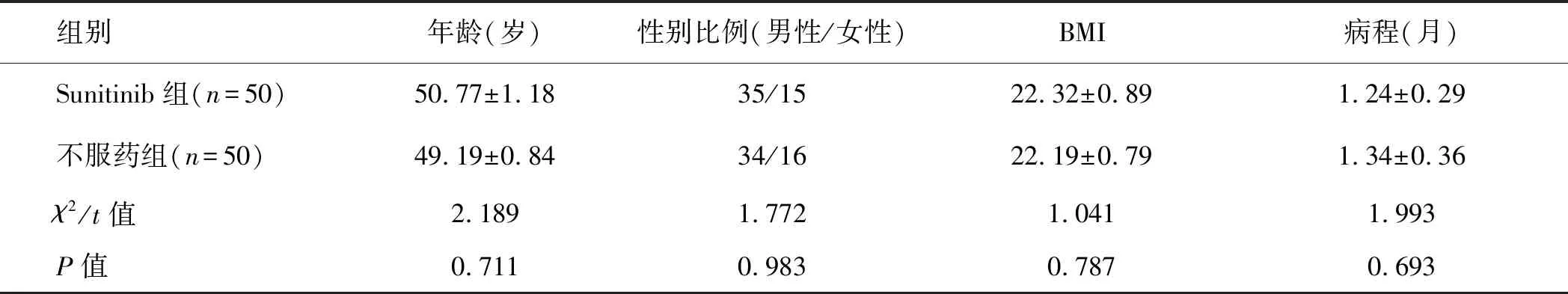
BMI:体质量指数。
2.2 受试者治疗效果比较Sunitinib组患者的治疗效果中,完全缓解的例数和比例为8/50(16%),部分缓解的例数和比例为21/50(42%),病情稳定的例数和比例为20/50(40%),病变进展的例数和比例为1/50(2%);不服药组患者中,治疗效果完全缓解的例数和比例为1/50(2%),部分缓解的例数和比例为3/50(6%),病情稳定的例数和比例为9/50(18%),病变进展的例数和比例为37/50(74%)。Sunitinib组患者的治疗效果高于不服药组患者(P<0.05,表2)。
表2 受试者治疗效果比较[例(%)]

2.3 患者并发症发生的情况Sunitinib组中的获益组、非获益组与不服药组的并发症有明显差异(P<0.05),获益组、非获益组患者主要存在电解质紊乱、发热、肾功能减退、胃肠道反应(恶心、腹泻、呕吐)、中重度贫血、左室射血分数降低等不良反应(表3)。
表3 患者并发症发生的情况[n(%)]
2.4 受试者生物标记物水平比较获益组患者比非获益组和不服药组的VEGF水平升高、sVEGFR2水平降低,这表明VEGF和sVEGFR2是Sunitinib治疗转移性肾癌患者过程中的关键参数(P<0.05,表4)。
表4 受试者生物标记物水平变化值的比较(n=50)
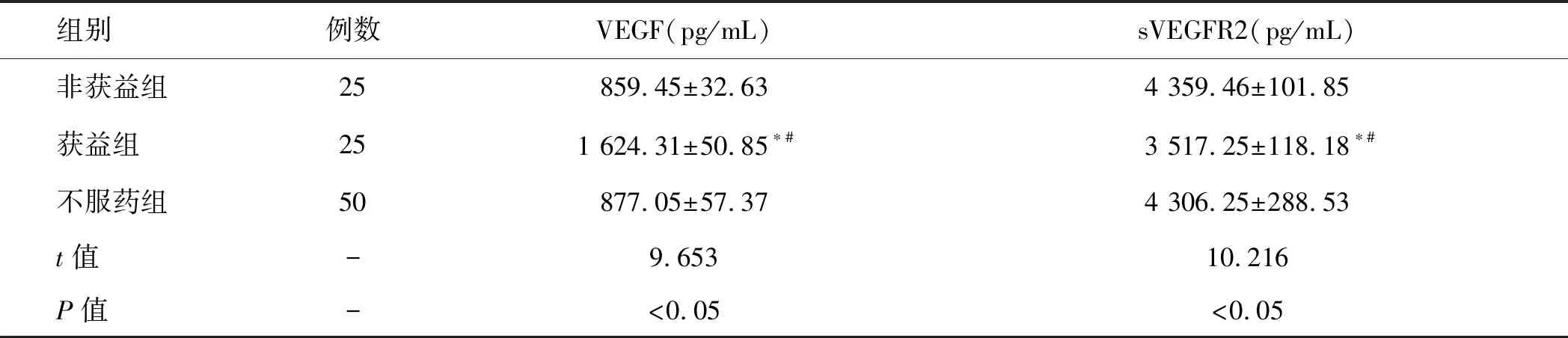
VEGF:血管内皮生长因子;sVEGFR2:可溶性血管内皮生长因子受体2;与非获益组比较,*P<0.05,与不服药组比较,#P<0.05。
2.5 受试者肿瘤转移灶(HLN)与生物标记物浓度的相关性分析
2.5.1治疗前 Sunitinib组患者的HLN与VEGF的相关系数-0.996,P值为0.015,与sVEGFR2的相关系数为0.984,P值为0.018;不服药组患者的HLN与VEGF的相关系数0.101,P值为0.829,与sVEGFR2的相关系数为0.484,P值为0.528。结果表明,HLN与VEGF呈负相关(P<0.05),与sVEGFR2呈正相关(P<0.05,表5)。
表5 受试者治疗初期肿瘤转移灶与生物标记物浓度的相关性分析(n=50)
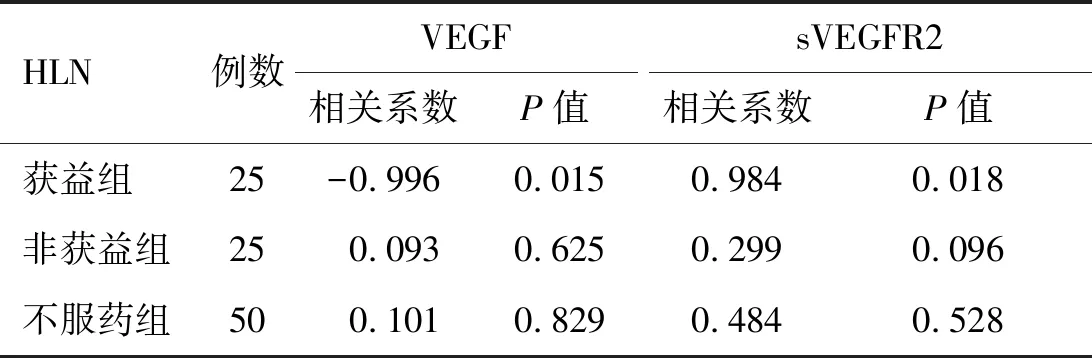
HLN:前哨淋巴结;VEGF:血管内皮生长因子;sVEGFR2:可溶性血管内皮生长因子受体2。
2.5.2治疗后 舒尼替尼治疗晚期肾癌的临床缓解率为36.00%。治疗后,Sunitinib组患者的HLN与血管内皮生长因子的相关系数-0.931,P值为0.059,与可溶性血管内皮生长因子受体2的相关系数为0.802,P值为0.218;不服药组患者的HLN与血管内皮生长因子的相关系数0.185,P值为0.814,与可溶性血管内皮生长因子受体2的相关系数为0.384,P值为0.611。结果表明,HLN与血管内皮生长因子水平呈负相关(P<0.05),与可溶性血管内皮生长因子受体2无相关性(P0.05,表6)。
表6 受试者治疗末期肿瘤转移灶与生物标记物浓度的相关性分析(n=50)
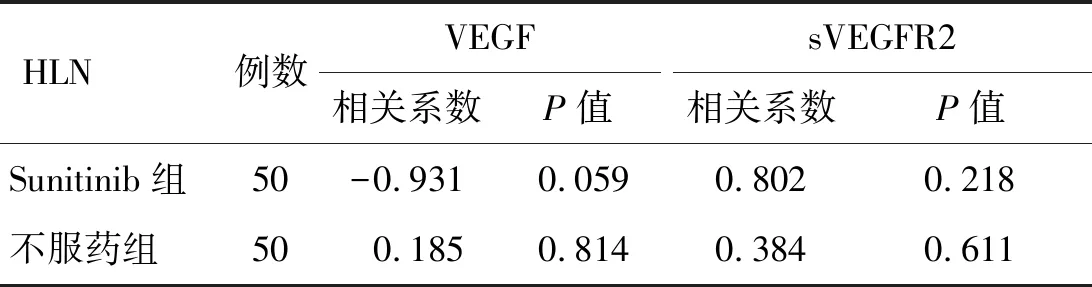
HLN:前哨淋巴结;VEGF:血管内皮生长因子;sVEGFR2:可溶性血管内皮生长因子受体2。
3 讨 论
目前,小分子靶向药物治疗肾癌等恶性肿瘤已经广泛应用于临床,并取得了一定的治疗效果[13],可提升患者生存率。Sunitinib具有抑制肿瘤血管生成和肿瘤细胞生长的多重抗癌作用,其靶点有:VEGFR(VEGFR1、VEGFR2、VEGFR3),及血小板源生长因子受体(platelet-derived growth factor receptor,PDGFR)α和β等[14]。同时,Sunitinib由于受体较多,其在临床使用过程中易产生手足综合征、口腔炎、其他皮肤和皮下组织异常等副作用。本次研究的结果显示,服用Sunitinib辅助治疗的患者其疗效优于对照组,但发生不良反应的几率也相应增高。
HLN是肾肿瘤患者引流肿瘤淋巴液并最先发生转移的淋巴结,按照解剖学及“由近及远”的转移原则,如未检测到此淋巴结转移,患者可免于行规范的根治性切除和广泛性淋巴结清扫。本次研究还发现,治疗前后HLN与VEGF水平均呈显著负相关;治疗前HLN与sVEGFR2呈显著正相关,治疗后HLN与sVEGFR2无显著相关。VEGF和sVEGFR2均可有效指示Sunitinib的治疗过程,VEGF的作用过程需要借助其受体sVEGFR2的信号通路完成,同时其作用过程下调了sVEGFR2的表达水平[15];患者治疗后病情缓解,无需要通过sVEGFR2的水平变化调控,故sVEGFR2水平与HLN无显著相关。可以认为,VEGF表达水平越高,肿瘤血管更加丰富,肿瘤生长更快、侵袭性更强[16],Sunitinib等小分子靶向药物治疗的效果也越好。VEGF和sVEGFR2因子在小分子靶向药物治疗肾细胞癌的临床过程中可成为其远期疗效的预测因子[17]。进一步分析其原因,Sunitinib作为抗肿瘤治疗的新型药物,主要通过抑制肿瘤内血管生长产生作用,直接抗肿瘤细胞效应相对较弱[18];抑制血管生成的过程复杂、受多种因素影响。随着对肿瘤血管形成过程认识的深入及检测技术的发展,尽早筛选出抗VEGF 药物疗效的、灵敏度高的预测因子,以界定优势人群,达到个体化治疗目的;同时可以更准确地区分不同的肿瘤类型,避免无效甚至有害的治疗。
综上所述,Sunitinib可有效控制转移性肾癌患者的病情,并与VEGF等受体的调节有关,VEGF是评估其疗效的有效预测指标。本研究阐述了Sunitinib治疗转移性肾癌的部分作用机制,具有一定的临床研究与应用价值。