利用基因编辑技术改良水稻性状的研究进展与展望
2019-05-05陈春莲熊运华黄永萍姚晓云尹建华
杨 平,陈春莲,熊运华,黄永萍,姚晓云,尹建华
(江西省农业科学院 水稻研究所,江西 南昌 330200)
基因编辑技术是20世纪80年代发展起来的一项非常重要的分子生物学技术——外源DNA被导入靶细胞后,与靶细胞内染色体上的同源DNA序列发生重组,从而整合到靶基因指定的位点,在靶位点切割或定点突变,导致遗传特性改变。随着基因组编辑技术日渐成熟,在作物的功能基因研究、遗传性状的改良、新品种培育中将发挥重要作用。在培育作物新品种方面,基因编辑技术与传统的转基因技术不一样。传统转基因是将外源DNA转入受体中,使其表达而获得优良性状,从而获得人类所需要的品种;基因编辑技术只是对内源基因进行定点突变或精准编辑,再编辑后代,通过遗传分离完全可以得到没有转基因元件的突变体。因此与传统育种方式相比,基因编辑技术具有很大的优势。虽然传统育种的回交选育也能达到相同的育种目的,但由于回交培育一个近等基因系不仅时间长、工作量大,并且还会产生负面的连锁累赘效应。而利用基因编辑技术只是定向编辑靶基因,不仅可以缩短培育周期,而且更能有效地避免连锁的累赘效应。
1 基因编辑技术
近年来,特异性位点核酸酶(site-specific nuclease, SSNs)的发现与开发促使基因编辑技术在基因功能和品种改良方面取得了很大的进展。特异性位点核酸酶是指在基因组编辑过程中对基因组进行定点切割,引入双链缺口的工具酶[1]。迄今为止,主要有4种SSNs:锌指核酸酶(ZFNs)、转录激活样效应因子核酸酶(TALEN)、成簇规律性间隔回文短重复序列(clustered regularly interspaced short palindromicrepeats, CRISPR)/Cas9系统。单碱基编辑器技术是不需要切割DNA形成双链断裂DSB的,只需经化学反应,让基因组中的一对碱基替换为另一对碱基,从而达到精准编辑基因的目的[2]。
1.1 锌指核酸酶
锌指核酸酶(ZFNs)由锌指蛋白构成的DNA识别域和FokⅠ构成的切割域组成,两者的结合使靶位点的DNA产生双链断裂[3]。因此,细胞可以通过同源重组定向修复(HDR)和非同源末端连接途径(NHEJ)来修复DNA。这两种修复机制都会产生移码突变,从而达到基因突变或编辑的目的。由于FokⅠ内切酶需要二聚化才能发挥活性[4],所以不容易构建,而且构建的成本很高。构建靶向特定位点的ZFN需要对目标基因设计8~10个锌指结构域,然后将这些锌指结构域与二聚化核酸内切酶结合[5]。
1.2 转录激活样效应物核酸酶
第二代基因编辑技术转录激活样效应物核酸酶(TALENs)的构成与ZFNs相似,由二聚化的FokI核酸内切酶的切割DNA结构域和TAL效应因子(TALE)的结合DNA结构域组成[6]。TALEN同样不容易构建,构建成本高,一般只能在基础研究实验室构建,TALEN包含核定位信号(NLS)域、中央结构域和核酸内切酶功能结构域。构建TALEN需要在靶序列两侧设计两个TALEN结合位点,在靶向序列处由二聚化的FokI核酸酶切割,从而产生DNA双链断裂(DSB),然后通过HDR或NHEJ修复。
1.3 CRISPR/Cas9系统
CRISPR/Cas9系统来源于古细菌及原核生物细菌对外源病毒和DNA的免疫系统。成簇的规律性间隔短回文重复序列(clustered regularly interspaced short palindromic repeat,CRISPR) 在古细菌或细菌中普遍存在[7]。CRISPR/Cas系统可特异性地识别外源DNA,切割并沉默外源基因的表达。CRISPR /Cas系统由CRISPR序列元件和Cas家族组成,它可分为3种类型,即Ⅰ型、Ⅱ型和Ⅲ型。目前的CRISPR/Cas系统由Ⅱ型系统改造而来,Ⅱ型系统仅需一种Cas9蛋白参与,相对比较简单,而Ⅰ型和Ⅲ型系统需要较多种的Cas蛋白共同参与,比较复杂。CRISPR区域上游有一段作为启动子启动后续CRISPR序列转录的系列,被称为前导序列,在前导系列调控下生成前体crRNA (Pre-CRISPR RNA,pre-crRNA)。然后加工为成熟的crRNA,通过碱基配对,与反式激活的crRNA (trans-acting crRNA, tracrRNA)形成单向导RNA (sgRNA)。Cas9核酸内切酶的类HNH和类RuvC分别切割DNA两条互补链,在sgRNA的引导下特异性地识别靶系列并切割形成双链DNA断裂,从而完成基因组的定向精准编辑[8]。
1.4 CRISPR/Cpf系统
2015年,美国麻省理工学院Zetsche等[9]发现了同样来源于CRISPR系统的Cpf1核酸内切酶,包括AsCpf1、FnCpf1和LbCpf1三种核酸内切酶。相比于CRISPR/Cas9系统, CRISPR/Cpf系统有如下优点:(1)Cpf1只需较短一段crRNA识别靶目标,不需tracrRNA,而且Cpf1更简单、更小、更容易进入细胞;(2)Cpf1的PAM是靶序列为5′端连续的2个或3个胸腺嘧啶(T),扩大了基因组编辑的范围,也是对CRISPR基因组编辑技术的一个重要补充;(3)Cpf1切割目标系列产生的是粘性末端,更有利于靶序列的同源重组替换和精准插入;(4) Cpf1既可以切割DNA,又能切割RNA,有助于构建多基因编辑的载体。
1.5 单碱基突变编辑技术
Komor等[10]开发出了只需经过化学反应从而让基因组的一对碱基发生替换的单碱基编辑器,包括胞嘧啶碱基编辑器(CBE)和腺嘌呤碱基编辑器(ABE)。CBE诱导鸟嘌呤(G)变成腺嘌呤(A),诱导胞嘧啶(C)变成胸腺嘧啶(T); ABE诱导A或T变成G或C。与其它基因编辑技术不同,单碱基突变编辑技术不需要核酸内切酶在特异位点处切割DNA,只需产生双链断裂就能达到精准编辑的目的。Kai等[11]在水稻中首次就应用了ABE编辑器。
2 基因编辑技术在水稻性状改良中的应用
基因编辑技术除了应用于研究水稻新功能基因组外,最近几年,应用CRISPR/Cas9系统等基因编辑技术在水稻遗传性状(产量、品质、育性、抗性等性状)改良、新品种培育方面也取得了较大进展(表1)。
2.1 产量和品质相关性状
产量和品质是典型的数量性状,水稻的产量主要由有效穗数、每穗粒数和千粒重决定。利用基因编辑技术已经成功改良产量性状的负调控基因包括GS3、DEP1、GS5、GW2、Gn1a和TGW6[12]。Li等[13]利用CRISPR/Cas9基因编辑系统编辑Gn1a(OsCKX2)、DEP1、GS3和IPA1,获得的突变体表型与以前报道的一样,单株产量得到了提高。Butt等[14]利用CRISPR/Cas9系统定向编辑CCD7基因,获得了多分蘖突变体。Xu等[15]利用CRISPR/Cas9系统同时突变3个粒重相关基因GW2、GW5和TGW6,获得了千粒重比野生型增加29.3%的突变体。Li等[16]利用CRISPR/Cas9介导的多基因载体同时组编辑3个负调控生育期基因Hd2、Hd4和Hd5,获得了早熟的突变体。水稻种子的贮藏特性主要受脂氧合酶(LOXs)的调控,在14个LOX基因家族中有3个基因(LOX1、LOX2和LOX3)在负调控水稻种子的贮藏性。Ma等[17]应用TALENs定向突变LOX3基因,提高了水稻种子的耐贮藏能力。Shan等[18]和Shao等[19]分别利用TALENs和CRISPR/Cas9技术对水稻的香气基因OsBADH2进行编辑,获得了香米突变体。Miao等[20]利用CRISPR/Cas9技术编辑调控水稻营养基因PYL家族,获得了生长力和产量增加的突变体。Ma等[21]利用CRISPR/Cas9系统敲除控制直链淀粉含量的基因OsWaxy,获得了籼稻和粳稻的糯性品系。
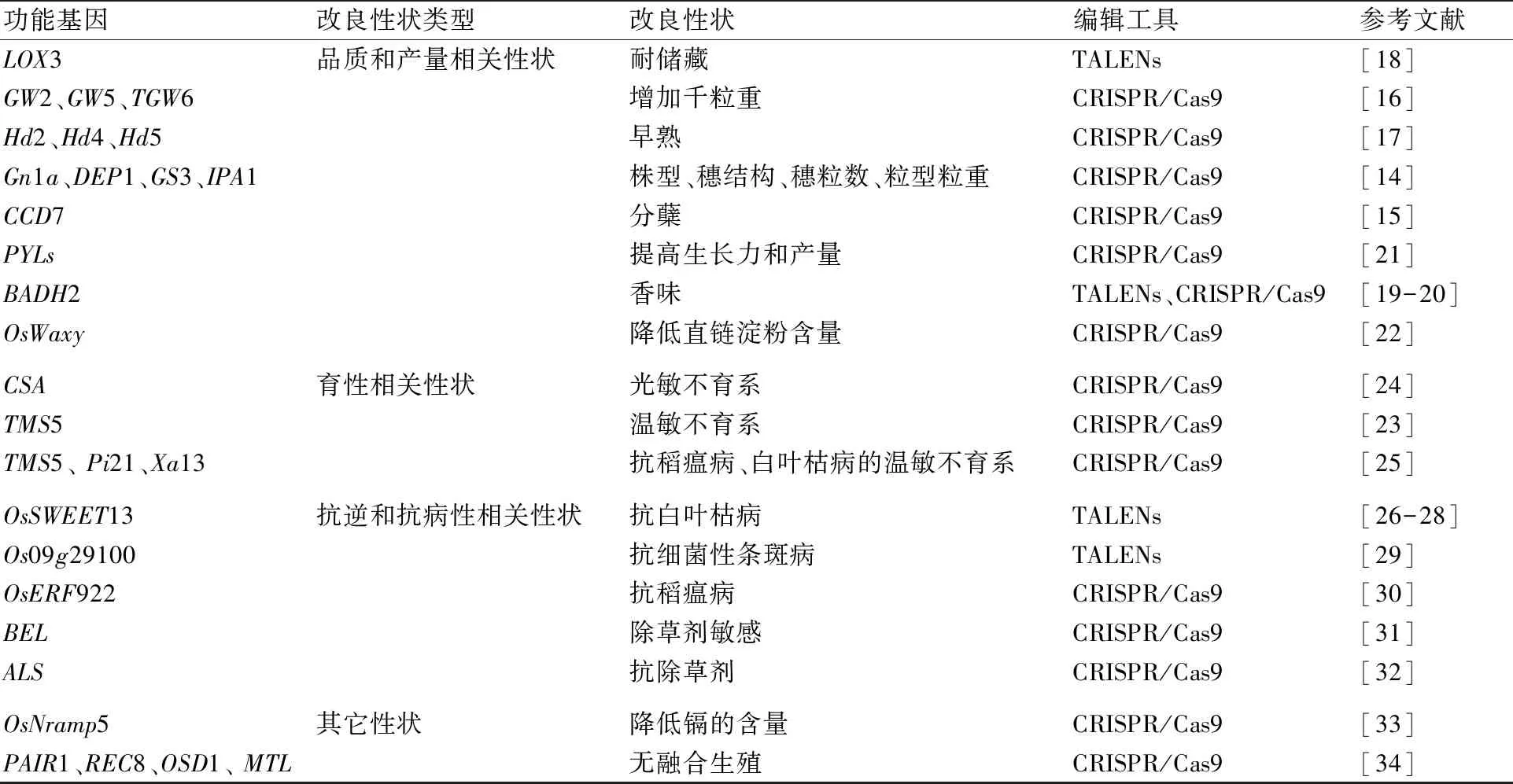
表1 基因组编辑技术在水稻遗传改良中的应用
2.2 育性相关性状
水稻杂种优势利用法包括三系法和两系法,其中环境敏感型两用不育系由细胞核基因PMS3、TMS5调控。Zhou等[22]利用CRISPR/Cas9系统突变TMS5基因,得到了温敏不育系,可用于两系杂交稻的培育。Li等[23]利用CRISPR/Cas9系统突变粳稻CSA基因,得到了2个反光敏不育系(9522csa和JY5Bcsa)和1个光温敏不育系(KY131csa-4)。李三峰等[24]通过编辑品占中的TMS5、Pi21和Xa13基因,创制出多个tms5/pi21/xa13纯合突变的水稻新株系;表型鉴定表明,不同突变方式的纯合株系在高温28 ℃下不育,在低温23 ℃下转可育;同时,这些纯合突变株系对稻瘟病和白叶枯病的抗性显著增强。
2.3 生物和非生物胁迫相关性状
近年来,应用基因编辑的方法大大增强了水稻对病虫害和逆境的抗性。运用TALENs定向敲除OsSWEET14启动子区的效应蛋白绑定元件(effector-binding element, EBE),解除了效应蛋白与OsSWEET14启动子的结合,从而使水稻对白叶枯病的抗性得到了提高[25-27]。Cai等[28]运用TALEN技术修饰Os09g29100基因启动子中的Tal7结合位点,从而增强了水稻对细菌性条斑病的抗性。Wang等[29]利用CRISPR/Cas9系统敲除水稻品种空育131中的1个编码AP2/ERF类转录因子的基因OsERF922(该基因负调控水稻对稻瘟病的抗性),获得了抗稻瘟病株系。Xu等[30]利用CRISPR/Cas9系统编辑了水稻的除草剂(苯达松)抗性基因BEL,使该基因的功能伤失,从而使水稻对苯达松敏感。Sun等[31]利用CRISPR/Cas9基因编辑系统定向对水稻ALS基因的密码子进行替换,并且通过分离获得了没有转基因元件的抗除草剂水稻株系。
2.4 其它性状
镉(Cd)含量超标严重影响人体健康。Tang等[32]利用CRISPR/Cas9编辑系统对籼稻的金属转运蛋白基因OsNramp5进行突变,田间试验表明,突变籼稻株系谷粒中的Cd浓度低于0.05 mg/kg,而野生型谷粒中的Cd浓度为0.33~2.90 mg/kg。Wang等[33]通过CRISPR/Cas9基因编辑技术在籼粳杂交稻“春优84”中同时敲除PAIR1、REC8、OSD1 和MTL这4个内源基因,获得了可以发生无融合生殖的Fix (Fixation of hybrids)材料; Fix植株在营养生长阶段表现正常,但其育性明显下降;通过细胞倍性检测,在其子代中获得了细胞倍性为二倍体且基因型与亲本完全一致的植株,这些F2代植株的表型也与其F1代杂交稻高度相似。由此证明,通过基因编辑技术同时编辑这4个基因,可以将无融合生殖特性引入到杂交稻当中,从而实现杂种优势的固定。
3 小结与展望
水稻的有利性状大部分是数量性状,由多基因调控。基因调控性状的方式分为正调控和负调控。目前的基因组编辑技术主要针对负调控基因,而对于替换及插入目的片段的获得性突变的效率很低,因此,未来的任意精准编辑水稻基因技术将会促进功能基因组研究与新品种改良。
水稻功能基因的深入研究及重要功能基因的克隆为利用基因编辑技术改良水稻遗传性状、获得优良性状品种或种质资源提供了遗传基础。将来可以通过基因编辑技术在水稻品质、产量、抗性等方面取得新突破。
基因编辑技术是一个新技术,也同样面临着前所未有的机遇和安全问题的挑战。美国认为由细胞自我修复产生的突变体不属于转基因农作物,利用基因编辑技术获得的作物新品种不属于转基因产品(GMO)[34]。欧盟则认为非自然产生的基因编辑产品就是GMO,然而通过化学和物理诱变获得的突变体在他们看来又不是GMO。显然,基因编辑的突变与化学、物理诱变在本质上是一样的,只是手段(技术)不一样。然而最近欧盟也倾向于将基因组编辑作物定义为非GMO[35]。
