高爆速含能化合物的合成及性能研究进展
2019-05-05王国栋刘国庆甄建伟韩瑞连张玉令
王国栋,刘国庆,甄建伟,韩瑞连,张玉令
(陆军工程大学石家庄校区, 石家庄 050003)
1 研究现状
目前,易产生较高爆速的炸药主要指环脲硝胺系列含能化合物,这类炸药中高氮多硝基的结构单元和环张力的存在使得它们具有高爆速等良好的爆轰性能,一般环脲硝胺类化合物以脂环和稠环为主,如众所周知的1,3,5-三硝基1,3,5-三氮杂环己烷(RDX),1,3,5,7四硝基-1,3,5,7-四氮杂环辛烷(HMX)等,已被人们作为模板或含能基底材料给予了多种结构修饰,合成了一些新型的含能化合物,如HHTDD和TDCD。
HHTDD,全称为2,4,6,8,10,12-六硝基-2,4,6,8,10,12-六氮杂三环十二烷-5,11-二酮,其分子式见图1。在高能单体炸药的研究中,它是迄今所报道的爆速最高的炸药,爆速可达9 546 m/s[1]。它是一种典型的多硝基环脲类含能化合物,它首先由西安近代化学研究所自行设计并于1972年首次合成,随后在1991年,Boyer等[2]也报道了HHTDD的合成方法。鲁鸣久[3]对HHTDD的结构、性质、和应用研究情况进行了报道。HHTDD是一种白色结晶,其分解温度为205 ℃。由X粉末衍射图可知,HHTDD有A,B两种晶型,其中A晶型是稳定晶型,结晶密度较大(2.07 g/cm3)。在一定条件下,A,B两种晶型可以相互转化。它易溶于醋类、酮类,稍溶于乙腈、硝基甲烷、环醚类和乙酰丙酮等。DSC研究显示,其峰温位于228 ℃,TGA研究显示其在100 ℃条件下48 h失重0.23%,布氏计法测得其100 ℃下48 h放出标准气体量为0.5 mL/g。HHTDD的能量水平很高,其爆热可达6 326 kJ/kg,爆速可达9 546 m/s(装填密度为1.995 g/cm3),但其感度也很高,撞击感度为100%,摩擦感度为100%。居学海等[4]利用密度泛函理论对HHTDD进行研究,结果显示在其全优化几何构型中六元氮杂环可采取椅式和船式两种构象,并且以船式构想更为稳定。作者还计算了两种构型分子的理论爆速,与实测结果极为吻合。多名学者对HHTDD的热力学性质进行了研究,结果显示HHTDD具有较好的热抵抗能力。
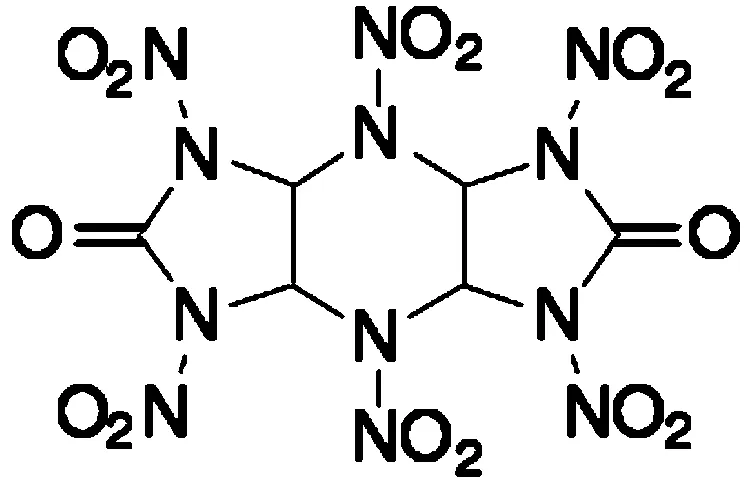
图1 HHTDD的分子式
TDCD,全称为1,3,4,6-四硝基八氢环丁基-二咪唑基-2,5-二酮,其分子式见图2。和HHTDD一样,它也属于典型的多硝基环脲类含能化合物。TDCD具有优良的爆轰性能,其计算密度达到1.99 g/cm3(HMX为1.96 g/cm3),爆速达到8.41 km/s(HMX为8.88 km/s)爆压为32.8 GPa(HMX为35.2 GPa),综合性能与HMX相当,因此在火炸药、火工品及推进剂中有一定的应用前景。Fischer等人报道采用2,2-二乙氧基乙胺和氰酸钾在酸性条件下合成脲类衍生物,之后经环化得到咪唑啉酮中间体,之后进行乙酰化和光催化环加成反应,得到1,3,4,6-四乙酰基八氢-环丁二咪唑-2,5-二酮,随后在碱性条件下脱掉乙酰基,再经硝化得到TDCD。
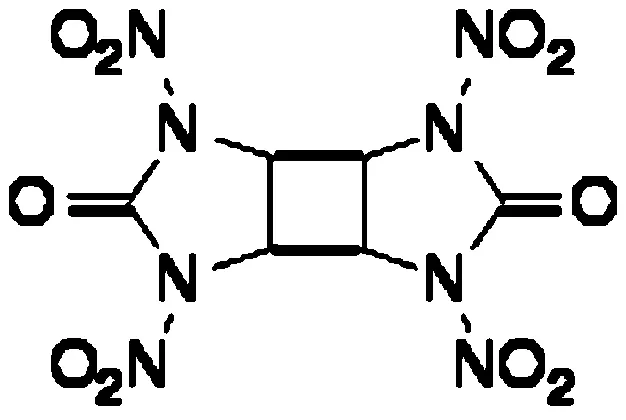
图2 TDCD的分子式
环脲硝胺系列化合物是一类高密度、高爆速含能化合物,对环脲硝胺的研究,国内外都开展了一些工作,制备了一些化合物,如二硝基乙烯脲、四硝基甘脲等。通过研究发现,用羰基代替环胺中的次甲基,可以明显提高炸药的结晶密度,进而提高炸药的爆速。其合成方法中的脲缩合-硝化法步骤简单、原料易得,在起始原料和实验条件的选择上具有广阔的空间,且反应过程中形成的六元环结构更适宜用温和的硝化剂,这些对于设计、合成以环脲硝胺为母体的含能衍生物具有较大的指导意义。而小分子缩合-硝化法常需引入基团保护,使反应操作步骤增多,且对使用的硝化剂体系要求较高,但由于小分子结构的多样性,使得合成原料的选择更广泛,合成方法的选用更灵活,这对于合成一些具有特殊结构或综合性能好的环脲硝胺类化合物具有参考价值。
2 环脲硝胺类化合物性能特点
最早以及最熟知的含单或双环硝基脲的例子分别是1,4-二硝基甘脲(DNGU)和1,3,4,6-四硝基甘脲(TNGU),因此比较两者的稳定性可从一定程度上说明含单或双硝基脲结构含能化合物的一般特性:具有双硝基脲结构单元的含能化合物水解稳定性不好,而具有单硝基脲结构的化合物却有较好的水解稳定性。Boileau等[5]发现四硝基甘脲在水及极性溶剂中易水解,且在样品处理过程中需用无水惰性溶剂洗涤,而1,4-二硝基甘脲在沸水中仅缓慢分解。
胡荣祖等[6]研究了多种环脲硝胺结构化合物的水解稳定性,发现酸性条件和水蒸气都会影响2,4,6,8,10,12-六硝基-2,4,6,8,10,12-六氮杂三环十二烷-5,11-二酮(HHTDD)的稳定性,他们还提出了该化合物在中性条件下可能的水解反应机理。然而,研究发现4,6,10,12-四硝基-2,4,6,8,10,12-六氮杂三环十二烷-5,11-二酮却对水稳定,而在沸腾的甲醇中则会非常缓慢地分解。实验证明,2,4,6-三硝基-2,4,6-三氮杂环己酮与其他的环状二硝基脲结构相比较也有更好的水解稳定性,原因可能是其含有六元环结构。
Brill等[7]研究发现1,3,4,6-四硝基八氢环丁基二咪唑基-2,5-二酮(TDCD)可溶于极性有机溶剂,如DMF,DMSO等,当加入水时便会发生水解反应。但该化合物在室温下对稀H2S04稳定,在稀H2SO4中回流6~8 h,可转变成1,2,3,4 -环丁基四硝胺(CBTN)。
由此可见,由于环硝基脲结构单元中α-N原子上的硝基为强吸电性基团,可对羰基产生强烈的吸电诱导效应,增强了羰基碳原子的电正性而容易受到亲核试剂(如OH-)的进攻,表现出水解不稳定性。而六元环单硝基脲结构可能减弱了环张力以及环脲中未被N-硝化的内酰胺(-CONH-)结构削弱了羰基的电正性和易形成分子内/间氢键,增强了分子的稳定性。
通过增加炸药分子中的并环数、相对分子量和所含的爆炸性基团,可达到提高化合物能量和密度的目的,但这也常导致化合物的稳定性降低。环脲硝胺类化合物因具有脲骨架单元和较多的N-NO2官能团,使其具有密度大和爆速高等性能特点。一些已经合成的环脲硝胺类化合物[8]的性能如表1所示。
3 合成方法
对环硝基脲类化合物的合成路线和制备工艺,目前主要有以下两种基本思路:脲缩合-硝化法,即以醛(主要是甲醛和乙二醛)和脲(等二胺)为原料,经过缩合反应闭环形成环脲仲胺中间体,再经N-硝化制得相应的环硝基脲衍生物。小分子缩合-硝化法,即环脲的形成是通过小分子的缩合制得,再经N-硝化得到环硝基脲类化合物。下面着重介绍HHTDD和TDCD的具体合成方法,一些环脲硝胺类化合物的技术参数如表1。
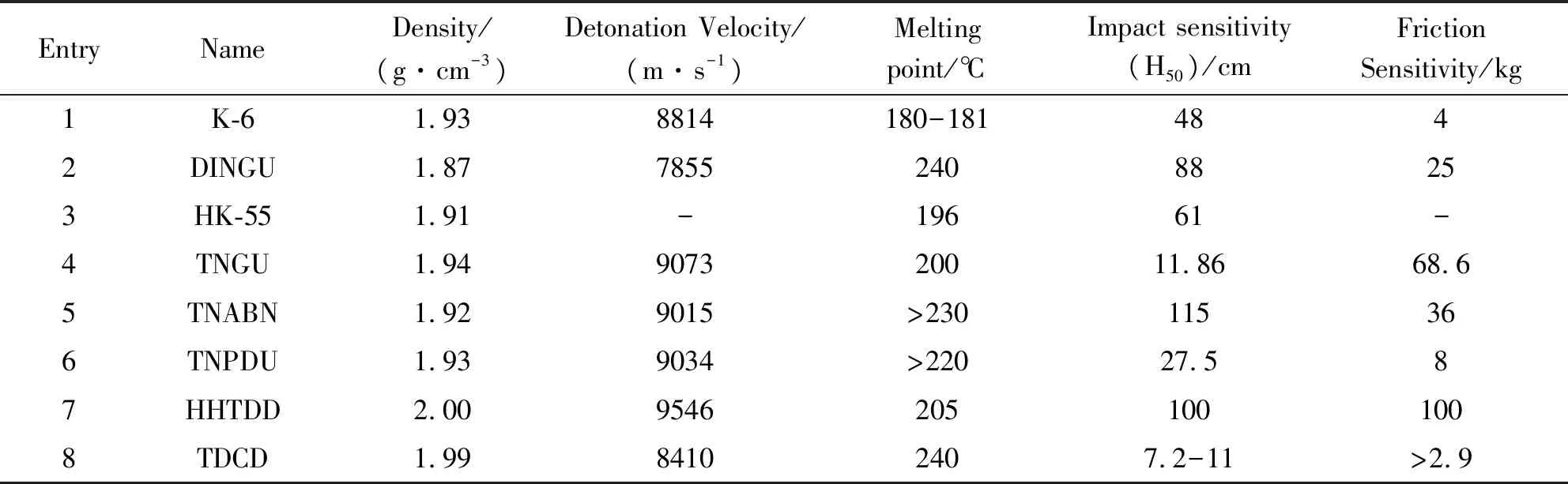
表1 一些环脲硝胺类化合物的技术参数
3.1 HHTDD的合成
总的合成路线[9]如图3所示。

图3 HHTDD的合成路线
1) 主要实验药品和试剂。40%乙二醛、尿素、甲酰胺、醋酸酐、NO2BF4(四氟硼酸硝酰胺)、浓盐酸、发烟硝酸、乙腈、乙酸乙醋、乙醇、DMF、甲醇、丙酮、氢氧化钠、无水硫酸镁、氯化钠、氧化镁等,皆为市售分析纯。
2) 合成步骤。HHTDD的合成分为以下4步:首先由乙二醛与甲酰胺反应制备DFTHP,之后DFTHP尿素在酸性条件下缩合闭环得到六氮杂三环十二烷二酮盐酸盐,再经HN03/Ac2O体系硝化得到四硝基六氮杂三环十二烷二酮,所的产物进一步硝化制备最终目标产物HHTDD。
DFTHP的合成如下:

将40%乙二醛(137 mL,1.2 mol)和甲酰胺(48 mL,1.2 mol)加入到500 mL三口瓶中,并在30 ℃下搅拌反应。此过程中需要不断滴加饱和氢氧化钠溶液以维持反应液pH在9左右。反应1.5~2 h之后,溶液出现固体浑浊。继续调节pH为9,继续反应2 h。反应完毕,冷却至室温,过滤,滤饼依次用DMF/H2O=4∶1的混合溶剂洗,水洗,乙醇洗,在60 ℃下干燥12 h,得到白色固体粉末89.02 g,产率72.0%。
六氮杂三环十二烷二酮盐酸盐的合成如下:
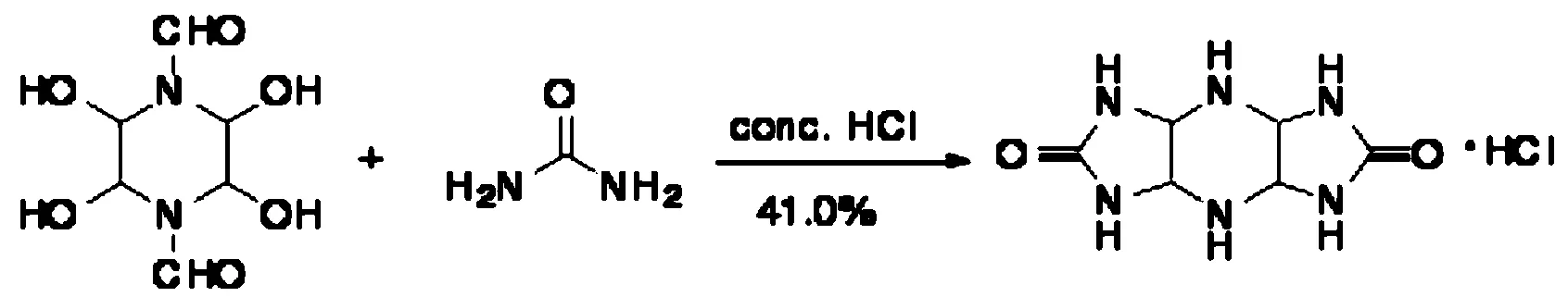
向250 mL三口瓶中加入尿素(21g,0.35mol),然后加入100 mL 37%浓盐酸,机械搅拌。将GFTHP(24 g,0.115 mol)分批加入到反应液中,室温下搅拌反应90 h。过滤,滤饼用300 mL甲醇洗,在75 ℃条件下干燥12 h,得到略带土黄色固体28.2 g,将产物溶于282 mL水中,然后加入564 mL冷冻甲醇,有大量白色固体沉淀产生。过滤,滤饼用甲醇洗涤,75 ℃条件下干燥6 h,得到白色固体粉末11.1 g,总产率41.0%。
四硝基六氮杂三环十二烷二酮的合成如下:

在100 mL双口瓶中加入20 mL醋酸酐,冰盐浴条件下分批加入六氮杂三环十二烷二酮盐酸盐(4.00 g,17.1 mmol),缓慢滴加发烟硝酸(18 mL,0.44 mmol),维持反应液温度低于70 ℃。滴加完毕,在0-4 ℃条件下搅拌反应4h。反应完毕,将反应液缓缓倒入120 g冰水混合物中,过滤,洗涤,得到略带浅黄色固体。将粗品加入到30 mL乙醇中,回流15 min,冷却至室温,过滤,乙醇洗,干燥,得到白色固体2.35 g,产率50.2%,在这种反应条件下只得到化合物Ⅱ。改变反应条件可得到化合物Ⅰ和化合物Ⅱ混合物,经柱色谱分离纯化可得到化合物Ⅰ。
3.2 TDCD的合成路线
总的合成路线[10-11]如图4所示:

图4 TDCD的合成路线
实验试剂。 实验药品和试剂:甘氨酸、尿素、浓硫酸、冰醋酸、四氢呋喃、甲醇、醋酸酐、乙醚、发烟硝酸、硝酸铵、碳酸钾、氧化镁等,皆为市售分析纯,DIBALH为1.5 mol/L的甲苯溶液。
合成步骤。咪唑啉二酮的合成如下:
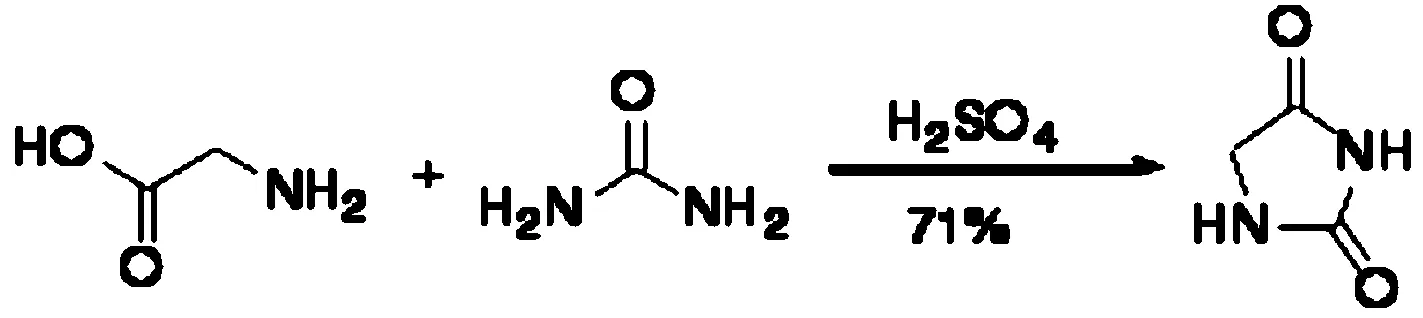
将甘氨酸(7.5 g,0.1 mol)、尿素(14 g,0.23 mol)溶于12 mL水中,加热回流(143 ℃左右)反应12 h。冷却,在冰水浴条件下,向反应液缓慢滴加9 mL浓硫酸,之后有固体生成。将反应液加热回流(140 ℃左右)1 h,冷却至0~5 ℃,有结晶析出。过滤,滤饼用冷水洗涤,得第一部分产物。将滤液旋蒸除去大部分水,冷却静置,过滤,滤饼用冷水洗涤,得到第二部分产物。产物共7.1 g,产率71%。
1,3-二氢咪唑-2-酮的合成如下:
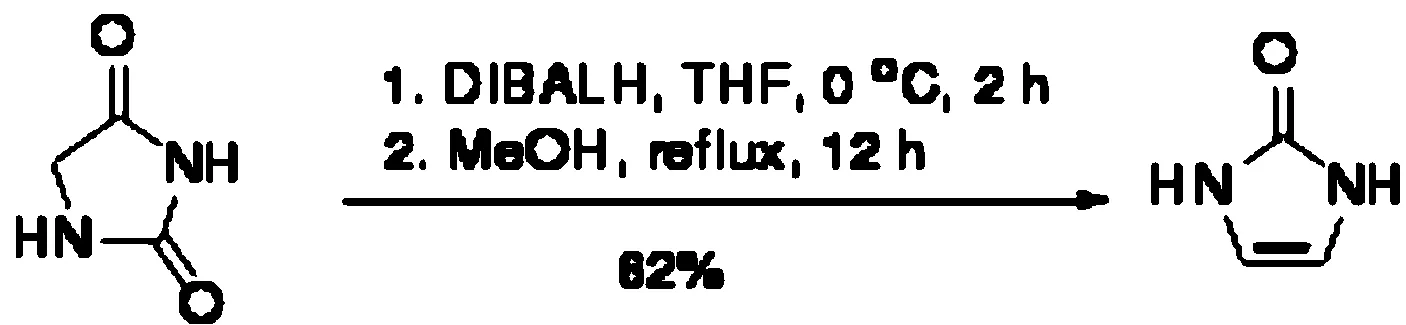
将咪唑啉二酮(6.00 g,0.06 mol)加入到1 000 mL双口瓶中,抽换氮气3次,向其中加入60 mL重蒸的THF,冷却至0 ℃。将DIBALH (107 mL,1.5 mol/L甲苯溶液)多次少量加入到反应液中,时间不小于2 h,之后继续搅拌反应2 h。然后向反应液中小心滴加450 mL90%的甲醇水溶液,反应液逐渐变浑浊,滴加完毕后回流过夜。得到略带淡粉色悬浊液,过滤,滤液旋蒸得到白色固体3.12 g,产率62%。
1,3-二乙酞基-1,3二氢咪唑-2-酮的合成如下:
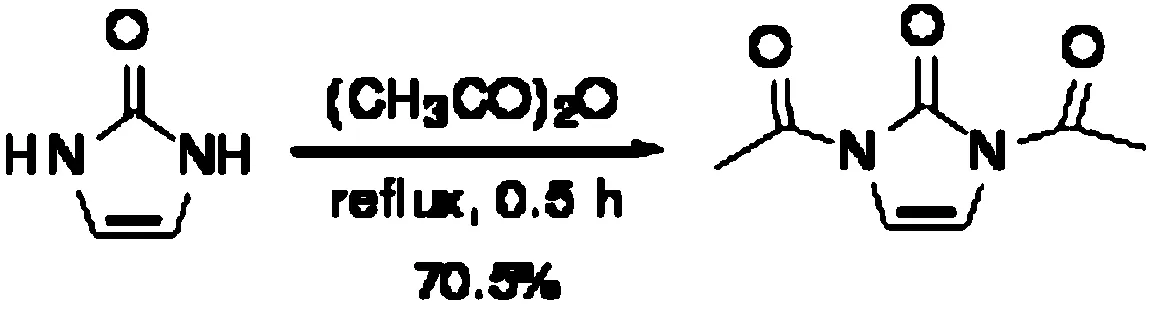
在100 mL原地烧瓶中加入原料(2.0 g,23.8 mol),醋酐(15.0 g,13.9 mL)回流反应0.5 h。反应完毕,冷却至室温,蒸除去醋酐,得到粗品黄色固体。将固体在乙醚中重结晶,得到白色针状晶体2.81 g,产率70.5%。
1,3,4,6-四乙酰基八氢-环丁二咪唑-2,5-二酮(TDCD)的合成如下:
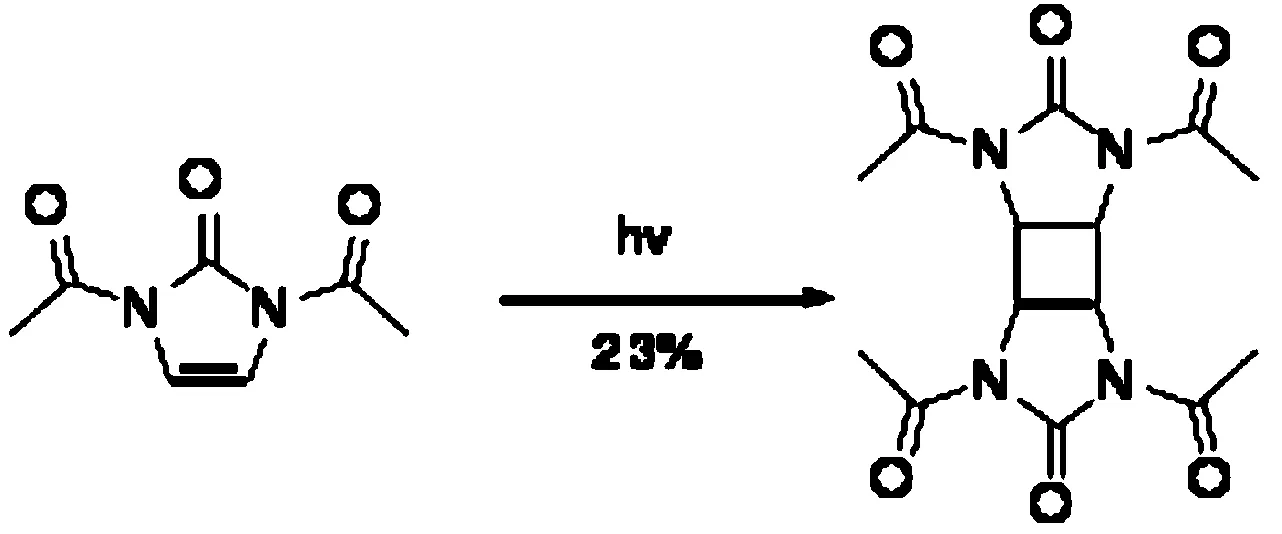
将原料(8.4 g,0.05 mol)溶于378 mL丙酮中,加入到浸没光解装置中,在室温氮气保护条件下,使用500 W紫外灯照射8天。薄层色谱法监测,原料消失。用柱色谱分离,得到白色固体产物3.76 g,产率23%。
4 结论
从环脲硝胺类化合物性能看,该类含能材料依然存在传统CHNO类炸药中能量与感度及稳定性的本质矛盾。如HHTDD的密度大,爆速高,氧平衡为零,但感度、爆发点和热安定性都不太理想。而一些含单硝基环脲类化合物由于存有未被N-硝化的内酰胺(-CONH-)结构,削弱了羰基的电正性和易形成分子内和分子间氢键,增加了分子结构的稳定性,感度降低,但同时也减低了其能量性能。这表明,这类含能材料仍具备提高其密度和爆炸性能的可能性,也存在降低其易损性能的空间,在发展新型含能材料方面,环脲硝胺类化合物不可忽视。
