基于微粒观教学促进学生对化学知识的深度理解
——以“沉淀溶解平衡”为例
2019-05-04福建省泰宁县第一中学354400黄清辉
福建省泰宁县第一中学(354400) 黄清辉
福建教育学院化学教育研究所(350025) 张贤金 吴新建
沉淀溶解平衡是继化学平衡、电离平衡、水解平衡后的又一个平衡理论,它是中学化学基础理论的一个重要组成部分,是近年来高考的一个热点和难点。在教学过程中,我们发现学生对沉淀溶解平衡概念的认识存在偏差,究其根源,是因为学生未在头脑中形成化学学科观念。实施学科观念建构的教学,有助于激发学生学习化学的热情、促进学生对学科知识的深入理解,培养学生的化学学科核心素养。微粒观是学科观念核心要素,学生微粒观建构将有助于学生深入理解知识的教育价值,有利于解决当前化学知识的相关问题。本文基于微粒观的视角,结合 “沉淀溶解平衡”的课堂教学,探讨在化学课堂教学中如何对学生进行学科观念教育,以达到对化学知识的深度理解。
1 微粒观的内涵与教育价值
化学是一门建立在原子、分子、离子等微观层次上认识物质的组成、结构、变化、制备及应用的自然学科。 《普通高中化学课程标准 (2017年版)》明确指出:要引导学生深入学习化学的基本原理和方法,形成发展学科核心观念。化学学科核心观念,不是指某个具体的化学知识,也不是指许多化学知识的组合,而是指学生通过对化学课程的学习,在深入理解化学概念、原理,认识化学的现象本质,理解化学变化规律的基础上所形成基本的观念性的认识。化学学科微粒观是化学基本观念的核心部分,微粒观核心内容主要有:一是微粒包含分子、原子、离子等类别;二是物质是由微粒构成;三是微粒不断运动和变化;四是微粒之间存在相互作用;五是微粒间相互作用是造成物质结构、状态、性质和变化的关键因素。利用微粒观教学有利于帮助学生将认识的视角从宏观走向微观,从现象走向本质,逐渐将具体概念知识的学习内化为学生的化学学科观念,进而实现发展学生微观认识物质水平、发展学生科学探究精神、发展学生的创新意识、创新品质和创新能力等学科教育价值。
2 基于微粒观建构的“沉淀溶解平衡”教学设计
2.1 教学目标设计
运用微粒观分析沉淀的生成、转化和溶解;明确沉淀生成与转化的本质;初步建立解决 “沉淀溶解平衡”的一般思路;运用微粒观分析日常生产、生活中与 “沉淀溶解平衡”的相关问题;体验化学微粒观、平衡观、转化观的教育价值。
2.2 教学思路设计
在学习 “沉淀溶解平衡”之前,学生已经对强弱电解质、化学平衡、电离平衡、水解平衡等核心概念有了一定的认识。在教学过程中,教师要充分引导学生利用已有的学科知识、学科思维、学科观念,解决身边的化学问题,体验化学在现实生活中的应用。本文在教学过程中,以NaCl饱和溶液溶解平衡的探究实验作为引入,过渡到氢氧化镁悬浊液存在另一种平衡—— “沉淀溶解平衡”,然后就 “沉淀溶解平衡”的特征、平衡的表达式、溶度积常数的概念及相关计算、“沉淀的溶解”与转化、“沉淀溶解平衡”的应用等展开学习。教学中,采用 “问题情境-实验探究”教学模式,环环相扣的教学方式进行知识层层推进,通过分析微观粒子的种类和数目变化,逐步将核心问题的探究引向深入。
2.3 教学过程设计
2.3.1 环节一:创设情境,引入概念
问题情境1:如何证明可溶性固体存在溶解平衡?
实验探究1:取4mLNaCl饱和溶液,滴加1~2滴浓盐酸,观察实验现象,并分析原因。
设计意图:通过引导学生分析饱和氯化钠溶液中存在微粒的种类,并结合固体溶解平衡及化学平衡Qc与K等相关知识,让学生明白增大氯离子浓度,促使饱和氯化钠溶解平衡逆向进行,氯化钠在该环境下溶解度减小,导致氯化钠晶体析出。
问题情境2:粗盐提纯过程中,用过量的氢氧化钠溶液除去镁离子,使之转化为氢氧化镁沉淀,那么所得溶液中镁离子浓度是否为零?怎么证明氢氧化镁固体是否溶于水,是否存在类似可溶性固体溶解平衡体系?
实验探究2:取少量的氢氧化镁固体于小烧杯中,加入适量的蒸馏水后,用玻璃棒搅拌。静置后,取上层清液于两支试管中,分别向其滴入几滴无色酚酞溶液及饱和氢氧化钠溶液,观察实验现象,并分析原因。
设计意图:通过观察酚酞溶液变红,学生很容易明白氢氧化镁固体有少量溶解,氢氧化镁溶解的部分电离出使酚酞变红的氢氧根离子;加入氢氧化钠溶液后观察白色沉淀生成,学生很容易认识到氢氧化镁存在溶解平衡。通过实验设计,让学生对“沉淀溶解平衡”的概念有了真实的体验,通过对体系中微粒的分析,促进学生对“沉淀溶解平衡”建立有更深层次的理解。
2.3.2 环节二:知识迁移,深化概念
问题情境3:①什么是化学平衡?化学平衡有哪些特征?化学平衡常数表达式如何书写?②以氢氧化镁为例,阐述什么是 “沉淀溶解平衡”?“沉淀溶解平衡”有哪些特征?③ “沉淀溶解平衡”及其常数表达式怎样书写?该平衡常数又称为什么?④氢氧化铁、碘化银的 “沉淀溶解平衡”及其Ksp表达式怎样书写?⑤观察硫酸钡的 “沉淀溶解平衡”表达式与硫酸钡的电离方程式有何区别?
设计意图:引导学生运用已有化学平衡知识,在加深理解平衡理论的同时,逐步将探究的问题引向对“沉淀溶解平衡”本质的学习与理解,在潜移默化中学习并掌握新知识。教学过程中,通过引导学生对溶液中微粒种类、数目、存在形态的分析,帮助学生对化学知识的深度理解。
问题情境4:根据表1中难溶物的溶度积常数(25℃),回答以下问题。
(1)表格中物质Ksp有什么特点?
(2)不同难溶电解质Ksp越小,表示该物质溶解能力越小?
(3)某溶液中含Fe3+为0.1mol/L,求下列情况溶液的pH。①开始沉淀时,溶液的pH;②Fe3+完全沉淀时(当被沉淀的离子浓度小于10-5mol/L,即认为沉淀完全)溶液的pH。
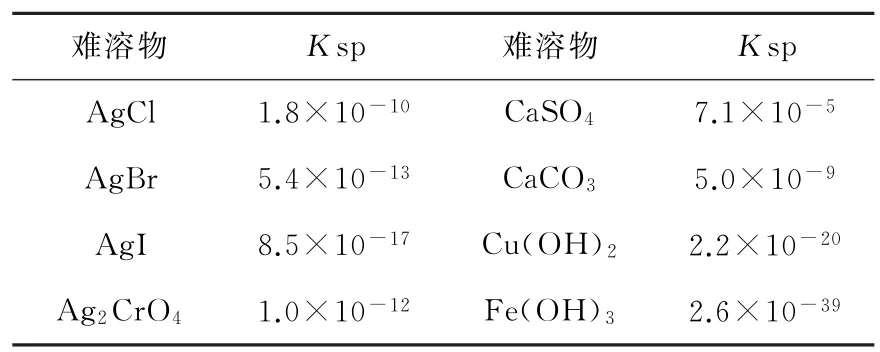
表1 难溶物的溶度积常数
设计意图:通过表格呈现Ksp的数据,让学生明白可以用Ksp表示其溶解能力,但是不同物质间,由于构成物质的微粒之间比例关系不一定相同,所以不能直接利用Ksp数值大小比较溶解能力;设计利用Ksp公式进行简单计算,进一步理解Ksp与微粒间浓度的相互联系。
2.3.3 环节三:问题解决、深化认知
问题情境5:
①鉴别碳酸钠和碳酸氢钠用什么试剂?能否用氯化钙溶液?②硝酸银溶液和氯化钠溶液混合时,一定有沉淀生成吗?③如何判定一定浓度的微粒间混合形成沉淀?④向含等浓度的氯离子、溴离子、碘离子、铬酸根离子的混合溶液中逐滴加入等浓度的硝酸银溶液,则产生沉淀的离子依次顺序是什么?
实验探究3:分别往碳酸钠和碳酸氢钠溶液中滴入氯化钙溶液,观察实验现象。
设计意图:让学生建立知识模型:溶液混合时,首先要根据混合瞬间溶液中离子Qc与Ksp的相对大小判断混合过程中是否产生沉淀,即Qc>Ksp,则有沉淀生成。在混合液中加入同一种离子,产生沉淀的顺序,不能直接根据Ksp的大小,而应看哪种物质的Qc先达到其溶度积常数,谁先沉淀。
问题情境6:①水垢中含有CaSO4,是一种难溶于酸碱的物质,该如何除去?②某工厂排放废水中常含有Cu2+、Pb2+、Hg2+等重金属离子,最适宜加哪种物质除去这些离子?③牙釉质的主要成分Ca10(PO4)6OH(羟基磷酸钙),它是一种难溶电解质,为什么吃糖容易形成蛀牙?为什么用含氟牙膏可以更好地保护牙齿?④医疗上的钡餐主要成分是硫酸钡,能否用碳酸钡代替硫酸钡?⑤从复分解反应的视角判断氯化银和溴化钠溶液,溴化银和碘化钾溶液混合是否发生化学反应?
实验探究4:向试管中加入1mL0.1mol/L的氯化钠溶液,滴入几滴0.1mol/L的硝酸银溶液,观察实验现象;再往试管中继续滴加几滴0.1mol/L的溴化钠溶液,观察实验现象;最后往试管中继续滴加几滴0.1mol/L的碘化钠溶液,观察实验现象。
设计意图:联系生产生活中的实际例子,让学生通过分析溶液中微粒的变化,充分感受到“沉淀溶解平衡”是真实存在的,不同沉淀之间是可以相互转化的。
问题情境7:在氢氧化镁悬浊液中加入适量的氯化铵晶体,充分振荡,沉淀会溶解吗?如果会,沉淀溶解是铵根离子直接与OH-反应造成的,还是铵根水解生成H+与OH-反应造成的?
实验探究5:分别取两支滴有酚酞的氢氧化镁悬浊液的试管,向一支试管中滴入氯化铵溶液,充分振荡,观察实验现象;向另一支试管中滴入醋酸铵溶液,充分振荡,观察实验现象。
设计意图:探究铵根离子对氢氧化镁沉淀影响,引导学生运用“沉淀溶解平衡”、电离平衡、水解平衡等相关知识充分分析溶液中存在的微粒及微粒间的相互作用。在此过程中,培养学生观察、分析、解决问题的能力,提升微观探析、平衡思想、科学探究等化学学科核心素养。
4 基于微粒观教学促进学生对化学知识的深度理解的建议与反思
4.1 培养微粒观认识事物的学习品质,促进对化学知识的深度理解
《普通高中化学课程标准 (2017年版)》指出:普通高中的培养目标是进一步提升学生综合素质,着力发展学生核心素养,使学生具有科学文化素养和终身学习能力,具备自主发展能力。品质指人的素质和物品的质量,其中人的素质指人的健康、智商、情商、逆商和知识、文化、道德素养等。学习品质包括学习行为、学习态度、学习能力等方面。化学是一门以实验为基础的学科,实验探究有助于学生培养观察、思考、分析问题及解决问题的学习品质。化学核心概念、原理如弱电解质电离平衡、盐类水解、“沉淀溶解平衡”都具有较强的抽象性、理论性,学生在化学学习过程中对核心知识的学习普遍感到恐惧,很容易停留在记忆的层面上。教学过程中可以借助Flash动画帮助学生透过实验现象分析微粒之间相互作用,深入理解概念、原理的实质,转变学生的学习方式,进而养成从微粒观的角度分析问题。在化学教学中,教师如何正确合理地培养学生基于微粒观认识事物的学习品质,促进学生对化学知识的深度理解,是目前化学课堂教学中面临的一个重要课题。
4.2 建构微粒观分析问题的思维模型,促进对化学知识的深度理解
为了让学生明确用微粒观认识事物的思维方式,在实验探究、小组合作交流中对微粒观思考方法优化后,教师引导学生明确化学反应原理与微粒性质间的内在联系,以化学反应原理为依据,从微粒的存在、微粒之间相互作用、微粒性质、化学反应原理之间的内在联系的综合维度,构建微粒观分析问题的思维模型。及时内化为学生解决生产生活中实际问题的思维工具。具体思维模型为:反应体系中存在哪些溶质和溶剂——体系中存在哪些分子、离子等形式的微粒及微粒的数量——这些微粒间是如何相互作用——往体系中加入试剂 (分析试剂中存在微粒的种类、数量)——试剂中微粒与原体系微粒发生反应机理(借助已有化学平衡理论)——造成体系微粒种类和数量如何变化——宏观现象变化——解决生产生活中实际问题例子。
4.3 构建微粒观解决问题的教学模式,促进对化学知识的深度理解
基于微粒观的教学最重要的是将微粒观与学科知识、学生已有认知、教学目标有机结合起来,并具体落实到教学环节设计和教学策略的选择当中。教师要充分意识到每一个教学环节的意图是如何引导学生将认识事物的视角从宏观走向微观,从现象走向本质的,发展学生从微观角度认识和理解物质及其变化,进而形成化学学科的观念。教师在教学过程中,从微粒观的视角深入理解化学学科核心知识,并对涉及微粒观教学内容进行一个整体设计,采用问题情境创设与实验探究相结合,引导学生从微观角度进行定性与定量分析发现问题,提出假设,实验验证,运用结论解释问题,有计划有目的地推进微粒观教学,促进学生对化学知识的深度理解。
