纯化腐植酸对氮胁迫下黄瓜幼苗光合特性及碳代谢的影响
2019-04-29谷端银高俊杰刘中良闫伟强
谷端银 高俊杰 焦 娟 刘中良 闫伟强
泰安市农业科学研究院 泰安 271018
碳、氮代谢是植物体内最基本的两大代谢过程,氮素的高低直接或间接地影响植物的碳代谢[1]。
碳代谢主要通过光合作用、呼吸作用及糖类代谢等途径影响作物的生长发育、有机化合物的合成、转运和积累,进而影响作物的产量和品质。设施蔬菜生产因过量施肥导致NO3-积累,从而引起连作障碍,对作物生长和发育带来了诸多不利影响。胁迫下,种子萌发受到抑制[2],植株抗氧化物酶系统紊乱[3],渗透调节物质增加,植物生长受到抑制。
1 材料与方法
1.1 试验设计
纯化腐植酸(PHA)为风化煤腐植酸纯化后获得,具体方法参考国际腐殖质学会(International Humic Substances Society,IHSS;http://www.ihss.gatech.edu/soilhafa.html)及Aguirre等[9]的方法。
供试品种为“新泰密刺”黄瓜。挑选饱满度均匀的种子,采用温汤浸种、催芽后,挑选发芽整齐的种子播于装有基质(草炭∶蛭石=2∶l)的穴盘中,待第一片真叶展平时,选取生长一致的幼苗,洗净黄瓜幼苗根部基质,以聚乙烯泡沫板打孔固定植株,移栽至盛有6 L营养液的水培盆(40 cm×30 cm×12 cm)中,每盆定植6株,采用1/2 Hoagland营养液培养,每3天更换一次营养液,培养至3叶1心时进行处理。
试验设3个NO3-水平:正常氮水平(NO3-为11 mmol/L,对照)、低氮胁迫(NO3-为 1 mmol/L)和高氮胁迫(NO3-为101 mmol/L);2个PHA水平:即0和100 mg/L(总腐植酸含量)。共计6个处理,分别记为MN(对照)、LN(低氮胁迫)、HN(高氮胁迫)、MN+P(对照添加PHA)、LN+P(低氮胁迫添加PHA)、HN+P(高氮胁迫添加PHA)。
为避免PHA在营养液中与Ca2+产生絮凝,影响处理效果,Ca2+浓度控制在0.5 mmol/L以下。低氮胁迫营养液采用基础营养液(NO3-为1 mmol/L),基础营养液配方参考Mina等[10]略作修改,为1 mmol/L NO3-[由0.5 mmol/L Ca(NO3)2提供],0.75 mmol/L K2SO4,0.65 mmol/L MgSO4,0.5 mmol/L KH2PO4,50 μmol/L KCl,40 μmol/L H3BO3,4 μmol/L MnSO4,2 μmol/L CuSO4,2 μmol/L ZnSO4,1.4 μmol/L (NH4)2MoO4,40 μmol/L EDDHA-Fe(乙二胺邻二羟基乙酸铁),以浓H2SO4调整营养液pH 5.5~6.5。对照营养液,即在基础营养液中另加10 mmol/L此10 mmol/L NO3-由硝酸钾∶硝酸铵∶硝酸钠=1∶0.5∶0.5提供。高氮胁迫营养液,在基础营养液中另加100 mmol/L NO-,此100 mmol/L3由硝酸钾∶硝酸铵∶硝酸钠=1∶0.5∶0.5提供。
在PHA使用前,先配制成5.0 g/L PHA盐母液,根据所需浓度在处理第1天即按照所需浓度加入到处理营养液中。胁迫处理开始时,对照和低氮胁迫第1天全部加入。高氮胁迫处理为防止高浓度一次性加入的盐刺激,于第1、2、3天各加入1/3的NO-浓度,第4天各处理全部更换一次对应NO-33处理浓度的营养液,3天后再更换1次对应NO-3处理浓度的营养液。每个处理3次重复。生理生化指标测定于第2次更换营养液的次日上午取样。
1.2 试验方法
1.2.1 PHA的基础指标测定
PHA的元素组成采用Elementar Analysensysteme GmbH元素分析仪(varioMICRO V1.5.4 2007-9-27,CHNS Mode,Ser.No.:15072029)测定。PHA分子量测定:采用激光光散射-凝胶渗透色谱仪(Wyatt DAWN HELEOS-Ⅱ),分子排阻色谱法测定。光散射检测器为Wyatt DAWN HELEOS-Ⅱ(红色信号);示差检测器为Wyatt Optilab(蓝色信号);色谱柱:Shodex SB-806M,Shodex SB-G保护柱;色谱条件:流动相为0.1 mol/L碳酸氢钠溶液;柱温为45 ℃;流速为0.5 mL/min。E4/E6的测定采用分光光度计法,即在465和665 nm处分别测定吸光度,记为E4和E6值,并计算E4/E6值,具体参见谷端银等[10]的方法。PHA的基础指标详见表1。
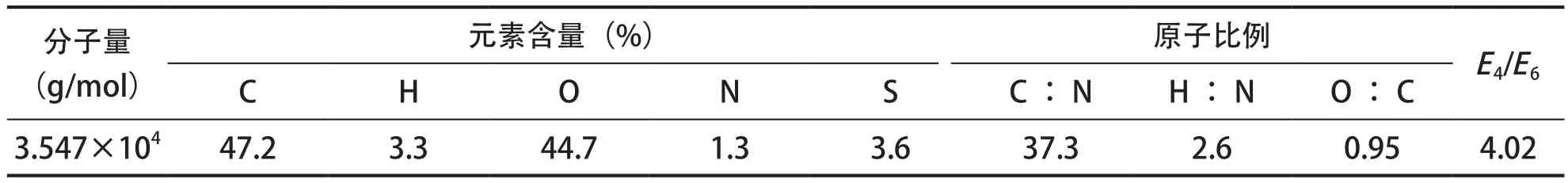
表1 PHA分子量、元素含量、原子比例及E4/E6Tab.1 Molecular weight, element content, atomic ratios and E4/E6 of PHA
1.2.2 测定项目与方法
参照赵世杰[11]的方法测定光合色素含量及可溶性糖含量;参照宁宇等[12]的方法测定蔗糖合酶(SS)、磷酸蔗糖合酶(SPS)活性;采用Elisa试剂盒说明书的指导方法测定1,5-二磷酸核酮糖羧化酶(RuBPCase)活性(试剂盒由上海邦奕生物科技有限公司提供)。以上每个指标均重复测定3次,取平均值和标准差进行数据分析。
气体交换参数的测定:用Li-6400型便携式光合作用测定系统(美国基因公司生产)于晴天上午9:00~11:00,测定顶端展开的第3片功能叶净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr),测定时光强约为800 μmol/m2·s,温度为30 ℃,空气中CO2浓度为(400±10)μmol/mol,每个处理随机选取5株黄瓜幼苗进行测定。水分利用效率(WUE)=Pn/Tr;气孔限制值(Ls)=1-Ci/Ca(Ca为大气中CO2的浓度)。
1.3 数据处理
采用Excel 2003软件进行数据处理和作图,采用DPS 7.55软件进行统计分析,采用Duncan法进行差异显著性检验。
2 结果与分析
2.1 PHA对氮胁迫下黄瓜幼苗叶片光合色素含量的影响
由表2可知,与对照相比,低氮、高氮胁迫处理的黄瓜幼苗光合色素含量(叶绿素a、叶绿素b、类胡萝卜素含量)均有所降低,其中叶绿素a、类胡萝卜素及叶绿素(a+b)含量各处理间差异达显著水平。对照添加PHA处理与未添加处理相比,叶绿素a含量、叶绿素b含量、类胡萝卜素含量及叶绿素(a+b)含量均显著增加。与对照比,低氮胁迫处理叶绿素a含量、叶绿素b含量、类胡萝卜素含量及叶绿素(a+b)含量略有增加但差异不显著,而高氮胁迫处理均显著增加。无论是否添加PHA,叶绿素a/b均在低氮胁迫下最大,添加PHA与未添加处理相比,低氮、高氮胁迫下比值增大,且均高于对照,但差异不显著。
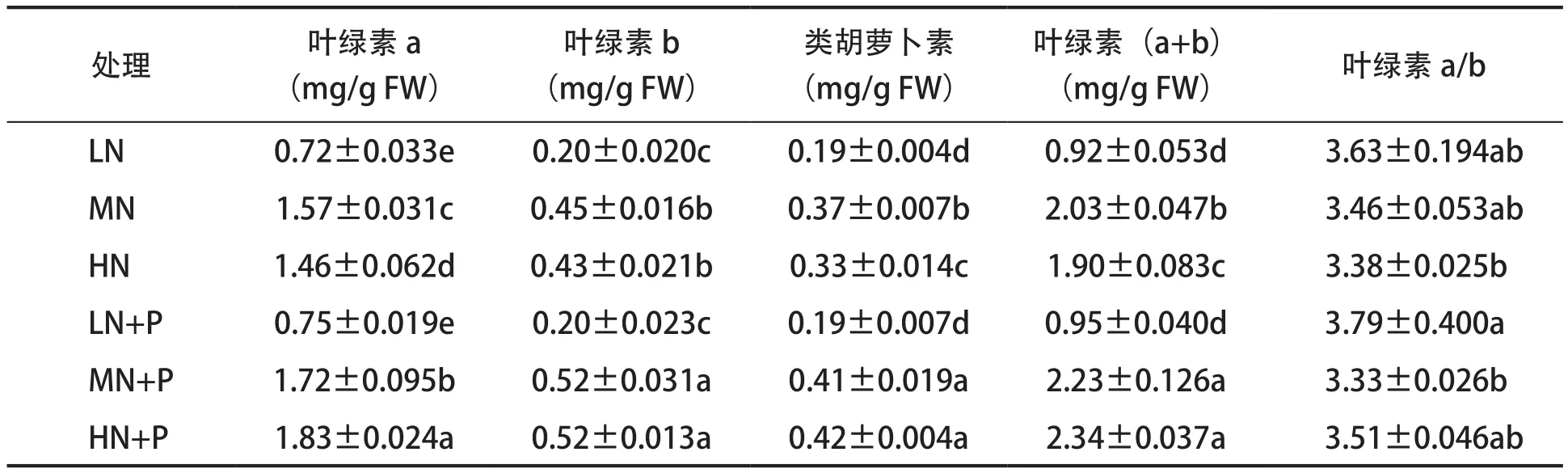
表2 PHA对氮胁迫下黄瓜幼苗叶片光合色素含量的影响Tab.2 Effects of PHA on photosynthetic pigment content of cucumber seedling leaves under nitrogen stress
2.2 PHA对氮胁迫下黄瓜幼苗叶片RuBPCase活性的影响
由图1可知,与对照相比,低氮、高氮胁迫处理的叶片RuBPCase活性均显著降低。对照、低氮胁迫下,添加PHA比未添加处理RuBPCase活性均显著提高;但高氮胁迫下RuBPCase活性显著降低。添加PHA处理RuBPCase活性以对照活性最高,而高氮胁迫处理活性最低。
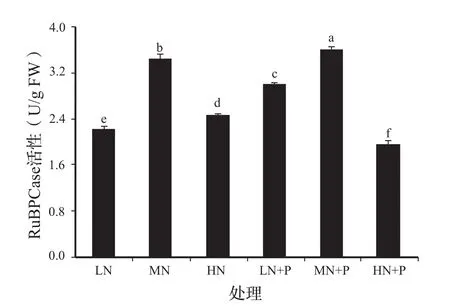
图1 PHA对氮胁迫下黄瓜幼苗叶片RuBPCase活性的影响Fig.1 Effects of PHA on RuBPCase activity of cucumber seedling leaves under nitrogen stress
2.3 PHA对氮胁迫下黄瓜幼苗叶片气体交换参数的影响
由表3可知,与对照相比,低氮、高氮胁迫处理的黄瓜叶片Pn均降低,3个处理间差异显著,以高氮胁迫处理黄瓜幼苗Pn最低。对照添加PHA后,Pn显著提高,低氮胁迫处理呈现相同趋势,而高氮胁迫处理略有降低,但差异不显著。说明添加PHA的低氮胁迫处理、对照可提高Pn,但高氮胁迫下PHA对Pn无显著促进作用。
与对照相比,低氮、高氮胁迫处理的黄瓜叶片Gs均降低,3个处理间差异显著,以高氮胁迫处理黄瓜幼苗Gs最低。对照添加PHA后,黄瓜幼苗Gs显著提高,在低氮、高氮胁迫下添加PHA,黄瓜幼苗Gs也提高,其中低氮胁迫下差异达显著水平,而高氮胁迫下差异不显著。说明添加PHA的低氮胁迫处理、对照可提高Gs,但高氮胁迫下PHA对Gs无显著促进作用。
与对照相比,低氮胁迫下黄瓜叶片Ci无显著差异,高氮胁迫下叶片Ci显著降低。各处理添加PHA后与未添加对应处理相比,Ci值均降低,其中,对照降低显著。说明添加PHA可降低Ci,对照表现差异显著。
与对照相比,低氮、高氮胁迫处理的黄瓜叶片Tr显著降低,以高氮胁迫下黄瓜叶片Tr最低。对照添加PHA比未添加处理Tr降低,差异达显著水平;而低氮胁迫下,黄瓜叶片Tr显著提高;高氮胁迫下,黄瓜叶片Tr显著降低。添加PHA后,低氮胁迫与对照间差异不显著,与高氮胁迫处理差异显著。说明添加PHA后在不同氮水平下,Tr表现不同,对照、高氮胁迫下显著降低,低氮胁迫下则相反。
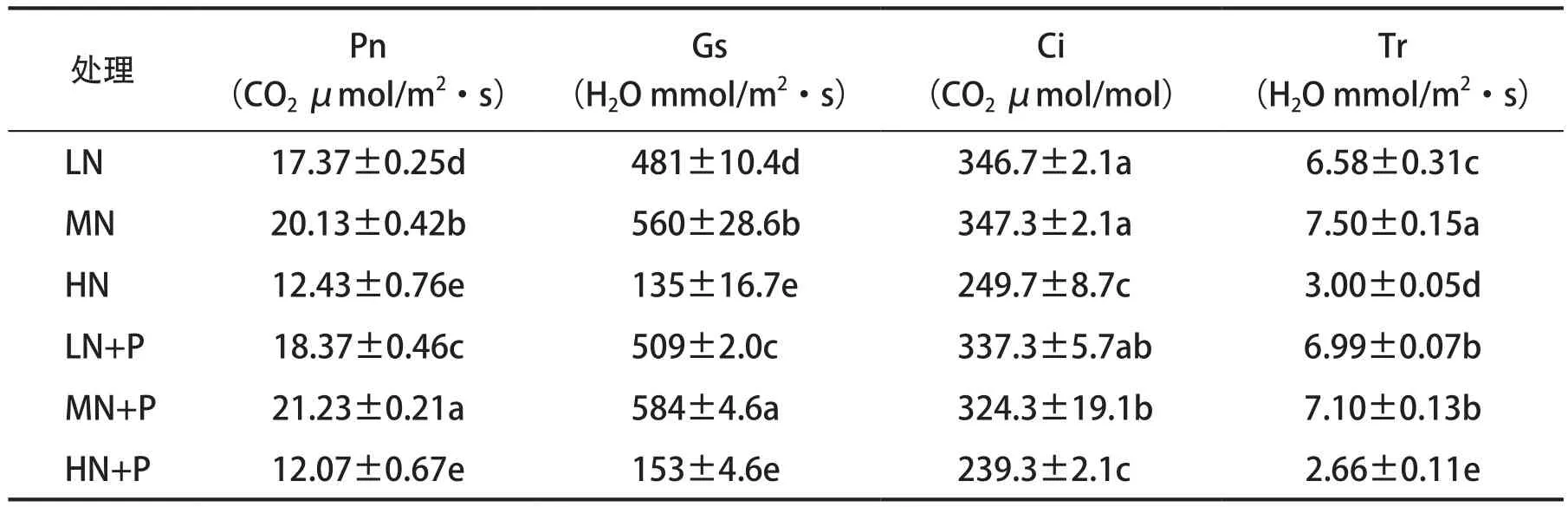
表3 PHA对氮胁迫下黄瓜幼苗叶片气体交换参数的影响Tab.3 Effects of PHA on gas exchange parameters of cucumber seedling leaves under nitrogen stress
2.4 PHA对氮胁迫下黄瓜幼苗叶片Ls及WUE的影响
由图2可以看出,与对照相比,低氮胁迫下黄瓜叶片Ls无显著差异,而高氮胁迫下显著增大。添加PHA的Ls均比未添加处理显著增大;低氮胁迫与对照间Ls无显著差异,但Pn显著不同,可能因为RuBPCase活性不同或光化学活性不同所致;而高氮下Ls显著增高,可能是其Pn显著降低的原因之一。
由图2可知,与对照相比,低氮胁迫黄瓜叶片WUE无显著差异,而高氮胁迫下WUE显著增大。添加PHA与未添加处理相比,低氮胁迫、对照的WUE略有升高,差异不显著;而高氮胁迫下,添加PHA后,WUE提高,且差异达显著性水平。高氮胁迫下WUE最大,可能主要因为显著降低的Tr所致。
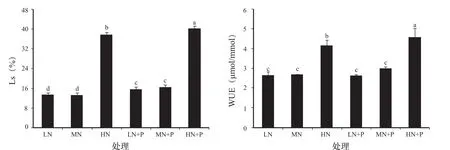
图2 PHA对氮胁迫下黄瓜幼苗叶片Ls和WUE的影响Fig.2 Effects of PHA on Ls and WUE of cucumber seedling leaves under nitrogen stress
2.5 PHA对氮胁迫下黄瓜幼苗可溶性糖含量的影响
由图3可知,与对照相比,低氮、高氮胁迫下黄瓜根系和叶片大量积累可溶性糖,尤其是低氮胁迫下,显著高于其他处理。添加PHA使黄瓜根系及叶片可溶性糖含量均呈增加趋势。
添加PHA对对照根系中可溶性糖含量影响不显著。而低氮、高氮胁迫下,添加PHA与未添加处理相比可溶性糖含量分别提高了32.3%、19.3%,差异显著。添加PHA使对照叶片中可溶性糖含量提高5.3%;低氮胁迫下含量提高16.7%,高氮胁迫下含量提高8.4%,差异均显著。
低氮胁迫下,植株形成相对较大的叶面积,产生大量光合产物,可溶性糖向根系大量的运输既有利于根系生长(低氮胁迫下两处理根冠比最大),又可为氮吸收同化提供充足的能量和碳架。高氮胁迫下,氮素同化与碳水化合物合成发生明显竞争性抑制,奢侈吸收的氮素被转化成蛋白质,积累相对较少,从而减少了向根系分配碳水化合物的数量。同时,高氮胁迫意味着较多的盐基逆境,可溶性糖积累相应增多,也是植株自身调节、提高抗逆性的表现。一方面,PHA可能是因为刺激黄瓜幼苗生长间接促成可溶性糖的积累;另一方面,PHA也有可能作为生物刺激素直接促进可溶性糖的合成。
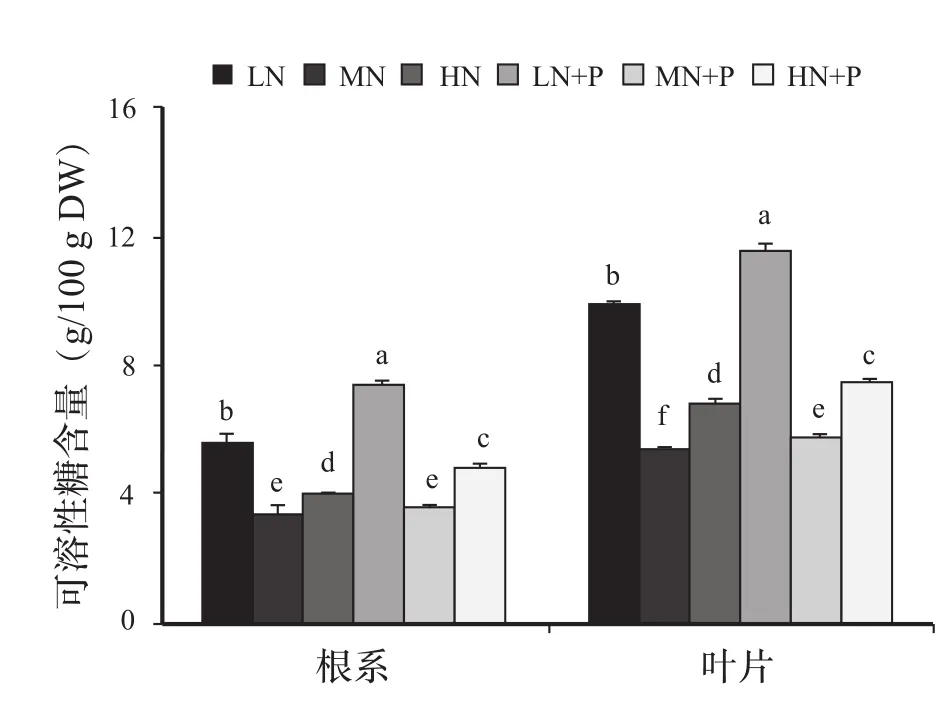
图3 PHA对氮胁迫下黄瓜幼苗可溶性糖含量的影响Fig.3 Effects of PHA on soluble sugar content of cucumber seedlings under nitrogen stress
2.6 PHA对氮胁迫下黄瓜幼苗SPS和SS活性的影响
由图4可知,根系中,与对照相比,低氮胁迫下SPS活性显著提高,而高氮胁迫下SPS活性显著降低。对照添加PHA处理使SPS活性显著降低;低氮胁迫下添加PHA处理SPS活性也显著降低;高氮胁迫下添加PHA处理反而使SPS活性显著升高(39.3%)。
叶片中,与对照相比,低氮、高氮胁迫下SPS活性均显著降低;对照添加PHA处理SPS活性显著降低;低氮、高氮胁迫下,添加PHA处理SPS活性显著提高,这也可能是叶片中对应低氮、高氮胁迫下可溶性糖含量较高的原因。
由图4还可看出,根系中,与对照相比,高氮胁迫下SS活性降低,低氮胁迫下几乎无变化,而高氮胁迫下差异达显著水平;对照添加PHA处理对SS活性影响不显著;低氮、高氮胁迫下,添加PHA处理SS活性均显著提高。
叶片中,与对照相比,低氮、高氮胁迫下使SS活性显著升高;对照添加PHA处理SS活性显著升高;在低氮和高氮胁迫下,添加PHA处理SS活性显著降低,这可能是叶片中较高含量的可溶性糖含量反馈抑制了SS活性。
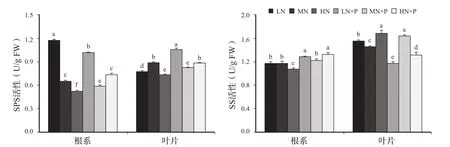
图4 PHA对氮胁迫下黄瓜幼苗SPS及SS活性的影响Fig.4 Effects of PHA on SPS and SS activity of cucumber seedlings under nitrogen stress
3 讨论
设施蔬菜生产中过量施肥现象目前仍较为普遍,设施土壤中硝酸盐积累是造成设施土壤次生盐渍化的主要原因之一[13,14]。轮作、增施有机肥及使用缓释肥等途径可缓解土壤中硝酸盐积累对蔬菜生长的影响,而近年来通过腐植酸提高蔬菜抗逆性的应用和研究也越来越多[4,5]。
植物叶片中的氮大部分以酶的形式存在于叶绿体和线粒体中[15],氮肥的施用除了直接影响植物的生长及氮代谢过程外,还会影响到植物的光合作用。本试验结果显示,与对照相比,低氮胁迫、高氮胁迫下Pn显著降低,尤其是高氮胁迫下Pn降低幅度较大;添加PHA后,低氮胁迫、对照的Pn显著增加,但高氮胁迫下Pn无显著变化;添加PHA显著促进了类胡萝卜素含量的增加,而类胡萝卜素可以猝灭三线态叶绿素和清除胁迫条件下的氧自由基,进而避免对光系统Ⅱ(PSⅡ)反应中心的直接破坏[16]。在低氮和高氮胁迫下,添加PHA也使叶绿素a/b值升高,有利于增强Pn[17]。
腐植酸可以调节气孔的开闭进而调节光合作用,提高植物的抗逆性。研究发现,不同来源的腐植酸(黄腐酸)均可抑制气孔开启、抑制K+在保卫细胞中的积累,类似脱落酸(ABA)的作用,腐植酸使用浓度以100 ppm为宜,并发现在pH值为5时所得的腐植酸抑制作用最大[18]。有研究者发现,从蚯蚓粪中提取的腐植酸与生长素(IAA)一样,通过活化磷脂酶A2诱导了气孔开放,而不是通过壳梭孢素及光照诱导的信号途径完成[19]。腐植酸浸种提高了Gs,降低了Ci,通过缓解叶肉细胞光合系统的损伤,调节气孔等因素而提高了盐碱胁迫下小麦的Pn[20]。
本研究结果显示,低氮胁迫、对照在添加PHA后,提高Gs,这有利于CO2快速同化、蒸腾作用加强和Pn提高;Ci降低,Pn升高,这可能与RuBPCase活性提高有关;而高氮胁迫下,RuBPCase活性降低,Ls增大,诱导气孔关闭,Gs降低,Tr降低,Pn降低,但WUE增大。
综上所述,氮胁迫下,PHA增加了光合色素含量、Pn、Ls,提高了WUE、根系及叶片SPS活性、根系SS活性,从而提高了黄瓜根系及叶片中可溶性糖含量,有效缓解了氮胁迫对黄瓜幼苗的影响,促进了黄瓜幼苗光合及碳代谢进程。
