制备方法对甲醇水蒸气重整制氢CuO/CeO2催化剂的影响
2019-04-29王东哲田志强张宣娇
王东哲,田志强,2,张宣娇,冯 旭,张 磊,白 金
(1. 辽宁石油化工大学 化学化工与环境学部,辽宁 抚顺 113001;2. 鞍山开炭热能新材料有限公司,辽宁 鞍山 114044)
随着我国经济不断地发展,能源供给出现短缺,开发新能源成为研究者的主要研究方向。氢由于其资源广泛、燃烧产物无污染等优点被研究者广泛关注[1]。在众多制氢方法中,甲醇水蒸气重整制氢是目前研究较为广泛的方法之一[2]。
铜基催化剂因为在低温下有较高的催化活性,重整气中一氧化碳含量较低,在甲醇水蒸气重整制氢反应中应用广泛。氧化铈作为催化材料具有很多优点,当氧化铈和金属之间相互作用时,会提高催化剂的催化活性,可以降低重整气中CO的浓度和防止催化剂烧结[3]。Benedetto 等[4]利用浸渍法制备了CuO/CeO2催化剂并将其应用于CO选择性氧化反应,发现采用比表面积大的CeO2纳米材料作为载体,可以获得高的Cu分散度,提高催化剂活性。Stanko等[5]采用共沉淀法和溶胶-凝胶法制备了CuO/CeO2催化剂,并将其应用于催化湿式氧化苯酚反应,实验结果表明,在反应条件相同时,溶胶-凝胶法制备的催化剂比共沉淀法制备的催化剂活性高出400百分点,这是因为溶胶-凝胶法制备的催化剂中铜物种更多地在载体表面分散。
本工作分别采用水热法、沉淀法和溶胶-凝胶法制备了CuO/CeO2催化剂,并应用于甲醇水蒸气重整反应,探索了不同制备方法对催化剂结构、性质和性能的影响。
1 实验部分
1.1 试剂
硝酸铜、硝酸铈、柠檬酸、氢氧化钠、乙醇胺、乙二醇、甲醇:分析纯,国药集团化学试剂有限公司。
1.2 催化剂的制备
1.2.1 水热法
将11 mol/L的NaOH溶液加入到100 mL含有Ce(NO3)3·6H2O(0.1 mol/L)和 Cu(NO3)2·3H2O(0.025 mol/L)的聚四氟乙烯内衬反应釜中(n(CuO)∶n(CeO2)=1∶4),加入乙醇胺溶液(硝酸铈与乙醇胺的摩尔比为3∶1),把反应釜移至125 ℃的烘箱里反应72 h,反应结束后冷却至室温。经抽滤、洗涤后滤饼放到85 ℃烘箱内干燥12 h,将固体粉末在空气气氛450 ℃下焙烧3 h,再经研磨、压片,粉碎成40~80目,得固体颗粒催化剂,记为CuO/CeO2-HT。
1.2.2 沉淀法
将 Cu(NO3)2·3H2O(0.025 mol/L)和 Ce(NO3)3·6H2O(0.1 mol/L)的混合溶液加入三口烧瓶中,将0.36 mol/L的氢氧化钠溶液在80 ℃下滴加到混合溶液中,待pH为9时停止滴加,在80 ℃下继续搅拌2 h后降至室温。经抽滤,洗涤,在85 ℃下干燥12 h,冷却后,将固体粉末在空气气氛450℃下焙烧3 h,再经研磨、压片,粉碎成40~80目,得固体颗粒催化剂,记为CuO/CeO2-CP。
1.2.3 溶胶-凝胶法
向Cu(NO3)2·3H2O(0.025 mol/L)和Ce(NO3)3·6H2O(0.1 mol/L)的混合溶液中加入乙二醇(Ce(NO3)3·6H2O与乙二醇的摩尔比为2∶1),在85 ℃下加热搅拌,再一次性向混合溶液中加入等物质的量的柠檬酸,待溶液呈黏稠状后移至烧杯中,放到烘箱中于85 ℃下干燥12 h,将固体粉末在空气气氛450 ℃下焙烧3 h,再经研磨、压片,粉碎成40~80目,得固体颗粒催化剂,记为CuO/CeO2-SG。
1.3 催化剂的表征
使用德国Bruker公司S8 TIGER型X射线荧光光谱仪对所制试样进行元素含量的测定。试样的物相组成和结构由德国Bruker公司的D8 Advance型X射线粉末衍射仪检测。采用美国Quantachrome公司NOVA2200E型物理吸附仪进行N2吸附-脱附表征,分别用BET法和BJH法对试样的比表面积和孔体积进行计算。采用美国康塔仪器公司的ChemBET Pulsar型化学吸附仪测定试样的H2-TPR,具体过程见文献[6]。XPS分析在上海禹重实业有限公司Thermo ESCALAB 250xi型光电子能谱仪上进行。
1.4 催化剂的评价
在自制固定床反应器上进行催化剂的评价,用量筒量取2 mL的催化剂,评价前需对催化剂进行还原,条件是用流量为100 mL/min 的5%(φ)H2-95%(φ)N2混合气在280 ℃下保持2 h。评价时开N2升至待测温度,关闭N2后,甲醇与水的混合溶液(水/甲醇摩尔比为1.2)经泵打入气化室中,甲醇的气态空速(GHSV)为800 h-1,反应生成的气体经冷凝器和干燥器脱去甲醇和水,气体进入北分瑞利公司SP1000型气相色谱仪进行分析。
利用甲醇转化率(X)和产氢速率(Y)评价催化剂的催化效果。计算式见式(1)~(2)。
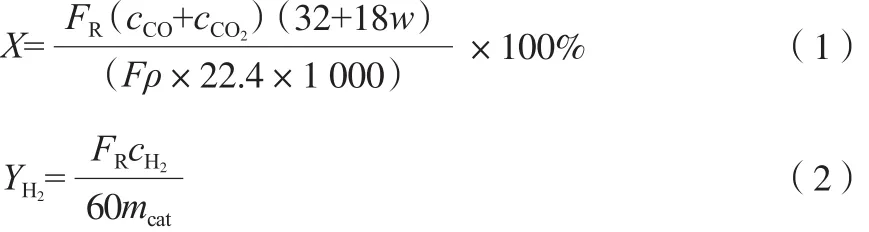
式中,FR为标况下反应出口气体总的流量,mL/min;F为原料甲醇水溶液的进料量,mL/min;ρ为原料甲醇水溶液的密度,g/cm3;w为水与甲醇的摩尔比;mcat为石英管中催化剂的质量,kg;cCO,cCO2,cH2分别为反应出口处CO,CO2,H2的含量,%。
2 结果与讨论
2.1 XRF分析结果
不同制备方法制备的CuO/CeO2-X催化剂的元素含量见表1。由表1可以看出,三种制备方法制备的CuO/CeO2-X(X=HT,CP,SG)催化剂的Cu、Ce和O含量基本相同,与制备计量比基本一致,说明制备方法对催化剂含量的影响很小。

表1 不同制备方法制备的CuO/CeO2-X催化剂的元素含量Table 1 Element contents of CuO/CeO2-X catalysts prepared by different preparation methods
2.2 XRD分析结果
图1为不同制备方法制备的CuO/CeO2-X催化剂的XRD谱图。从图1可看出,在2θ=28.8°,32.1°,48.1°,56.8°,69.5°,76.8°,79.3°处的特征衍射峰分别对应CeO2的(111),(200),(220),(311),(222),(400),(331),(420)晶面。出峰位置和相对强度都与标准卡片(JCPDS34-0394)相匹配,说明三种不同方法所制备的CuO/CeO2-X催化剂的CeO2均为立方晶系,属于萤石结构。CuO/CeO2-HT、CuO/CeO2-CP和CuO/CeO2-SG催化剂均在2θ=38.7°处出现了微弱的单斜相CuO特征衍射峰,说明铜结晶度较低,分散较好[7]。
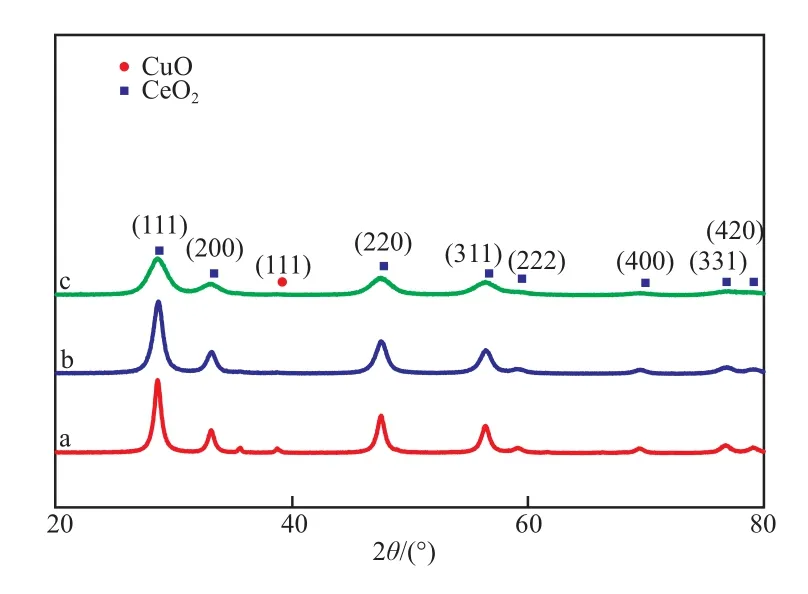
图1 不同制备方法制备的CuO/CeO2-X催化剂的XRD谱图Fig.1 XRD spectra of CuO/CeO2-X catalysts prepared by different preparation methods.
2.3 物化性质分析结果
图2为不同制备方法制备的CuO/CeO2-X催化剂的N2吸附-脱附等温线。从图2可知,不同制备方法制备的CuO/CeO2-X催化剂均属于H3型回滞环,说明催化剂的孔结构类似于裂隙孔。
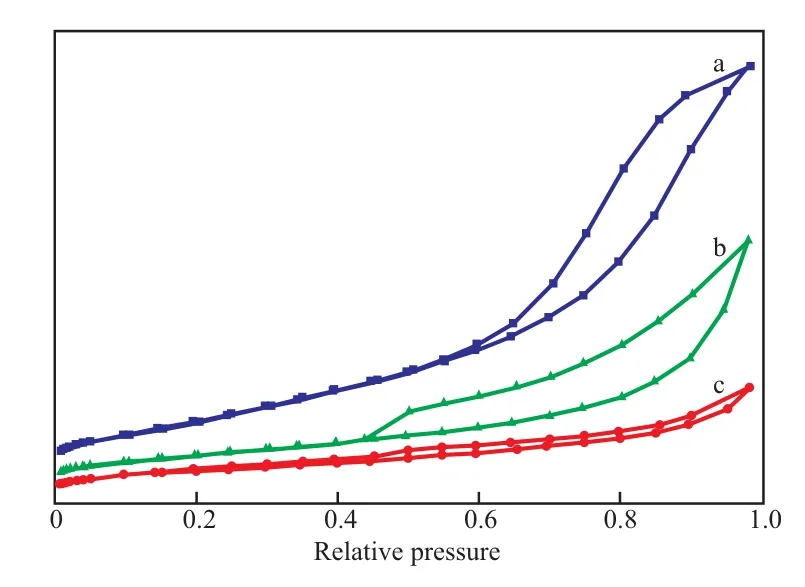
图2 CuO/CeO2-X催化剂的N2吸附-脱附等温线Fig.2 N2 adsorption-desorption isotherms of prepared CuO/CeO2-X catalysts.
CuO/CeO2-X催化剂的孔径分布见图3。从图3可看出,不同制备方法制备的CuO/CeO2-X催化剂的孔径分布大致为3~15 nm,属于介孔材料,但通过水热法制备的CuO/CeO2-HT催化剂的孔径主要集中在8~10 nm,而通过沉淀法和溶胶-凝胶法制备的CuO/CeO2-CP和CuO/CeO2-SG催化剂的孔径主要集中在3~4 nm。这是因为反应物甲醇和水以及产物氢气、一氧化碳和二氧化碳都是小分子,在介孔内可自由出入,因此通过不同方法制备的CuO/CeO2-X催化剂不会对甲醇水蒸气重整制氢反应造成影响。

图3 CuO/CeO2-X催化剂的孔径分布Fig.3 Pore diameter distribution of prepared CuO/CeO2-X catalysts.
不同制备方法制备的CuO/CeO2-X催化剂的比表面积和孔体积见表2。从表2可看出,CuO/CeO2-HT、CuO/CeO2-CP和CuO/CeO2-SG催化剂的比表面积分别为85.80,72.01,49.76 m2/g。水热法制备的CuO/CeO2-HT催化剂的比表面积最大,比表面积最小的是溶胶-凝胶法制备的CuO/CeO2-SG催化剂。有研究表明催化剂的比表面积越大,催化活性越好[8-9],因此水热法制备的CuO/CeO2-HT催化剂的催化活性较好。

表2 催化剂的物化性质Table 2 Physical and chemical properties of prepared catalysts
2.4 H2-TPR分析结果
图4是CuO/CeO2-X催化剂的H2-TPR谱图,Shang等[9]对CeO2的还原峰进行研究发现,CeO2的还原峰一般在413 ℃以上出现,所以图4中出现的还原峰归属于不同CuO物种的还原。由图4可知,CuO/CeO2-X催化剂的还原温度均明显低于纯CuO的还原温度(340 ℃)[10],说明Cu与Ce的相互作用促进了CuO的还原。CuO/CeO2-X催化剂均出现了三个重叠交错的还原峰,对应不同CuO物种的还原,第1个还原峰归属于CuO与CeO2作用较强的表相CuO物种的还原峰;第2个还原峰归属于CuO与CeO2作用较弱的表相CuO物种的还原峰;第3个还原峰是体相CuO物种的还原峰[11]。
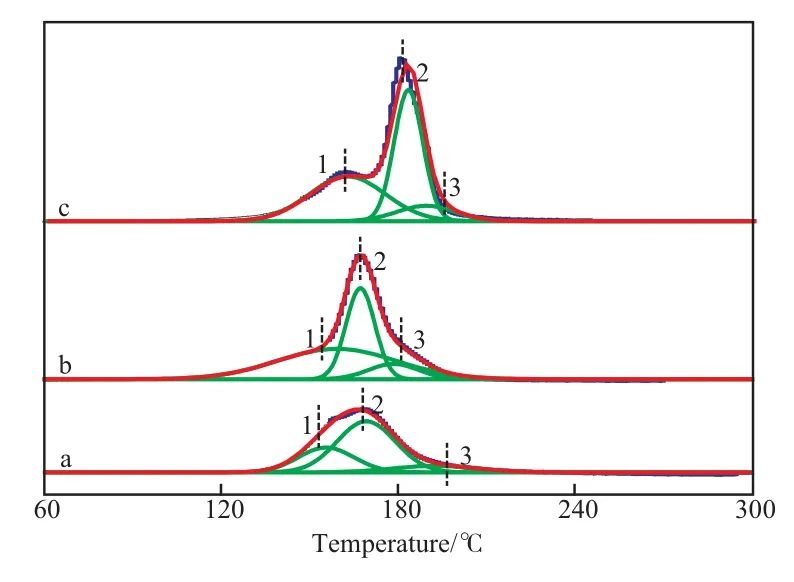
图4 CuO/CeO2-X催化剂的TPR谱图Fig.4 TPR patterns of CuO/CeO2-X catalysts.
表3为CuO/CeO2-X催化剂的各个还原峰峰位置和峰面积,CuO/CeO2-HT催化剂的表相CuO物种峰面积(峰1和峰2之和)略大于CuO/CeO2-CP和CuO/CeO2-SG催化剂,说明与CeO2发生相互作用的高分散状态的铜物种略多。另外,水热法制备的催化剂还原温度最低,表明其Cu与Ce的作用较强,从而使得CuO的还原温度降低。一般来说,催化剂的催化活性受CuO还原温度的影响,CuO还原温度越低,催化剂的催化活性越高[12],这就是水热法制备的催化剂催化活性较好的原因之一。

表3 不同方法制备的催化剂的TPR峰面积和温度Table 3 Area and temperature of TPR peaks for the catalysts prepared by different methods
2.5 XPS分析结果
图5为 CuO/CeO2-X催化剂的Cu 2p XPS谱图,图6为CuO/CeO2-X催化剂的Cu俄歇谱图。从图5和图6可知,933.5 eV处特征峰归属于Cu 2p3/2电子结合能,952.8 eV处特征峰归属于Cu 2p1/2电子结合能,937~948 eV处的特征峰归属于Cu2+离子卫星峰[13]。Cu 2p3/2的电子结合能在933.5 eV处,与文献中Cu 2p3/2的电子结合938.8 eV相比,向高结合能方向移动,说明催化剂中可能有其他Cu物种存在,可能为 Cu+和(或)Cu0[14]。由于Cu+和Cu0离子在XPS图谱中的峰位置和峰形相似,所以在谱图中很难分辨,为了更详细地分辨CuO/CeO2-X催化剂表面铜物种,进行了Cu的俄歇谱图分析,其中,917.3 eV和914.4 eV处的特征峰分别对应于Cu2+和Cu+离子的电子结合能。Cu0的俄歇电子结合能为918.6 eV,比Cu2+和Cu+的俄歇电子结合能都高[15],因此证明CuO/CeO2-X催化剂中不含Cu0物种。所制备的CuO/CeO2-X催化剂的表面上形成Cu+离子有利于Ce3+的存在[16]。实际上,CeO2将Cu2+还原为Cu+,说明了铜和铈之间具有强烈的相互作用。Cao等[17]报道铜基催化剂具有高活性和稳定性,由于在甲醇蒸气重整制氢反应中Cu和Ce之间强烈的相互作用形成了Cu+,因此Cu和Ce之间强烈的相互作用有利于提高催化剂的活性。这些结果还表明,Cu与Ce载体之间较强的相互作用有利于Cu+的稳定存在及使氧化铜物种的还原温度降低,这些因素使CuO/CeO2-HT催化剂对甲醇蒸气重整具有很高的催化活性。
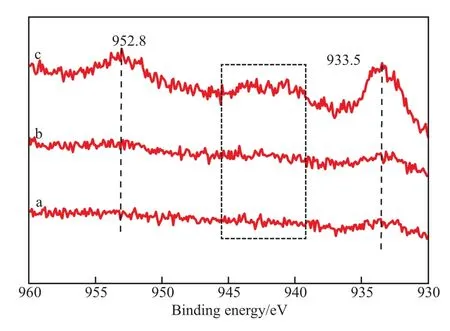
图5 CuO/CeO2-X催化剂的Cu 2p XPS谱图Fig.5 Cu 2p XPS spectra of CuO/CeO2-X catalysts.
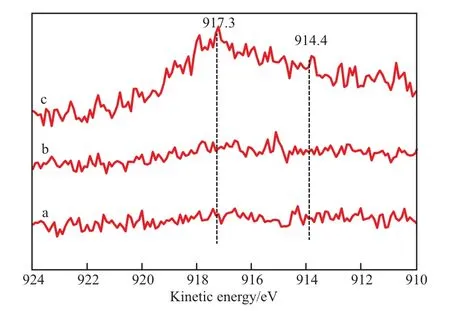
图6 CuO/CeO2-X催化剂的Cu俄歇谱图Fig.6 Cu Auger spectra of CuO/CeO2-X catalysts.
图7为CuO/CeO2-X催化剂的Ce 3d XPS谱图。从图7可知,u-u′′′处的卫星峰归属于Ce 3d3/2自旋轨道特征峰,v-v′′′处卫星峰归属于Ce 3d5/2自旋轨道特征峰。u′和v′处的卫星峰分别归属于Ce3+的3d3/2能级和3d5/2电子结合能。而其他峰归属于Ce4+离子[18]。表明CuO/CeO2-X催化剂表面均存在Ce3+和Ce4+,Ce4+到Ce3+的还原伴随着氧空位的形成。表面氧空位的存在对甲醇水蒸气重整有积极影响。对于甲醇水蒸气重整,活性物质Cu+的产生需要表面氧空位;还有水的分解以及氢气的形成也需要表面氧空位[19]。
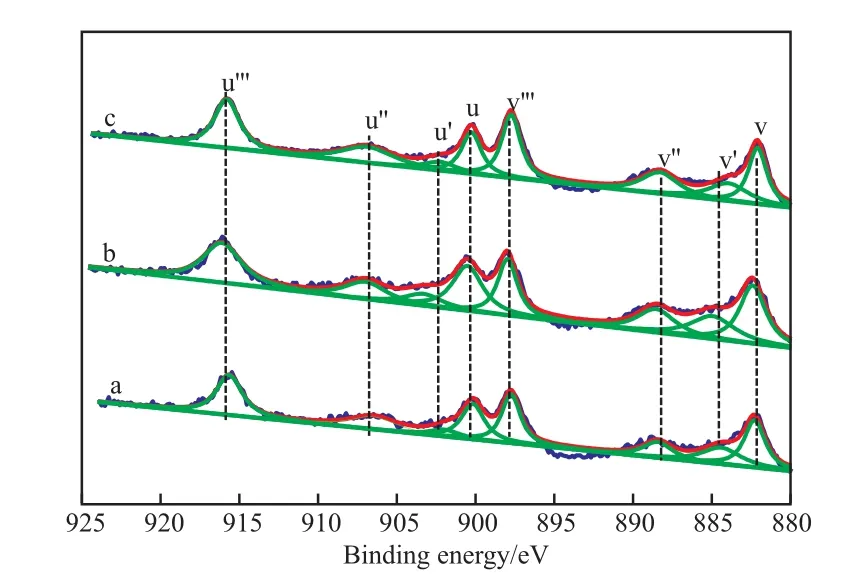
图7 CuO/CeO2-X催化剂的Ce 3d XPS谱图Fig.7 Ce 3d XPS spectra of CuO/CeO2-X catalysts.
CuO/CeO2-X催化剂的O 1s XPS谱图见图8。从图8可看出,所有制备的催化剂的O 1s XPS谱图在529.1 eV和531.1 eV附近出现两个峰。在529.1 eV附近的较低结合能峰归属于与金属阳离子结合的晶格氧,在531.1 eV附近的较高结合能峰归属于除晶格氧之外的氧物质,如吸附在催化剂上的羟基上的氧和吸附氧。表面氧物种和表面氧空位的共存对氧化还原过程具有协同效应。一方面,甲醇的分解和氧化需要表面氧物种;另一方面,H2O的分解和H2的形成需要表面氧空位。
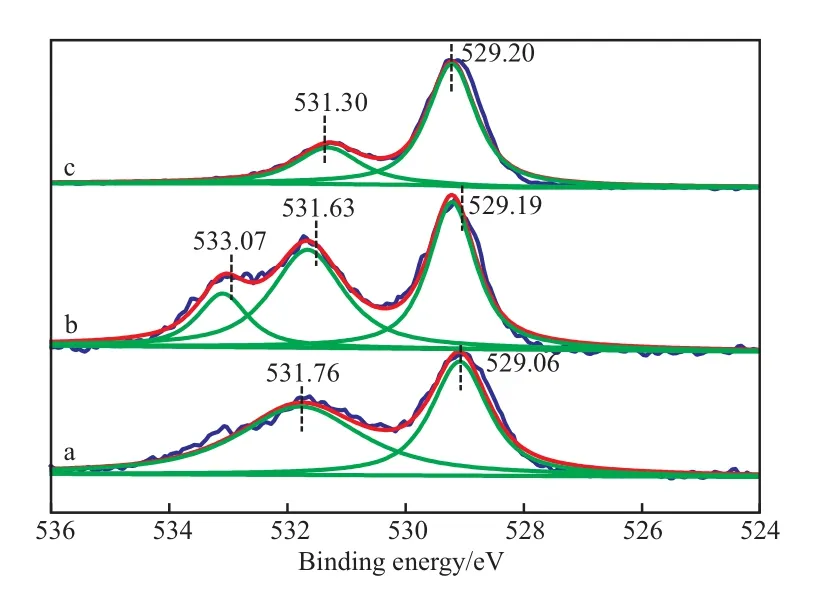
图8 CuO/CeO2-X催化剂的O 1s XPS谱图Fig.8 O 1s XPS spectra of CuO/CeO2-X catalysts.
2.6 催化剂的性能评价
图9是不同制备方法制备的CuO/CeO2-X催化剂催化甲醇水蒸气重整制氢反应活性评价曲线。从图9可看出,在反应温度为240~300 ℃,水醇摩尔比为1.2,GHSV为8 00 h-1时不同制备方法制备的CuO/CeO2-X催化剂催化活性高低顺序为:CuO/CeO2-HT>CuO/CeO2-CP>CuO/CeO2-SG,产生这种差别的主要原因与催化剂的比表面积、催化剂的还原性质及CeO2与CuO之间的相互作用的强弱有关。CuO/CeO2-HT催化剂的比表面积最大,CuO的还原温度较低,CeO2与CuO之间的相互作用较强,因此CuO/CeO2-HT催化剂表现出最佳的催化活性,甲醇转化率最高达93%。
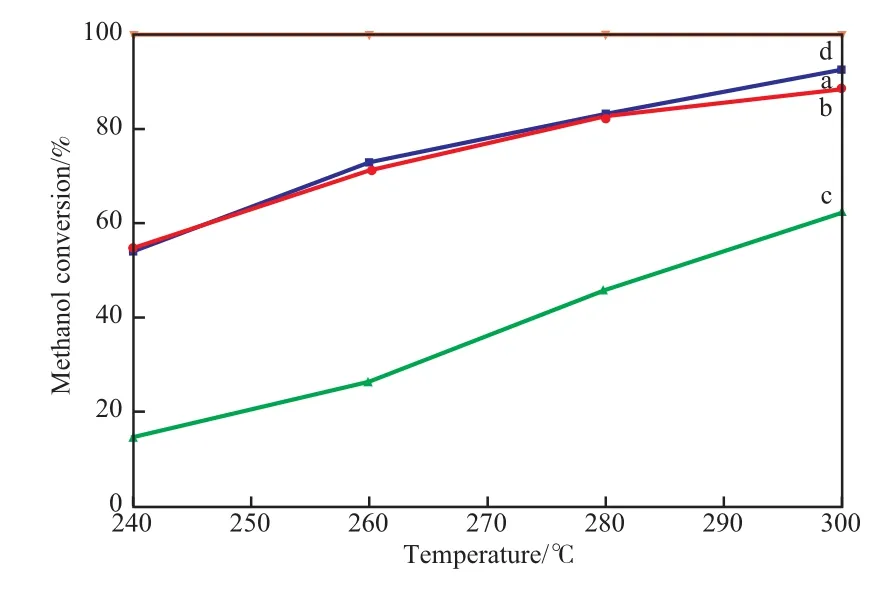
图9 CuO/CeO2-X催化剂在不同反应温度下的催化活性Fig.9 Catalytic activity of the CuO/CeO2-X catalysts at different reaction temperatures.
图10为不同反应温度下的产氢速率。从图10可看出,所有催化剂的产氢速率与反应温度成正比,另外,CuO/CeO2-HT和CuO/CeO2-CP催化剂的产氢速率较高,在300 ℃下,产氢速率分别为432 mL/(kg·s) 和 394 mL/(kg·s), 而 CuO/CeO2-SG催化剂的产氢速率较低,仅有308 mL/(kg·s)。

图10 不同反应温度下催化剂的产氢速率Fig.10 Hydrogen production rate of the catalysts at different reaction temperatures.
图11为不同制备方法制备的CuO/CeO2-X催化剂在不同反应温度下的CO含量。从图11可看出,随温度的升高,催化剂的活性逐渐变大,重整气中的CO含量也逐渐增加,但反应气中CO含量都低于热力学平衡含量。已有研究表明CO主要是由逆水气变化产生的[20],随着反应温度的升高,催化剂的反应活性也在增强,同时逆水气变化反应和甲醇直接分解反应的催化效果也随之增加。因此反应产物中的CO的含量随之增加。虽然CuO/CeO2-SG催化剂的CO选择性比其他两种催化剂都要低,但是整体催化活性较差,当反应温度升高到300 ℃以上时,也很难达到较好的甲醇转化率,因此CuO/CeO2-HT催化剂活性最好。
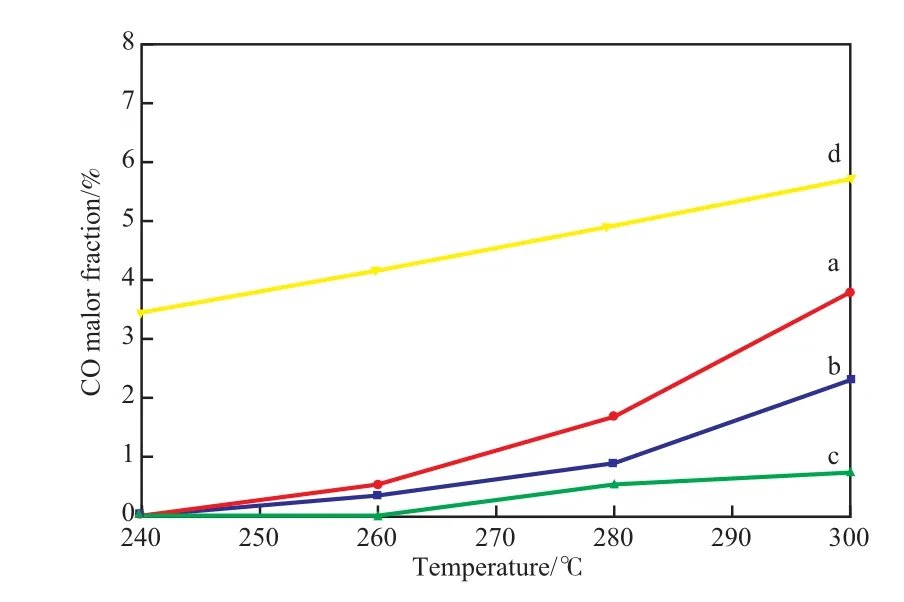
图11 不同反应温度下重整气中CO含量Fig.11 CO content in reformed gas at different reaction temperatures.
3 结论
1)Cu与Ce载体之间的较强的相互作用有利于Cu+的稳定存在以及使氧化铜物种的还原温度降低。
2)催化剂的活性组分CuO的还原温度越低,CuO与载体CeO2的相互作用越强,催化活性越好。
3)水热法制备的CuO/CeO2催化剂催化性能最好,当反应温度为300 ℃,水醇摩尔比为1.2,甲醇GHSV为800 h-1时,甲醇转化率达93%。
