常压室温等离子体诱变选育高产油脂皮状丝孢酵母的研究
2019-04-29许鹏飞郭金玲吕育财龚大春
许鹏飞,郭金玲,2,吕育财,2,涂 璇,2,龚大春,2
(1.三峡大学天然产物研究与利用湖北省重点实验室,湖北 宜昌 443002; 2.三峡大学湖北省生物酵素工程技术研究中心,湖北 宜昌 443002)
微生物油脂是利用酵母菌、藻类、霉菌等微生物在一定生长条件下,通过代谢在体内积累所产生的一种特殊油脂,其主要成分为甘油三酯(TAG),在组成上与植物油相似,以C16和C18为主[1]。微生物油脂可以作为生物柴油的原料,其产油微生物可实现大规模培养。但目前微生物油脂的产量不高,高产菌株的选育成为微生物油脂产业化的瓶颈[2-3]。
常压室温等离子体(ARTP)诱变育种技术是通过氦气大气压射频辉光放电,产生系列活性氧化物和活性氮化物等离子体,攻击微生物DNA,引起DNA的磷氧键和氮氧键断裂,实现DNA重组,从而产生突变体的一种新技术。该技术操作在常压室温下进行,具有活性粒子种类多样、成本低、使用简便、安全性高、无污染、突变谱广、突变率高等优势,被广泛用于酵母、霉菌等微生物的生物育种[4]。
建立高效的高产油脂菌株的筛选方法是ARTP诱变育种研究重点[5-6]。王美珠[7]研究发现,在酵母脂肪酸合成途径中,苹果酸酶是产油代谢途径中的关键性酶,而芝麻酚是苹果酸酶的抑制剂,如果将芝麻酚加入培养基中则可以抑制苹果酸生成丙酮酸和NADPH,从而抑制脂质积累[8-9],由此可用于诱变菌株的初筛。Kimura[10]、林义[11]等报道利用尼罗红荧光染色测量油脂的方法,具有较高的准确率,如果采用荧光酶标仪可望实现多孔板的高通量筛选。
因此,本文使用ARTP诱变仪对皮状丝孢酵母(Trichosporoncutaneum)进行处理后,通过添加一定质量浓度的芝麻酚抗性标记初筛,然后将初筛菌株接种到多孔板培养后进行尼罗红荧光检测高通量筛选,得到增殖迅速、油脂产量高的优势突变菌株,并对其遗传稳定性和菌株油脂成分开展进一步研究,为后续的发酵培养优化奠定基础。
1 材料与方法
1.1 实验材料
皮状丝孢酵母(Trichosporoncutaneum),来自三峡大学艾伦麦克德尔米德研究所;氯仿、甲醇、尼罗红等均为分析纯;十六烷酸甲酯、硬脂酸甲酯、油酸甲酯、亚油酸甲酯标准品,购于TMRM公司。常压室温等离子体(ARTP)诱变仪,Tecan Infinite®200 Pro多功能酶标仪,福立GC9720气相色谱仪。
平板培养基:葡萄糖20 g/L,蛋白胨 20 g/L,酵母浸粉10 g/L,琼脂粉 20 g/L。
种子液培养基:蔗糖 25 g/L,酵母浸膏 6 g/L,麦芽浸粉 5 g/L,Na2HPO44 g/L,KH2PO41 g/L,MgSO40.5 g/L,1×105Pa灭菌20 min。
发酵培养基:葡萄糖 60 g/L,酵母浸膏 6 g/L,麦芽浸粉 5 g/L,Na2HPO44 g/L,KH2PO41 g/L,MgSO40.5 g/L,1×105Pa灭菌20 min。
1.2 实验方法
1.2.1 菌株培养
将保存的原始菌株接种到斜面中,30℃培养3 d。然后将斜面上的菌种取1环接种到100 mL种子液中,在28℃、200 r/min的摇床中培养18 h。
1.2.2 高产菌株ARTP诱变筛选
将培养好的菌株,先进行ARTP诱变条件的优化,然后通过芝麻酚抗性标记进行初筛,挑选优势菌落,接种到多孔板中培养,通过添加尼罗红荧光试剂,挑选荧光强度大的菌株,经摇瓶培养,提取油脂,气相检测,得到优势菌株。具体流程如下。
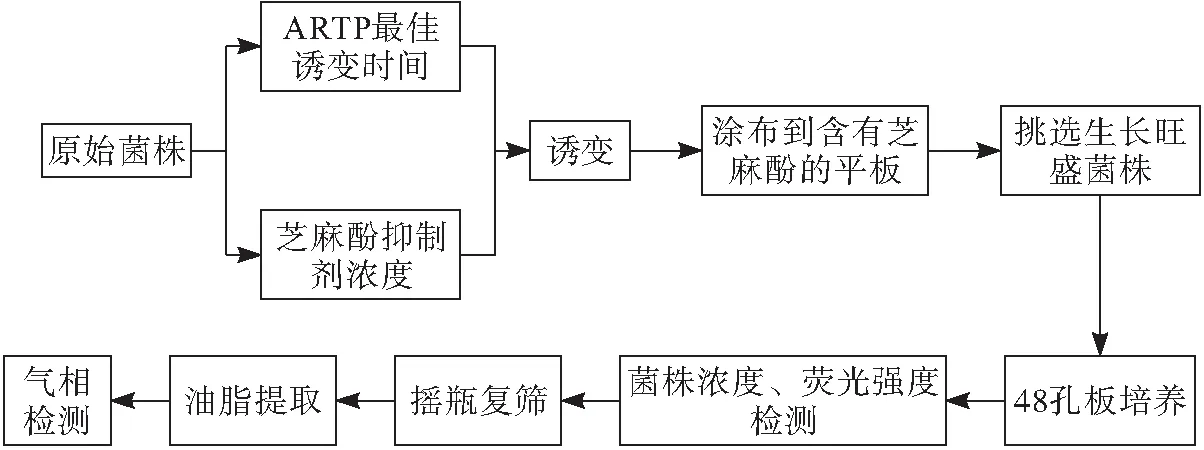
1.2.3 诱变致死率计算
先将种子液制成OD600值为1.0的菌悬液,将ARTP诱变仪的温度保持在20℃,调节功率为120 W,氦气流量为10 L/min[11]。吸取10 μL菌悬液点到已用酒精灼烧30 s的金属载片上,将载片放入到诱变室内,发射体距离菌悬液2 mm,使用不同的时间(0、10、20、30、40、50、60 s)进行诱变处理,将诱变的菌体放入1 mL的生理盐水中振摇1 min,取100 μL涂布到平板培养基上28℃培养2 d,计算致死率。
1.2.4 芝麻酚质量浓度筛选
配制62.5 mg/mL的芝麻酚溶液,分别添加0、40、80、120、160 μL到50 mL的平板培养基中,最终质量浓度为0、0.05、0.1、0.15、0.2 mg/mL。将OD600值为1.0的菌悬液取100 μL涂布到含芝麻酚的抗性平板上,28℃培养2 d,观察菌体生长情况。
1.2.5 优势菌株的高通量筛选
先将平板上诱变的菌株用竹签接种到48孔1 mL 的液体培养基中,在30℃、200 r/min的微孔板恒温摇床中培养,每隔24 h,取150 μL菌液到96孔板中用酶标仪检测600nm处的吸光度,测定生物量。
每个孔板添加7.5 μL尼罗红染液,混合均匀,避光染色5 min,用酶标仪以485 nm的发射波长、595 nm的吸收波长检测细胞油脂荧光强度,以没有添加尼罗红染液的荧光强度为空白对照,筛选出油脂含量高的诱变菌株。
1.2.6 发酵培养
将筛选得到的高油脂含量的菌株和低油脂含量的菌株分别接种到种子液中培养18 h,取10%种子液接种到发酵培养基中28℃、200 r/min培养,每隔24 h检测菌株浓度和油脂含量,连续检测10 d。
1.2.7 油脂提取
将发酵培养90 h的菌液8 500 r/min离心10 min,将菌体放到已烘干称重的试管中,一起放入80℃烘箱中烘干至恒重,计算菌体得率。每克干菌体加入适量 8 mol/L的盐酸,混合均匀后室温静置1 h,沸水浴处理10 min,迅速冷却,恢复到常温后加入2倍体积的氯仿-甲醇(体积比2∶1)溶液,混匀后室温静置30 min,于4 500 r/min离心10 min。萃取得氯仿层,上层溶液再加10 mL氯仿,振荡均匀,离心,进行二次萃取得氯仿层,合并氯仿层。旋转蒸发除去氯仿得油脂,称重。
1.2.8 遗传稳定性分析
将诱变菌株在平板培养基上连续传代10次,再进行发酵培养,检测菌株的荧光强度变化,研究其遗传稳定性。
1.2.9 油脂脂肪酸组成分析
取1 mL油脂放入15 mL离心管中,加入3 mL正己烷,浸润提取15 min后,再加入0.4 mol/L的KOH-CH3OH溶液1 mL,振荡摇匀后放于50℃水浴15 min左右,取出后沿管壁加入5%NaCl溶液,静置分层后,用注射器取其上层清液,经过滤后加入1.5 mL的气相色谱样品瓶内,进行气相分析。气相分析条件参考朱启思等[12]方法进行检测。
2 结果与讨论
2.1 ARTP诱变时间对Trichosporon cutaneum致死率的影响
研究表明,等离子体中的活性粒子作用于微生物,能够使微生物细胞壁/膜的结构及通透性改变,并引起基因损伤,进而使微生物基因序列及其代谢网络显著变化,最终导致微生物产生突变[13]。诱变时间和强度对微生物致死率的影响较大。致死率过低或过高都不利于筛选。本实验采用1.2.3的方法,在不同诱变时间下,考察皮状丝孢酵母的致死率与时间关系,结果见图1。
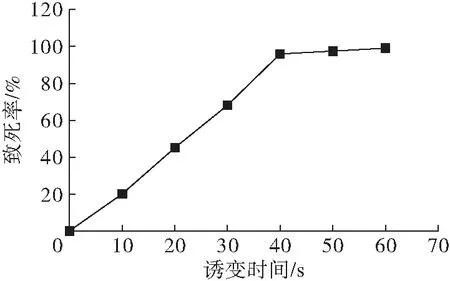
图1 皮状丝孢酵母ARTP致死率曲线
从图1可以看出,ARTP对Trichosporoncutaneum的杀伤力较强,致死率在10~40 s之间呈现直线增长方式,经35 s 诱变后菌体致死率为80%左右, 40 s 的时候致死率就达到了95%左右,当诱变时间达到60 s的时候,菌体基本上全部不能存活。为了保证一定的正负突变率,选择一定的诱变时间至关重要。因此,选择致死率达到95%左右的40 s为最佳诱变时间。
2.2 芝麻酚质量浓度对诱变菌株生长的影响
选取不同质量浓度芝麻酚,按照1.2.4方法进行研究。不同质量浓度芝麻酚对Trichosporoncutaneum生长的影响如图2所示。
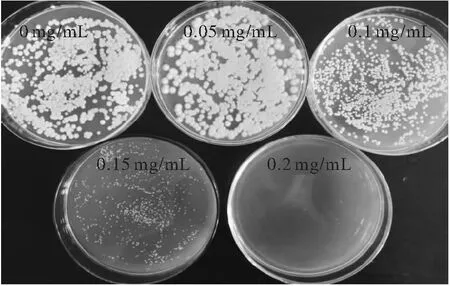
图2 不同质量浓度芝麻酚对Trichosporon cutaneum生长的影响
从图2可以看出,芝麻酚能抑制Trichosporoncutaneum菌株的生长。在低质量浓度(0.05 mg/mL)时,抑制作用较小,当芝麻酚质量浓度达到0.1 mg/mL时,菌落数量明显减少,生长受到抑制作用,菌落形态也发生了一些变化。当芝麻酚质量浓度达到0.15 mg/mL时,抑制大大增强,菌落数量大幅减小。若继续加大芝麻酚质量浓度,菌株停止生长。为了保证菌株的生长情况较好,又便于筛选,选取0.15 mg/mL的芝麻酚作为筛选培养基中的最佳质量浓度,用于芝麻酚抗性标记筛选。
2.3 ARTP诱变高通量菌株筛选
综合考虑ARTP致死率情况和芝麻酚的抑制效果,将OD600值为1.0的种子菌悬液,用ARTP诱变仪以120 W的功率处理40 s,再将诱变的菌株涂布到含有0.15 mg/mL芝麻酚的平板培养基上28℃培养2 d。挑选生长旺盛的40个单菌落菌株用无菌竹签接种到48孔培养基中,每隔24 h检测菌株浓度和荧光强度。图3显示了原始菌株荧光强度为1.0时,40个诱变菌株培养6 d时的相对荧光强度。
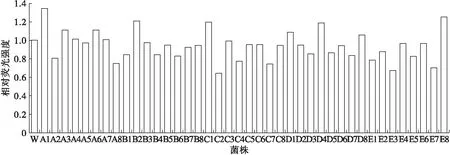
图3 诱变菌株的相对荧光强度
从图3可以看出,大多数诱变菌株的荧光强度低于原始菌株(W),但有两株诱变菌株TrichosporoncutaneumA1、E8的荧光强度高于原始菌株20%以上。同时也有荧光强度比原始菌株低很多的,其中菌株C2最低,说明其脂肪酶合成途径的关键基因受到极大影响,为了验证荧光强度与油脂积累的关系,以及为了后期探究诱变菌株基因层面上的变化,特将正突变诱变菌株TrichosporoncutaneumA1、E8和负突变诱变菌株TrichosporoncutaneumC2同时进行进一步复筛,为后期的进一步发酵和基因水平的比较做准备。
2.4 诱变菌株的发酵培养复筛
将诱变菌株TrichosporoncutaneumA1、E8、C2和原始菌株(W)进行种子液和摇瓶发酵培养,每天检测荧光强度,进行复筛, 其10 d的检测结果如图4所示。
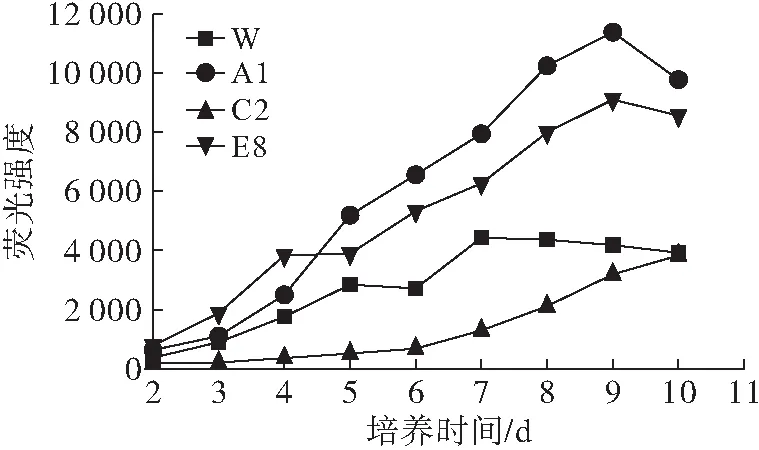
图4 诱变菌株与原始菌株的荧光强度随时间的变化
从图4可以看出,初筛得到的优势菌株TrichosporoncutaneumA1、E8在摇瓶发酵中的荧光强度明显高于原始菌株,菌株荧光强度增加较快,预示着诱变菌株的脂质积累量较大,在发酵9 d时的荧光强度达到最大,为原始菌株的300%左右,负突变诱变菌株C2的脂质积累一直低于原始菌株且积累缓慢。
为了进一步验证诱变菌株的油脂积累情况,将这4个菌株摇瓶培养9 d后,按照1.2.7的方法提取细胞内油脂,分析其生物量、油脂产量和含量变化,结果如表1所示。
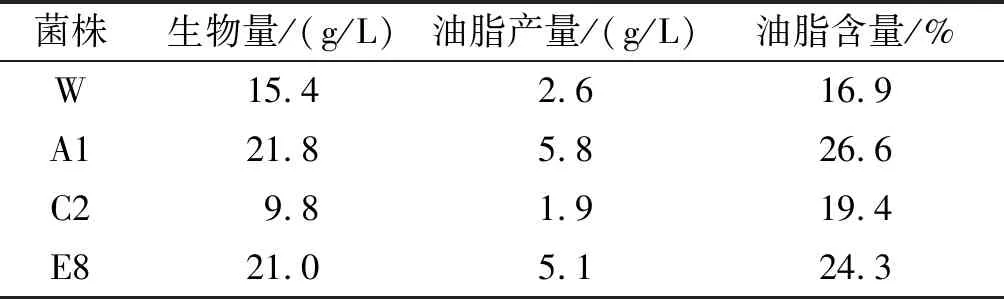
表1 皮状丝孢酵母诱变菌株的复筛结果
由表1可知,经诱变筛选的诱变菌株TrichosporoncutaneumA1比TrichosporoncutaneumE8综合指标好,较原始菌株产油脂能力有了很大提高,其生物量、油脂产量、油脂含量分别提高了41.6%、123.1%、57.4%。在摇瓶培养中,TrichosporoncutaneumA1的油脂产量达到了5.8 g/L,远高于原始菌株,而负突变诱变菌株C2油脂产量下降26.9%。由此可见,本筛选方法用于优势诱变菌株筛选是行之有效的。
2.5 遗传稳定性
为了检验优势诱变菌株TrichosporoncutaneumA1能否保持稳定的遗传特性,将诱变菌株A1连续传代培养10次,并同时进行发酵培养,检测菌株的荧光强度, 结果如图5所示。
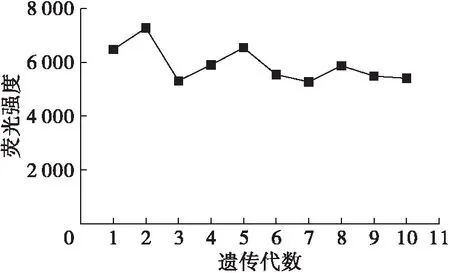
图5 诱变菌株A1连续传代10次的荧光强度
从图5可以看出,从第1代到第10代诱变菌株A1的荧光强度基本保持稳定,传代至第10代,诱变菌株A1的荧光强度仍然能达到第一代的90%,可见诱变菌株具有良好的遗传稳定性,能稳定生产油脂。
2.6 油脂脂肪酸组成
对诱变菌株TrichosporoncutaneumA1所产油脂用气相色谱法进行脂肪酸组成测定,结果如表2所示。

表2 原始菌株和诱变菌株A1的脂肪酸组成及含量 %
从表2可以看出,诱变前后菌株中的油脂脂肪酸组成相同。而诱变菌株A1的油脂脂肪酸含量与原始菌株相比,十六烷酸、硬脂酸、亚油酸的相对含量略有提高,而油酸的相对含量下降了3.89个百分点,其变化的原因有待进一步研究。
3 结 论
本文建立了芝麻酚初筛和尼罗红荧光多孔板检测的高通量筛选策略。经过ARTP的40 s诱变后,接种到质量浓度为0.15 mg/mL的芝麻酚培养基中28℃培养2 d,筛选出生长旺盛的菌株,然后接种到48孔液体培养基培养,并利用96孔板尼罗红荧光染色对培养菌株进行高通量筛选,选育出一株高产油脂菌株TrichosporoncutaneumA1。该菌株较原始菌株的生物量、油脂产量、油脂含量分别提高了41.6%、123.1%、57.4%,且具有良好的遗传稳定性;通过气相色谱分析,其油脂脂肪酸组成与原始菌株相同,主要为十六烷酸、硬脂酸、油酸、亚油酸。
本文通过将ARTP随机诱变与芝麻酚定向抑制微生物产油代谢途径中的关键酶相结合,增大诱变菌株向油脂积累方向突变的机会,使筛选到优良菌株的概率升高,减少筛选的工作量,为油脂酵母的选育提供了高效的筛选方法,可为其他产油脂菌株的筛选提供重要参考。诱变后所产生的正负突变诱变菌株在基因水平的变化和关键酶的影响有待进一步研究。
