热钾碱溶液脱除沼气中CO2反应机制与相际传质研究
2019-04-29张良佺郑猫英毛琰昊盖希坤杨瑞芹单胜道
张良佺 郑猫英 毛琰昊 盖希坤 杨瑞芹 单胜道
(浙江科技学院生物与化学工程学院, 杭州 310023)
0 引言
沼气是有机物在厌氧条件下经微生物发酵产生的一种可燃混合气体,主要成分为CH4和CO2,其中CO2体积分数在15%~35%范围内。现有沼气主要用于民用炊事、生活照明、发电等,利用手段单一,效率较低。利用提纯分离技术去除CO2,可以提高单位体积气体的能量值,还可提高沼气品质,生成高热值的CH4,可作为天然气的替代物,并入燃气管网,或加压作为汽车燃料使用,现已成为国内外沼气行业开发应用的新方向[1-9]。
沼气脱碳方法主要有变压吸附法、化学吸收法和物理吸收法。因为吸收速率快、吸收容量高等优点,化学吸收法是目前捕集CO2的主要方法。其中的热钾碱(碳酸钾)法一般用于高压或高CO2分压的分离过程,如尿素生产、天然气净化等高压分离领域。该方法系统压力高,热钾碱吸收CO2速率加快,反应器体积减小;同时该吸收反应的产物是碳酸氢钾,当系统闪蒸压力降低时,碳酸氢钾发生逆反应,再生碳酸钾,并释放出CO2,因此溶质的再生非常容易,能耗较低。伴随着工程实践的深入以及技术的进步,尤其是其工艺流程中采用喷射器闪蒸或双塔变压再生节能技术,可以节能25%~40%,从而极大地降低了系统能耗和操作成本[10-12]。
当前,对热钾碱吸收CO2过程的热力学研究主要集中在以下几方面:一是基于基团贡献法优选吸收剂。如石会龙等[13]基于UNIFAC(基团贡献法),对用于脱除天然气中CO2的复合溶剂进行组成设计,由于文中采取符号表示活化剂,因此无法了解其分子结构以及分子中各基团对CO2吸收的贡献。二是对CO2吸收过程吸收热的测定。如文献[14-15]采用真实热流法测量高浓度碳酸钾溶液对 CO2的吸收热,分析反应温度、溶液浓度、CO2负载和结晶效应等对吸收热的影响,为稠浆型工艺的设计和模拟提供了必要的热力学基础数据。三是对整个CO2吸收工艺进行热力学模拟。如CLARE等[16]通过模拟手段研究了稠浆型碳酸钾CO2捕集工艺,从热力学角度对整个工艺能耗进行了模拟计算,认为其再生能耗可达2.0~2.5 GJ/t,传统MEA(乙醇胺法)吸收法的再生能耗为4.0 GJ/t。
针对吸收过程反应机制,DANCKWERTS[17]于1970年提出3独立反应机理,后来学者[18-22]都普遍接受了这一观点,并在此基础上进行了反应动力学研究,获得相应的动力学方程。但对3独立反应机制的合理性尚未见文献报道。本文基于对整个吸收过程所进行的化学计量学研究,提出4独立反应机制理论,并对各独立反应进行化学平衡计算,同时对双驱动反应器中的气液传质过程进行测定,并获得相应的传质系数关联方程。
1 实验方法
实验测定动力学工艺流程如图1所示。

图1 二氧化碳气体吸收测定工艺流程Fig.1 Process flow chart of carbon dioxide gas absorption measurement 1.气体钢瓶 2.减压阀 3.调节阀 4.过滤器 5.质量流量计6.止逆阀 7.压力变送器 8.玻璃增湿器 9.双驱动搅拌吸收器 10.恒温水浴箱 11.吸收剂瓶 12.截止阀 13.皂膜流量计 14.吸收液取样阀 15.交流电动机
气体(CO2)由气体钢瓶通过减压阀输出,经过滤器过滤除去其中的水分,通过质量流量计控制气体流量,在质量流量计出口处安装一压力变送器检测管路气体压力,然后气体进入玻璃增湿器,玻璃增湿器安放在恒温水浴箱中维持一定的温度,经增湿后的气体进入吸收剂瓶(即双驱动反应器),吸收剂瓶中存放一定浓度的热钾碱溶液,在一定的温度和一定的搅拌速率下,气液两相接触,吸收过程发生,到达规定的反应时间后,吸收液经吸收液取样阀取出,并准确量取体积,吸收后的气体经皂膜流量计放空。
双驱动搅拌吸收器是一个气液接触界面已知的设备,材质由玻璃制成,内管直径为70 mm,外套管直径为90 mm,高200 mm,内外套管之间通过恒温水保温,以保持反应器内反应温度一定,气相搅拌桨、液相搅拌桨的转速分别通过数显调速器调节。吸收器中液面的位置应控制在液相搅拌桨上桨的下缘1 mm左右,以保证桨叶转动时恰好刮在液面上,达到更新表面的目的。吸收液从吸收剂瓶一次准确加入。
2 结果与讨论
2.1 吸收液体系的热力学探讨


(1)
(2)
(3)
(4)
(5)

(6)
这些反应不全是独立的,一些反应可由另外一些反应经过加减运算而获得,现应用矩阵判别法求独立反应数,系数矩阵为

最后得

由此可知,独立反应数为4,取反应式(1)~(4)为独立反应。
为计算以上各独立反应的平衡常数K,现列出各组分生成热及生成自由焓如表1所示[23]。
反应热及反应自由焓计算式为

(7)
(8)
式中αi——生成物中i组分的物质的量
βj——反应物中j组分的物质的量
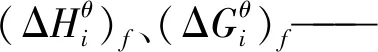

298.15 K时平衡常数K计算公式为
-RTlnK=ΔGθ
(9)
现取反应温度为60℃,计算该温度下的反应平衡常数,根据Van’t Hoff等压方程
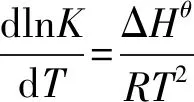
(10)
取ΔHθ不随温度变化,则式(10)积分得
(11)
式中T1=298.15 K。各独立反应热力学数据如表2所示,表中K298、K333分别表示温度为298、333 K时的反应平衡常数。
根据K值可以对各独立反应的化学平衡性质进行分析,对于CO2吸收反应而言,反应(3)由于其平衡常数K3很小,意味着H2CO3分子的平衡电离度也很小,增大其值的方法是降低产物H+离子的浓度,只有当H+离子浓度足够低时,H2CO3分子才能有较高的平衡电离度。

表1 各组分生成热与生成自由焓(101.325 kPa,298.15 K)Tab.1 Heat of formation and formation free enthalpy of each component (101.325 kPa,298.15 K) kJ/mol

表2 各独立反应热力学参数Tab.2 Thermodynamic parameters of each individual reaction

另外,反应(1)的平衡常数K1在60℃时,其值为0.809 3,与1相近,说明H2CO3在溶液中的浓度能够保持较高的数值,由此可合理推论,反应(1)和反应(2)将共同决定CO2的吸收速率。
DANCKWERTS[17]提出的3独立反应机理认为,在热钾碱吸收CO2的反应过程中,主要包括3个独立反应,分别为反应(2)以及
(12)
(13)
在上述3个独立反应中,DANCKWERTS认为,当pH值大于10时,CO2和H2O的反应速率很慢,可以忽略,CO2和OH-离子之间的反应是整个反应体系的控制步骤,反应(13)达到平衡,文献[19-22]据此建立了CO2吸收反应本征动力学模型。
显然3反应机理与本文上述的分析存在一些矛盾,4反应理论保留了其中的CO2与H2O之间的反应,因为实验数据说明,反应结束,吸收液pH值大多在9.6~10.1之间,不能严格满足pH值大于10的条件,所以保留CO2与H2O之间的反应是必须的。4独立反应理论,既符合热力学独立反应原理,也符合实验结果。
2.2 CO2吸收反应机理及过程分析
由上述吸收反应体系的热力学分析,为更好地表达反应机理,将上述独立反应改写为

2.3 双驱动反应器中CO2吸收传递性能
根据双膜理论,在气液相界面两侧,存在气膜和液膜,两层滞流膜中集中了复杂相际传质过程的全部阻力,为获得宏观动力学方程,首先必须要研究膜内基本传质特征,包括膜传质系数、膜厚参数等。
2.3.1吸收速率与气相搅拌转速之间关系
应用CO2-H2O体系在20℃时,保持一定的液相搅拌转速,改变气相搅拌转速nG进行实验,当CO2被H2O吸收一定体积时记录时间,实验原始数据如表3所示。其他操作条件为:气相流量设定值80 mL/min;液相搅拌转速120 r/min。
吸收速率NCO2的计算公式为
(14)
其中
式中pw——水蒸气在20℃时分压,Pa

表3 不同气相搅拌转速下的吸收时间与吸收体积Tab.3 Absorption time and volume at different stirring speeds
p——大气压,Pa
V——CO2吸收体积,m3
S——反应器截面积,m2
pCO2——CO2分压,Pa
nCO2——CO2物质的量
由吸收速率计算数据可知,在40~120 r/min之间吸收速率变化较快,大于120 r/min之后,吸收速率变化趋向稳定,表明气膜传质阻力完全消除,整个吸收过程阻力主要集中于液膜。由此可得,为消除气膜阻力,气相转速应大于临界值120 r/min,为安全考虑,后续实验中实际气相转速取140 r/min。
2.3.2吸收速率与液相搅拌速度之间关系
应用CO2-H2O体系,温度保持在20℃,气相转速一定,改变液相转速进行实验,吸收一定体积CO2时记录吸收时间,实验数据如表4所示。
其他操作参数:气相流量80 mL/min;气相搅拌转速140 r/min。

表4 一定吸收体积时液相搅拌转速nL与吸收时间t之间的关系Tab.4 Relationship between liquid phase stirring speed nL and absorption time t at a certain absorption volume
由吸收速率NCO2与液相搅拌转速nL之间的关系可知,随液相搅拌转速nL的增大,吸收速率NCO2也随之增大,甚至在转速为120 r/min后,NCO2有较快上升趋势,其原因是随着搅拌转速的增大,液相湍流程度增大,液膜变薄,传质阻力减小,所以吸收速率增加。
为获得液相传质系数kL的关联式,关键是要求出kL与液相搅拌转速nL之间的关系,根据
其中

(15)

E——亨利系数
xCO2——CO2在水的摩尔分率
nw——吸收液中水的物质的量
Mw——水的摩尔质量ρw——水的密度
VL——双驱动反应器中吸收CO2水的体积
液相传质系数kL与液相搅拌转速nL之间的关系见表5。

表5 液相传质系数kL与液相搅拌转速nL之间的关系Tab.5 Relationship between liquid mass transfer coefficient kL and liquid speed nL
2.3.3液相传质系数的回归
由因次分析法可得液相传质系数kL与搅拌转速nL之间的关系
(16)
式中L——搅拌桨叶的长度
DL——CO2分子在水中扩散系数
μL——液体溶剂黏度
ρL——液体溶剂密度
A、m——待求的常数
在实验获得不同nL时的kL值后,为求解A、m,将式(16)进行线性化处理,即

(17)
式中N——实验次数
求解方程组(17),即可解得参数A、m。
在计算kL时,涉及到CO2在水中的扩散系数DL,其值计算有多种方法,本文采取Wilke-Chang公式进行估算,即
(18)
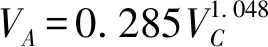
(19)
式中MB——溶剂的摩尔质量,kg/kmol
φ——溶剂的缔合参数,取2.6
VA——溶质在正常沸点下摩尔体积,cm3/mol
VC——气体的临界摩尔体积,取93.9 cm3/mol
根据kL与nL之间关系,结合方程组(17),实验次数N=10,计算结果如表6所示。
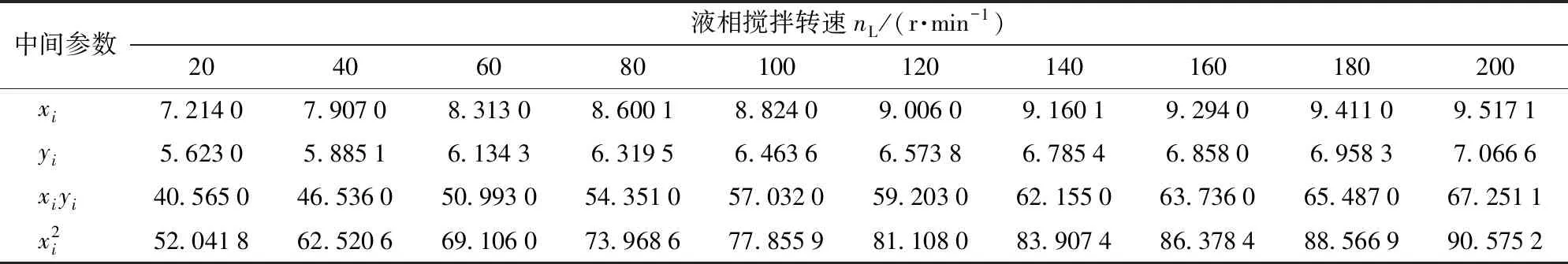
表6 不同液相搅拌转速nL下kL回归计算数据Tab.6 Data of kL regression calculation at different liquid stirring speeds nL

将数据代入式(17),得
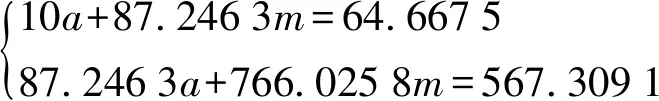
(20)
解得:a=0.993 2,m=0.631 1。
计算结果:m=0.631 1,A=0.113 3,最后kL的回归方程为
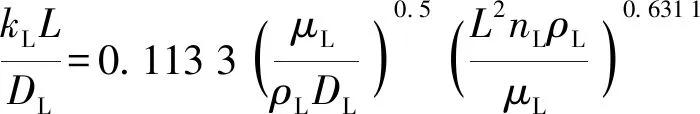
(21)
定义误差
液膜厚度
式中kL,cal——液相传质系数的模型计算值
计算结果如表7所示。由表中数据可知,在液相搅拌转速nL为140 r/min时,出现了最大误差,其值为11.312%,其余转速时,误差都小于10%,因此实验数据可靠可信。
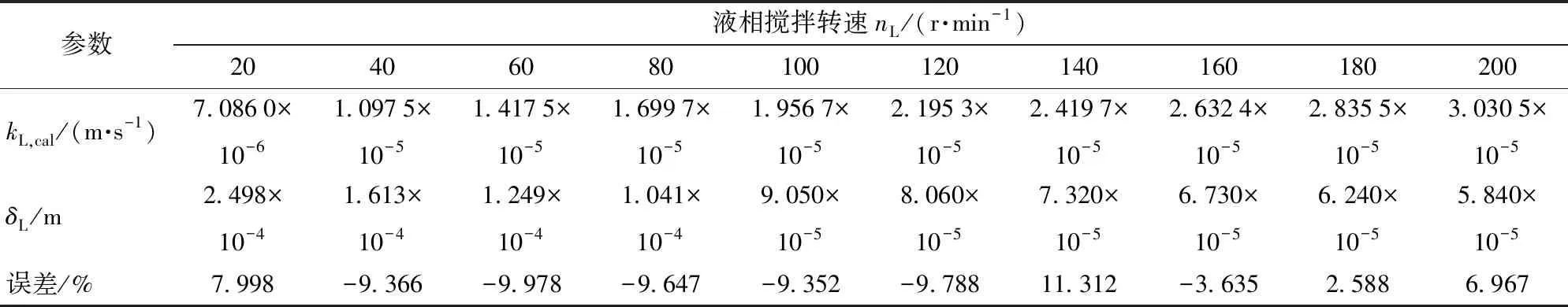
表7 不同液相搅拌转速下的传质系数、误差及液膜厚度Tab.7 Calculation values of mass transfer coefficient kL,cal, error Er and thickness of liquid film δL at different liquid phase stirring speeds nL
3 结论
(1)对碳酸钾吸收CO2反应的热力学性质进行了研究,进行了独立反应数的计算,提出了4独立反应理论。

(3)基于双膜理论,在双驱动反应器中对吸收传质过程进行了研究,当气相转速达到140 r/min以上时,气膜扩散阻力可忽略不计;同时研究了液相传质系数与搅拌转速之间的关系,回归获得了相应的方程,通过计算误差,认为该方程真实可靠。
