信号分子在好氧颗粒污泥形成过程中的作用
2019-04-28王玉莹支丽玲马鑫欣
王玉莹,支丽玲,马鑫欣,王 硕,2,李 激,2*
信号分子在好氧颗粒污泥形成过程中的作用
王玉莹1,支丽玲1,马鑫欣1,王 硕1,2,李 激1,2*
(1.江南大学江苏省厌氧生物技术重点实验室,江苏 无锡 214122;2.江南大学江苏省高校水处理技术与材料协同创新中心,江苏 苏州 215009)
采用人工配水成功培养好氧颗粒污泥,针对絮状污泥颗粒化过程中污泥的理化性质、污染物去除效率、胞外聚合物和信号分子变化进行相关分析.结果发现,在好氧颗粒污泥的形成过程中,污泥对污染物去除能力明显提高.与接种污泥相比,成熟的好氧颗粒污泥对COD、NH4+-N和PO43--P去除率分别提高20%、36%和57%.好氧颗粒污泥中胞外蛋白质和多糖含量分别增加了116和31mg/gMLVSS.采用激光共聚焦扫描显微镜对接种污泥和好氧颗粒污泥进行空间表征,发现后者蛋白质含量明显增加,说明蛋白质在污泥颗粒化过程中具有重要作用;磷酸二酯酶活性总体呈现上升趋势,第二信使环二鸟苷酸(cyclic diguanylic, c-di-GMP)含量先增加后降低,与胞外聚合物中蛋白质和多糖的变化规律相似.通过SPSS软件进一步分析得知,c-di-GMP与蛋白质相关系数2=0.92871,呈极显著相关性;与紧密结合型胞外聚合物中蛋白质相关系数2=0.89025,呈显著相关性,推测c-di-GMP可能是通过指导紧密结合型胞外聚合物中的蛋白质合成以促进好氧颗粒污泥的形成.
好氧颗粒污泥;胞外聚合物;蛋白质和多糖;信号分子;磷酸二酯酶
好氧颗粒污泥(AGS)是一种特殊的生物膜结构,可通过微生物间的自固定化形成椭球或球状的颗粒[1-3].与传统活性污泥相比,AGS的突出特点是生物量高、微生物种类丰富、生长速度快,优异的沉降性能可提高污水处理效果[4-6].20世纪90年代,AGS首次在UASB反应器中被发现,后来被各国学者所研究和探讨[7].2003年,荷兰首次搭建了以AGS为主体处理废水的中试装置[1].2010年,AGS技术已经正式应用于实际污水处理厂[7].但是迄今为止,关于AGS的形成机理仍处于假说阶段,有研究表明信号分子在污泥颗粒化过程中发挥重要作用[1],本文主要从信号分子的角度来阐释絮状污泥的颗粒化过程.
大部分微生物的生长代谢活动都与群体感应现象相关[2],即细菌会通过信号分子感知外界环境变化,从而精确调控生物体代谢、物质合成以及行为方式改变等[8].环二鸟苷酸(c-di-GMP)是微生物体内普遍存在的信号分子,它的合成与分解分别受到位于同一结构域的二鸟苷酸环化酶(DGC)和磷酸二酯酶的调节[9].其中,两分子的三磷酸鸟苷(GTP)在二鸟苷酸环化酶作用下形成环二鸟苷酸;过量环二鸟苷酸会被含有EAL(Glu-Ala-Leu)或HD-GYP(His- Asp,Gly-Tyr-Pro)结构域的磷酸二酯酶水解成两分子环磷酸鸟苷(cGMP)而失活[10].c-di-GMP的存在会影响微生物运动方式、生物膜的形成以及细胞分化等[11]. Christen等[12]研究发现,高浓度的c-di- GMP会促进胞外聚合物(EPS)的分泌,影响污泥的颗粒化进程.Karaolis等[13]证明,c-di-GMP与微生物运动状态有关,可将细菌由单细胞游离型转变为多细胞聚合型,促进生物膜形成,抵抗抗生素攻击.还有研究者认为,信号分子c-di-GMP可促进EPS中多糖的合成,从而改变细菌菌落形态[14].
本研究利用SBR培养AGS,对该过程中污染物去除效果和AGS特性进行相关分析,并深入研究了絮状污泥颗粒化过程中信号分子和EPS的变化特性,探讨AGS的形成机理,以期为AGS的快速培养和稳定运行提供思路.
1 材料与方法
1.1 试验装置
试验反应装置采用有机玻璃制成的圆柱形SBR,高100cm,内径8cm,有效容积约为4L.反应器底部有曝气系统,曝气量大小由转子流量计控制,充氧期间控制曝气量在2L/min,为污泥提供充足的溶解氧和剪切力.运行周期4h,其中进水60min、曝气时间由145min逐渐增加到170min,沉降时间由30min逐渐降低到5min.污泥泥龄20d,排水比60%.
1.2 接种污泥与进水水质
接种污泥取自无锡市某污水处理厂好氧池活性污泥(AS),外表呈黑褐色,较为松散.反应器进水采用人工配水,以CH3COONa为碳源,NH4Cl为氮源, K2HPO4为磷源,进水中COD、NH4+-N、PO43--P浓度分别为600,60和16mg/L.此外,添加KH2PO4、KCl、MgSO4·7H2O和微量元素等物质,以保证细菌正常的生长代谢活动.
1.3 分析方法
1.3.1 常规指标分析 COD、NH4+-N、NO3--N、PO43--P、MLSS和MLVSS指标测定方法均参照《水与废水监测分析方法》(第四版)[15].污泥形态变化通过OLYMPUS CX41型(Olympus,Japan)显微镜观察.
1.3.2 EPS的测定 EPS的提取采用NaOH法[16],首先将10mL待测样品置于50mL离心管中,超声解体,分别在2000,5000,10000r/min的转速下离心15min,收集上清液,即为溶解型胞外聚合物(SMP- EPS)、附着型胞外聚合物(LB-EPS)和紧密结合型胞外聚合物(TB-EPS).用考马斯亮蓝法和蒽酮-硫酸比色法对每层EPS中的蛋白质和多糖含量进行测定.
1.3.3 磷酸二酯酶(PDE)活性的测定[17]由于PDE可分解对硝基苯磷酸盐为对硝基苯酚,故PDE的活性采用对硝基苯磷酸盐法测定.操作步骤如下:称取1g抽滤后污泥于50mL三角瓶,加入0.2mL甲苯(C7H8)、4mL三(羟甲基)氨基甲烷缓冲液(THAM缓冲液,pH=8.0)和1mL对硝基苯磷酸钠,在37℃培养箱中培养1h,取出后加入1mL浓度为0.5mol/L 的CaCl2溶液和4mL三(羟甲基)氨基甲烷-NaOH浸提剂(THAM-NaOH),0.45μm滤纸过滤,在410nm处比色.根据标准曲线计算溶液中对硝基苯酚含量,再根据公式(1)计算对硝基苯酚的单位时间产量,根据其产量来估计PDE活性:

式中:为对硝基苯酚的单位时间产量, mg/(kg×h);1为样品中产生的对硝基苯酚质量, mg;2为所取待测样品质量, g;为待测样品的含水率.
1.3.4 第二信使的测定[18]取冻干后的污泥0.2g溶于15mL超纯水,加入15mL溶菌酶(1mg/mL)使细胞溶解,震荡均匀后于37℃培养箱中培养1h;取出置于4℃、转速为9000r/min离心机中离心15min,上清液转移至离心管中.然后加2倍无水乙醇,震荡几秒后置于4℃培养箱中培养1h;再将样品置于4℃、9000r/min离心机中离心15min,倒掉上清液,将沉淀物放置在37℃培养箱中培养3h,加入3mL超纯水均匀震荡.将混合液移至5mL离心管中,在12000r/min转速下离心10min,最后取1mL上清液,通过Waters 1525EF高效液相色谱(Waters,USA)进行定量分析.
1.3.5 激光共聚焦扫描显微镜(CLSM)分析[4]将相同浓度的接种污泥和AGS捣碎,分别用核酸染料Syto 63(20mol/L, Sigma)、核酸染料Sytox Blue (25mol/L, Sigma)、异硫氰酸荧光素FITC(10g/L, Sigma)和伴刀豆凝集素Con A (0.2g/L,Sigma)对污泥中的总细胞、死细胞、蛋白质和α-多糖染色,样品置于TCS SP8激光共聚焦显微镜(Leica,Germany)下观察各物质变化.
2 结果与讨论
2.1 污泥形态变化和污染物去除特性
2.1.1 污泥形态和生物量变化 在AGS培养过程中,根据反应器运行情况和污泥特性不断缩短沉降时间.运行前40d,沉降时间由最初的30min逐渐缩短到5min,最终在5min稳定运行.絮状污泥颗粒化过程中,污泥形态变化如图1所示,接种污泥(0d)为黑褐色,呈流质状态,微生物比较分散;40d时污泥中丝状菌相互缠绕,形成菌胶团,构成了AGS骨架,为絮状污泥颗粒化奠定基础;运行到60d时,由于EPS的大量合成和污泥浓度提高,反应器中出现较小不规则的AGS;80d时颗粒污泥在高剪切力作用下进一步规则化,形成椭圆的成熟AGS.在此过程中,生物量变化如图2所示.

图1 颗粒化过程中污泥形态变化
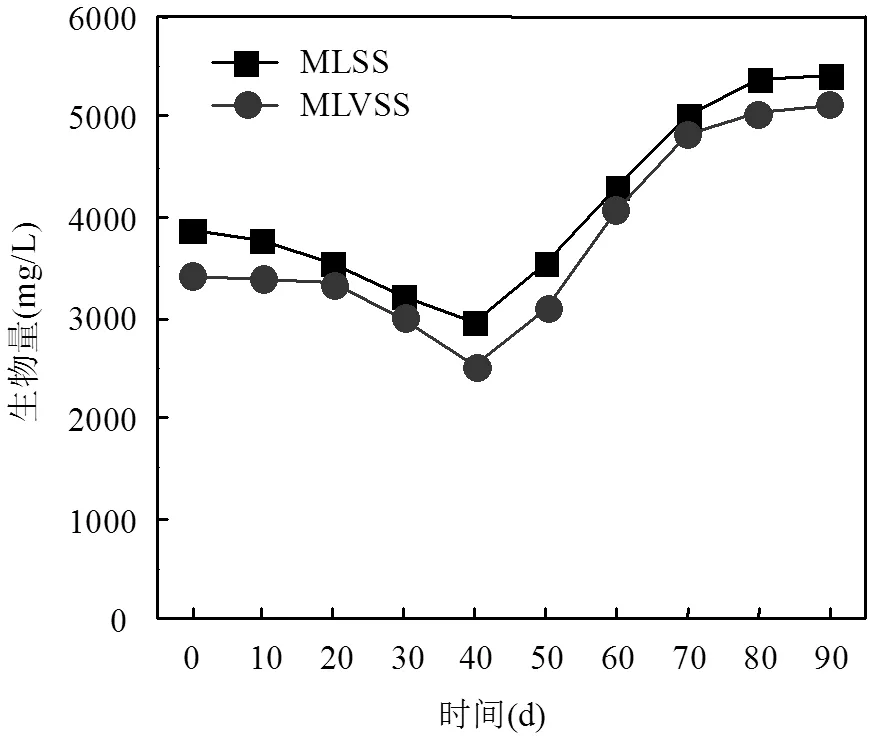
图2 颗粒化过程中生物量的变化
接种污泥浓度为3865mg/L,反应器运行前40d,将沉降时间按照30,20,10和5min的顺序每隔10d依次降低.从图2中发现,前40d污泥浓度不断降低,一方面原因在于微生物对接种环境适应性较差,另一方面则是由于较短的沉降时间使沉降性能较差的污泥被排除在SBR之外.在SBR运行至第40d时污泥浓度达到最低2943mg/L.反应器在5min稳定运行后,污泥浓度开始增长,60d左右形成小颗粒污泥,此时污泥浓度为4021mg/L.80d时形成成熟的AGS,污泥浓度达到5400mg/L.之后AGS反应器稳定运行,污泥浓度不再发生变化.
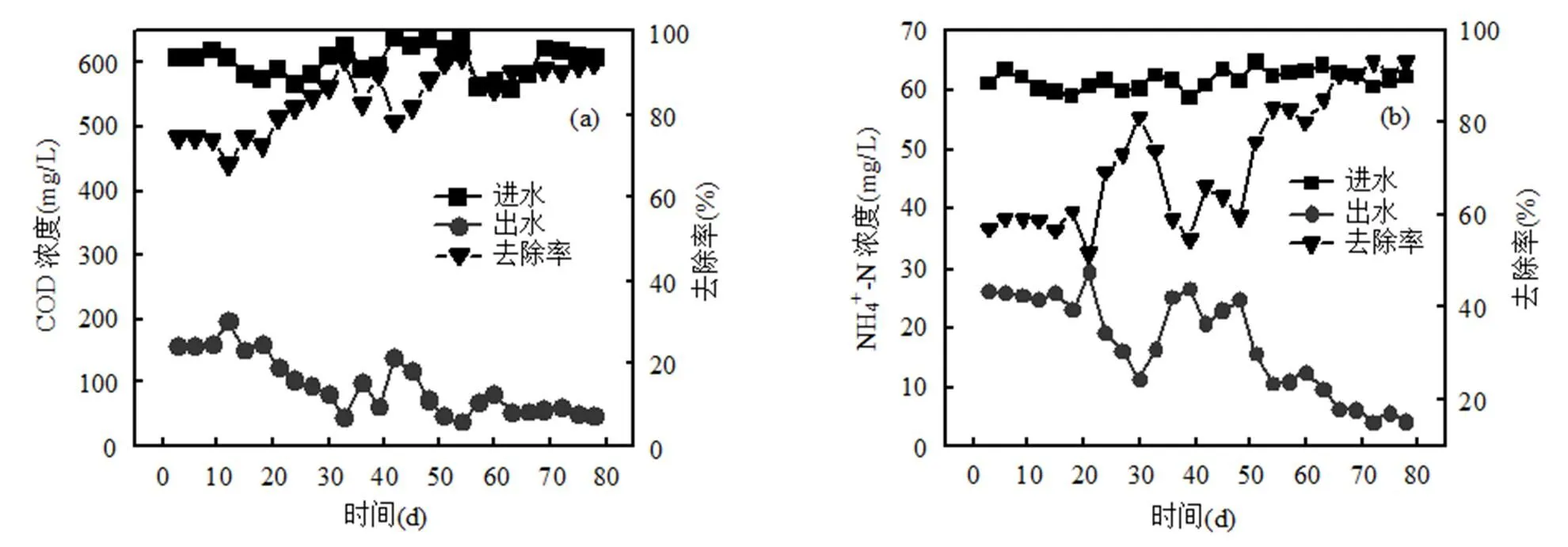
2.1.2 污染物去除特性 絮状污泥颗粒化过程中反应器进出水COD变化如图3a所示,进水COD浓度在600mg/L左右,反应器运行初期,大部分异养细菌对高C/N的环境不适应导致微生物活性降低,对COD的去除率只有72%.随着环境适应性的提高和生物活性的恢复,COD去除率逐渐升高至80%.当AGS形成后,微生物对碳源的利用率可达到92%,与活性污泥相比提高20%,出水COD约40mg/L. NH4+-N变化如图3b所示,进水NH4+-N的浓度在60mg/L左右,接种污泥对NH4+-N去除率约为57%,反应器在沉降时间为5min稳定运行时,去除率升高到80%,推测是由于反应器内较高的溶解氧(DO: 7~9mg/L)提高了硝化细菌活性,对NH4+-N的去除率上升.成熟的AGS形成之后,污泥浓度增加到5400mg/L,对NH4+-N去除率达到93%,硝化速率为4.47mgN/(gVSS×h),与接种污泥的硝化速率相比,AGS的硝化能力提高了36%.NO3‑-N和NO2‑-N变化如图3c所示,在AGS培养过程中, NO2‑-N几乎不存在,说明反应器中的污泥运行状况较好,实现完全硝化.而初始阶段反应器内NO3‑-N含量较高,分析可能是由于反硝化细菌对环境敏感,且在污泥培养初期,污泥浓度降低,导致反硝化菌数量减少、活性下降,从而影响整体的反硝化能力.随着AGS的形成和污泥浓度的提高,反硝化细菌大量生长,活性随之提高,反硝化速率由接种污泥的4.11mgN/(gVSS×h)升高至AGS的6.73mgN/(gVSS×h),最终出水中NO3‑-N含量在1mg/L左右. PO43--P变化如图3d所示,接种污泥长期受到除磷药剂的影响导致在反应器运行前期对PO43--P去除效率仅为28%,反应器运行60d左右出现较小的AGS,其中含有大量的聚磷菌,除磷效率得到一定提升.随着AGS的成熟,微生物更加适应反应器运行环境,进一步促进了聚磷菌生长,PO43--P的去除率稳定在85%,与活性污泥相比提高了57%,释磷速率由接种污泥的2.69mgP/ (gVSS×h)升高到AGS的5.27mgP/(gVSS×h).
2.2 EPS的变化
EPS是一种特殊的高分子化合物,具有生物凝胶特性,为微生物聚集提供物质基础,可促进微生物聚集体的构建,是絮状污泥到AGS的过渡桥梁,在絮状污泥颗粒化过程中发挥重要作用[19-20].如图4a所示,在颗粒化过程中,EPS呈现明显递增趋势,由接种污泥的90mg/gMLVSS增加到AGS的260mg/ gMLVSS,其中蛋白质的增长最为显著,由77mg/ gMLVSS增加到193mg/gMLVSS.细胞的疏水性和表面电荷的降低是微生物固定化的关键[21],而蛋白质结构中的氨基酸具有疏水性,推测其会降低细胞表面的静电斥力和吉普斯自由能,增强微生物间的粘附力,促进AGS的形成[20-22].如图4b所示, TB- EPS中蛋白质增幅较大,由接种污泥的53mg/ gMLVSS增加到AGS的163mg/gMLVSS.有文献[22-23]指出,TB-EPS中存在大量络氨酸蛋白、天冬氨酸蛋白以及α螺旋和β折叠蛋白,这些蛋白质的存在是污泥颗粒化的关键.SMP-EPS和LB-EPS中蛋白质增幅较小,因此TB-EPS中蛋白质含量的增加可能是AGS形成的重要因素.

EPS中多糖浓度增幅较小,由12mg/gMLVSS增加到43mg/gMLVSS.文献指出[1],多糖中主要含有α和β两种功能性多糖,其中β-多糖主要分布在污泥内部,为絮状污泥颗粒化提供碳骨架结构,促进菌胶团形成[1,24];α-多糖主要分布在污泥外部,多糖中的羧基是亲水性物质,会吸附水中的微小颗粒和悬浮物,具有吸附架桥作用,可促进AGS的形成.总体而言,多糖总量变化较小,以TB-EPS层增加为主(图4c).
PN/PS(蛋白质/多糖)是AGS结构稳定的重要指标.Xie等[25]发现,PN/PS 值升高可减小细菌与水分子之间的结合力,促进菌胶团的形成,缩短污泥颗粒化进程.接种污泥的PN/PS为6.2,在环境适应阶段下降到4.7,主要与污泥浓度降低和曝气量高、剪切力较大有关;随着污泥浓度上升,大量蛋白质和多糖被合成,PN/PS值上升到6.1;60d左右AGS初步形成,多糖和蛋白质含量达到最大值, PN/PS也增加到7.6;随着AGS的进一步成熟,蛋白质和多糖都出现小幅度下降,但PN/PS值变化较小,维持在7.4左右,略高于接种污泥,表明AGS结构已趋于稳定.在絮状污泥颗粒化前期,胞外蛋白质和多糖含量都增加.在AGS进一步成熟阶段, EPS含量略有降低,主要是因为AGS形成后,其骨架结构和粒径已比较稳定,EPS含量维持在240mg/g MLVSS左右,且AGS中PN/PS值略高于接种污泥.
2.3 AGS特征物质分布
通过CLSM手段对接种污泥和AGS中总细胞、死细胞和蛋白质、α-多糖进行空间表征.结果如图5所示,在相同污泥浓度下,AGS中蛋白质含量明显高于接种污泥,这与图4中的结果相符.蛋白质可通过静电作用与水中阳离子结合,降低细胞表面电荷,促进微生物聚集,为絮状污泥颗粒化奠定基础[21].同时,胞外蛋白质可作为碳源被AGS内部微生物利用,这对于维持AGS的稳定结构具有重要意义[26].α-多糖量低于接种污泥,与廖青等[20]研究结果存在差异,推测可能是因为AGS粒径较大,位于污泥内部的α-多糖没有被完全染色.从细胞的角度比较发现,AGS中总细胞数量较高,死细胞数量较低,与2.1中AGS成熟后污泥浓度升高和污染物去除率上升具有良好对应关系.
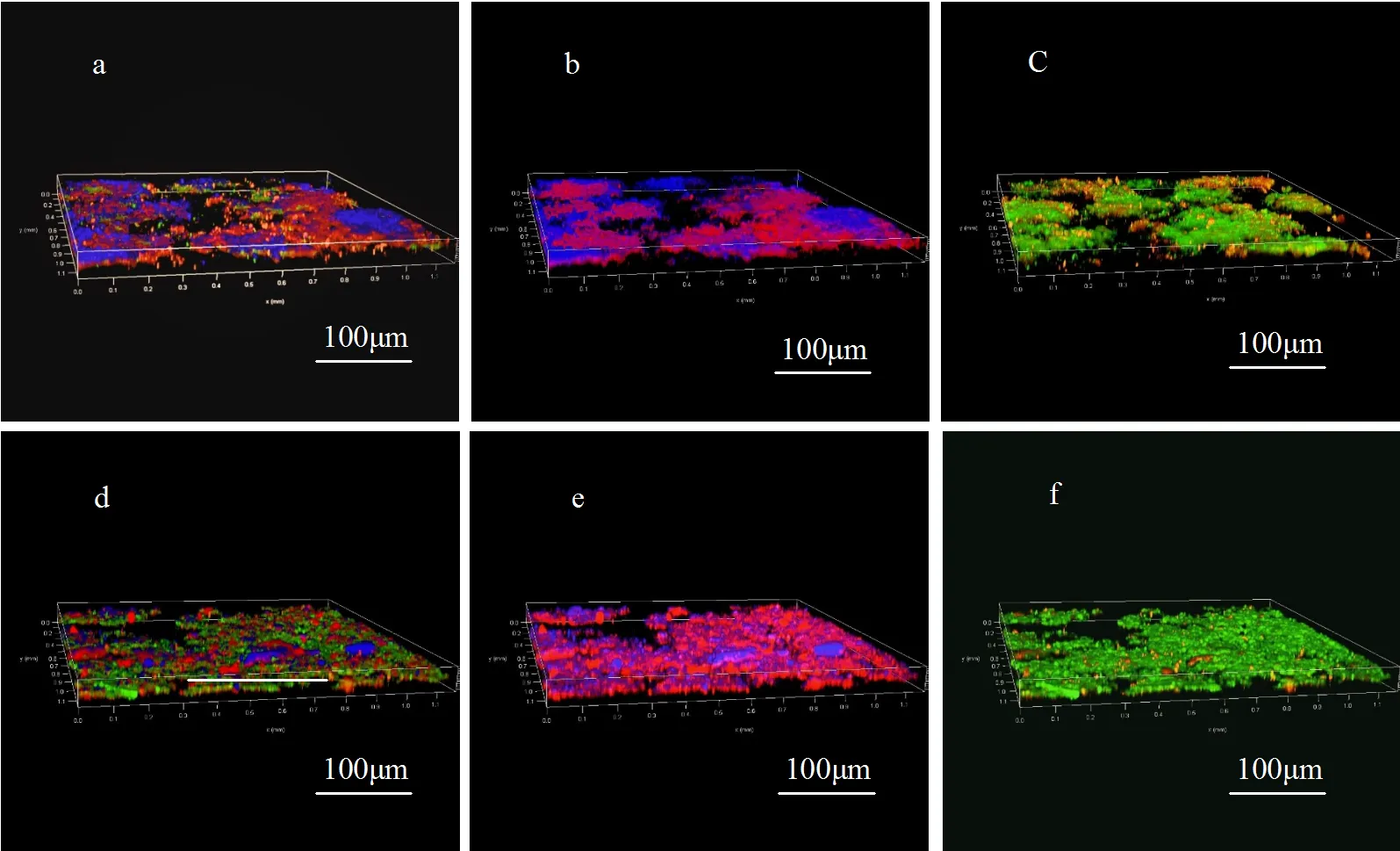
图5 接种污泥(a~c)和好氧颗粒污泥(d~f)中各组分分布变化
总细胞(红色)、死细胞(蓝色)、多糖(橙色)和蛋白质(绿色)、a和d:合成图像
2.4 信号分子和PDE酶的变化
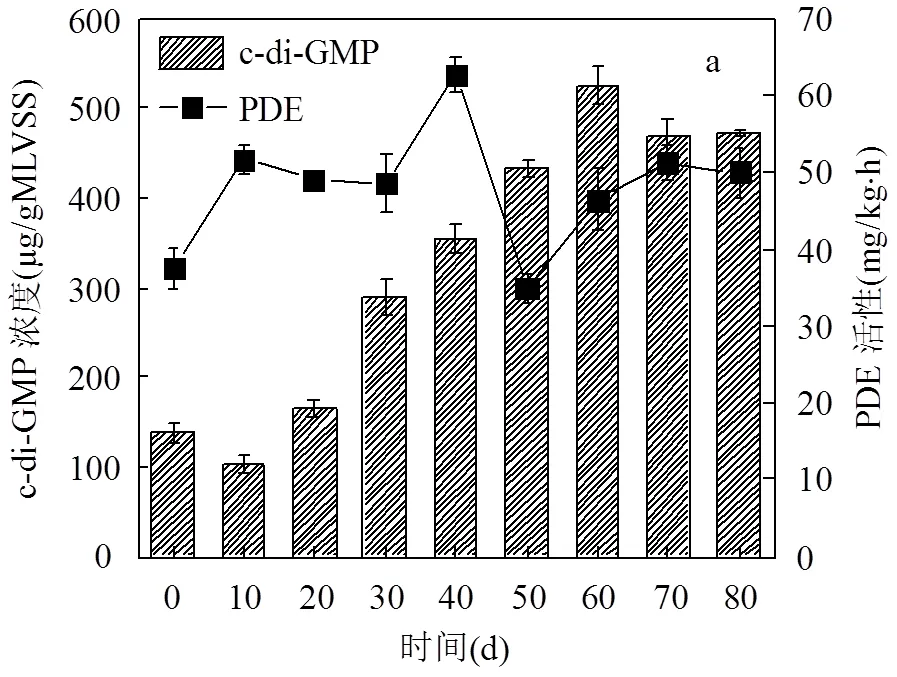
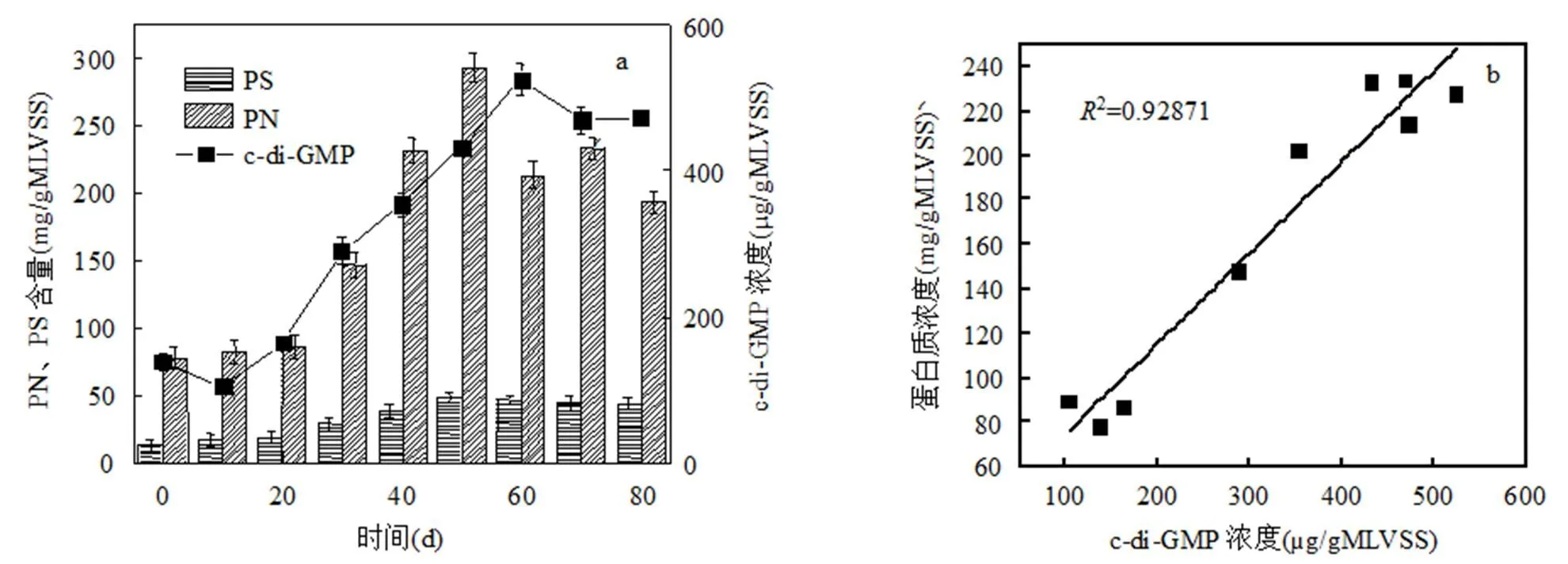
信号分子c-di-GMP和PDE酶的变化如图6a所示,在反应器运行初期(前 40d),PDE的活性和c- di-GMP 含量整体呈上升趋势,SBR运行至第40d, PDE活性上升到65mg/(kg×h),c-di-GMP含量达到341μg/gVSS,这可能是因为当时反应器中污泥浓度较低,为防止污泥因沉降性能较差而被冲出反应器,进一步使污泥浓度降低,大量第二信使被合成以指导EPS分泌,但为维持细胞渗透压稳定和胞内第二信使平衡,PDE酶活性逐步提高,用以分解过量合成的第二信使,保证颗粒化进程稳定有序进行[27-29].虽然第二信使被PDE酶部分分解,但与接种污泥相比c-di-GMP含量仍然是增加的.AGS形成以后,PDE酶的活性变化较小,维持在50mg/(kg×h),略高于接种污泥,说明AGS中第二信使的合成量比较高.c-di- GMP含量稳定在453μg/gVSS,明显高于接种污泥,说明较高浓度的c-di-GMP是维持AGS结构稳定与污染物高效去除的关键因素.
如图6b所示,接种污泥中PDE/c-di-GMP值为0.27,在10d左右升高到0.5,这可能是因为接种污泥前期不适应反应器环境,大量污泥随出水排出,污泥浓度降低,微生物通过群体感应现象启动特征基因编码[4],促进c-di-GMP分泌以提高污泥沉降性能,但为了使微生物能够稳定、有序聚集,PDE酶活性也同步升高.随后该比值一直降低,成熟的AGS形成之后PDE/c-di-GMP稳定在0.11,低于接种污泥,表明AGS中c-di-GMP合成量较高,为AGS发挥稳定功能奠定基础.
2.5 信号分子与蛋白质和多糖的相关性分析
Whiteley等[6]研究发现,c-di-GMP会促进蛋白质和多糖的合成,如图7a所示,EPS中蛋白质、多糖和c-di-GMP的变化趋势基本一致.其中蛋白质与c-di-GMP在接种污泥中的含量比较低,55d左右达到最高,随着AGS的成熟,2者的含量都略有降低.与2者变化不同的是,多糖在AGS成熟阶段浓度不再明显变化.通过SPSS软件对3者关系进行相关性分析,结果如图7b、7c所示,在AGS形成过程中c-di- GMP与EPS中蛋白质的相关性系数2=0.92871,显著性水平=0.0042,表明信号分子是影响蛋白质合成的极显著因素;c-di-GMP与多糖的相关性系数2=0.83506,显著性水平=0.015,表明信号分子是影响多糖合成的显著因素.由于TB-EPS中蛋白质和多糖的变化最为明显,又对信号分子和TB-EPS中的蛋白质和多糖进行相关性分析,结果如图7d、7e所示,在污泥颗粒化过程中c-di-GMP与TB-EPS中蛋白质相关性系数2=0.89025,显著性水平= 0.0113,说明信号分子是影响TB-EPS层蛋白质含量的显著因素;c-di-GMP与TB-EPS中多糖的相关性系数2=0.82913,显著性水平=0.0214,说明信号分子与TB-EPS中多糖含量具有显著相关性,但相关性程度略低于信号分子与TB-EPS中蛋白质的相关性程度.推测第二信使c-di-GMP是通过指导蛋白质(尤其是TB-EPS中蛋白质)的合成来促进絮状污泥颗粒化进程的.
3 结论
3.1 絮状污泥颗粒化过程中,污泥形态由最初的絮体形态变成光滑紧密的颗粒态,污泥浓度呈现先降低后增高的趋势,成熟AGS对COD、NH4+-N和PO43--P去除率分别提高到92%、93%和85%.
3.2 随着AGS的形成,EPS含量明显提高,以TB-EPS层蛋白质增加为主,多糖含量相对增加, PN/PS值由接种污泥的6.2增加到AGS中的7.4.
3.3 第二信使c-di-GMP与EPS中蛋白质相关系数2=0.92871,呈现极显著相关性;与TB-EPS中的蛋白质相关系数2=0.89025,呈显著相关性.
3.4 与接种污泥相比,AGS中PDE酶活性和信号分子c-di-GMP含量都明显提高,PDE/c-di-GMP值降低,表明AGS中c-di-GMP合成量较高.
[1] Adav S S, Lee D, Show K, et al. Aerobic granular sludge: Recent advances [J]. Biotechnology Advances, 2008,26(5):411-423.
[2] 王 硕,于水利,徐 巧,等.好氧颗粒污泥特性、应用及形成机理研究进展[J]. 应用与环境生物学报, 2014,20(4):732-742.Wang S, Yu S l, Xu Q, et al. Characteristics, application and formation mechanisms of aerobic granular sludge: recent advances [J]. Chinese Journal of Applied & Environmental Biology, 2014,20(4):732-742.
[3] 金正宇,郗 皓,苑 泉,等.进水模式对强化脱氮好氧颗粒污泥培养的影响[J]. 中国环境科学, 2018,38(3):935-942.Jin Z Y, Xi H, Yuan Q, et al. Impacts of feeding mode on stable aerobic granular sludge cultivation for enhanced denitrification [J]. China Environmental Science, 2018,38(3):935-942.
[4] Ni B, Yu H. Mathematical modeling of aerobic granular sludge: A review [J]. Biotechnology Advances, 2010,28(6):895-909.
[5] Salehizadeh H, Yan N. Recent advances in extracellular biopolymer flocculants [J]. Biotechnology Advances, 2014,32(8):1506-1522.
[6] Whiteley C G, Lee D. Bacterial diguanylate cyclases: Structure, function and mechanism in exopolysaccharide biofilm development [J]. Biotechnology Advances, 2015,33(1):124-141.
[7] Pronk M, de Kreuk M K, de Bruin B, et al. Full scale performance of the aerobic granular sludge process for sewage treatment [J]. Water Reserch. 2015,84:207-217.
[8] Guo Y, Liu S, Tang X, et al. Role of c-di-GMP in anammox aggregation and systematic analysis of its turnover protein in Candidatus Jettenia caeni [J]. Water Research, 2017,113:181-190.
[9] 李玖龄.基于信号分子AHLs检测的微氧废水处理系统脱氮机制研究[D]. 哈尔滨:哈尔滨工业大学, 2016.Li J L. The mechanism of nitrogen removal in a microaerobic wasterwater treatment system based on the decetion of signal molecule [D].Harbin: Harbin Institute of Technology, 2016.
[10] 那路新,杨振军.环二鸟苷酸(c-di-GMP)在微生物体内的作用及其类似物的研究[J]. 药学学报, 2012,23(3):307-312.Lu X Z, Liu Z J, Yu W G.Cyclic Diguanylate—New Second Messenger in Bacteria [J]. Acta Pharmaceutica Sinica, 2012,23(3): 307-312.
[11] Chen Z, Schaap P. The prokaryote messenger c-di-GMP triggers stalk cell differentiation in Dictyostelium [J]. Nature, 2012,488(7413): 680-683.
[12] Christen B, Christen M, Paul R, et al. Allosteric control of cyclic di-GMP signaling [J]. Journal of Biological Chemistry, 2006,281(42): 32015-32024.
[13] Karaolis D, Rashid M H, Chythanya R, et al. c-di-GMP (3 '-5 '-cyclic diguanylic acid) inhibits Staphylococcus aureus cell-cell interactions and biofilm formation [J]. Antimicrobial Agents and Chemotherapy, 2005,49(3):1029-1038.
[14] Nakhamchik A, Wilde C, Rowe-Magnus D A. Cyclic-di-GMP regulates extracellular polysaccharide production, biofilm formation, and rugose colony development by Vibrio vulnificus [J]. Applied and Environmental Microbiology, 2008,74(13):4199-4209.
[15] 编委会国家环境保护总局水和废水监测分析方法.水和废水监测分析方法(第四版) [M]. 北京:中国环境科学出版社, 2009.Editorial Board of State Environmental Protection Administration & The Analysis Method of water and wastewater. The method of monitoring and analysis about water and wastewater (4th Edition) [M]. Bei Jing: China Environmental Press, 2009.
[16] Liang Z, Li W, Yang S, et al. Extraction and structural characteristics of extracellular polymeric substances (EPS), pellets in autotrophic nitrifying biofilm and activated sludge [J]. Chemosphere, 2010,81(5): 626-632.
[17] 朱芸芸,李 敏,曲 博,等.湿地植物根际土壤磷酸酶活性变化规律研究[J]. 环境科学与技术, 2016,39(10):106-112.Zhu Y Y, Li M, Qu B, et al Research on the Variations of Phosphatase Activity in Rhizosphere Soil of Wetland Plants [J]. Environmental Science & Technology, 2016,39(10):106-112.
[18] Simm R, Morr M, Kader A, et al. GGDEF and EAL domains inversely regulate cyclic di-GMP levels and transition from sessility to motility [J]. Molecular Microbiology, 2004,53(4):1123-1134.
[19] Chen M Y, Lee D J, Tay J H. Distribution of extracellular polymeric substances in aerobic granules [J]. Applied Microbiology and Biotechnology. 2007,73(6):1463-1469.
[20] 廖 青,李小明,杨 麒,等.好氧颗粒污泥的快速培养以及胞外多聚物对颗粒化的影响研究[J]. 工业用水与废水, 2008,38(4):13-19.Liao Q, Li X M, Yang Q, et al. Rapid cultivation of aerobic granular sludge and influence of extracellular polymeric substances on granulation [J]. Industrial Water & Wastewater, 2008,38(4):13-19.
[21] Liu Y, Tay J H. The essential role of hydrodynamic shear force in the formation of biofilm and granular sludge [J]. Water Research, 2002, 36(7):1653-1665.
[22] Badireddy A R, Chellam S, Gassman P L, et al. Role of extracellular polymeric substances in bioflocculation of activated sludge microorganisms under glucose-controlled conditions [J]. Water Research, 2010,44(15):4505-4516.
[23] Deng S, Wang L, Su H. Role and influence of extracellular polymeric substances on the preparation of aerobic granular sludge [J]. Journal of Environmental Management, 2016,173:49-54.
[24] 王陆玺,周 楠,王晨旭,等.流体流速对好氧颗粒污泥快速培养的影响[J]. 中国环境科学, 2018,38(6):2090-2096.Wang L X, Zhou N, Wang C X, et al. Influences of fluid flow rate on the rapid culture of aerobic granular sludge [J]. China Environmental Science. 2018,38(6):2090-2096.
[25] Xie B, Gu J, Lu J. Surface properties of bacteria from activated sludge in relation to bioflocculation [J]. Journal of Environmental Sciences, 2010,22(12):1840-1845.
[26] Badireddy A R, Chellam S, Gassman P L, et al. Role of extracellular polymeric substances in bioflocculation of activated sludge microorganisms under glucose-controlled conditions [J]. Water Research, 2010,44(15):4505-4516.
[27] Manikandan K, Sabareesh V, Singh N, et al. Two-Step Synthesis and Hydrolysis of Cyclic di-AMP in Mycobacterium tuberculosis [J]. Plos One. 2014,9(4):e965904.
[28] Du B, Ji W, An H, et al. Functional analysis of c-di-AMP phosphodiesterase, GdpP, in Streptococcus suis serotype 2[J]. Microbiological Research. 2014,169(9/10):749-758.
[29] Wan C, Zhang P, Lee D, et al. Disintegration of aerobic granules: Role of second messenger cyclic di-GMP [J]. Bioresource Technology, 2013,146:330-335.
Characteristics of signal molecules in the formation of aerobic granular sludge.
WANG Yu-ying1, ZHI Li-ling1, MA Xin-xin1, WANG Shuo1,2, LI Ji1,2*
(1.Jiangsu Key Laboratory of Anaerobic Biotechnology, Jiangnan University, Wuxi 214122, China;2.Collaborative Innovation Center of Water Treatment Technology and Material of Jiangsu Colleges, Jiangnan University, Suzhou 215009, China)., 2019,39(4):1516~1524
The correlation analysis based on the physical and chemical properties of sludge, the removal efficiency of pollutants, the variation of extracellular polymeric substances (EPS) and signal molecules during the granulation process were carried out. It was notable that the contaminants removal efficiency was significantly improved.Compared with activated sludge, the removal rates of COD, NH4+-N and PO43--P increased by factors of 20%, 36% and 57% in mature aerobic granular sludge. The extracellular protein (PN) and polysaccharide (PS) content increased by 116 and 31mg/gMLVSS, respectively. On the basis of laser confocal scanning microscopy (CLSM) analysis, it was remarkable that the protein from EPS increased significantly, which indicated that the protein may play an important role in the granulation process. The activity of phosphodiesterase showed an upward trend, and the second messenger cyclic diguanylic (c-di-GMP) content increased during formation and decreased when AGS became mature, which was consistent with the variation of protein and polysaccharide in EPS. Moreover, according to the SPSS analysis, c-di-GMP has a significantly positive correlation with proteins in Tightly Bound-EPS (TB-EPS). It was speculated that c-di-GMP may accelerate the formation of aerobic granular sludge by regulating the biosynthesis of proteins in TB-EPS.
aerobic granular sludge;extracellular polymeric substances (EPS);protein and polysaccharide;c-di-GMP;phosphodiesterase
X522
A
1000-6923(2019)04-1516-09
2018-09-03
国家水体污染控制与治理科技重大专项(2017ZX07202001- 004,2017ZX07202001-005);国家自然科学基金资助项目(51408264)
*责任作者, 教授, liji@jiangnan.edu.cn
王玉莹(1993-),女,山东济南人,江南大学硕士研究生,主要研究方向为好氧颗粒污泥形成机理解析.发表论文1篇.
