介入性超声治疗卵巢子宫内膜异位囊肿的临床效果
2019-04-28李炜智明春李贞爱
李炜,智明春,李贞爱
北京医院妇产科国家老年医学中心,北京100730
前言
卵巢子宫内膜异位囊肿是临床最为常见的育龄期女性疾病,同时具有一定的侵袭性,经过治疗后容易出现复发,在妇科疾病中是较为难治的疾病,因此对卵巢子宫内膜异位囊肿的治疗一直是妇产科研究的热点。单纯使用药物治疗无效,常规的进入腹腔操作手术后容易造成囊肿破裂或囊液的播散,形成盆腔粘连或不孕等并发症,对女性身心健康产生严重影响[1]。近年来随着微创手术的发展,腹腔镜手术在临床广泛应用,但是腹腔镜粘连术中止血方法和对患者卵巢储备功能产生较大影响,严重者可能出现卵巢早衰。近年来介入性超声治疗的飞速发展使得在超声动态监测下开展卵巢子宫内膜异位囊肿成为可能,通过超声监测将穿刺针准确置入病灶、囊腔中起到诊断和治疗的作用[2]。本研究观察介入性超声治疗卵巢子宫内膜异位囊肿的疗效,以期为临床提供进一步指导。
1 资料与方法
1.1 一般资料
选取2017年1月至2018年3月在北京医院治疗的卵巢子宫内膜异位囊肿患者130例,纳入标准:(1)均经病理检查确诊;(2)囊肿直径>5.0 cm;(3)无酒精过敏史;(4)患者及家属知情同意。排除标准:(1)近6个月有激素类药物治疗史;(2)合并有内分泌疾病、恶性肿瘤、免疫系统疾病等;(3)年龄>50岁。根据患者最终选取的治疗方案分为观察组(n=74)和对照组(n=56),两组患者一般资料比较差异无统计学意义(P>0.05),见表1。

表1 两组患者一般资料比较Tab.1 Comparison of general information of two groups of patients
1.2 治疗及随访
对照组:给予腹腔镜囊肿剔除术,患者全麻满意后置入腹腔镜器械,对卵巢周围粘连进行分离,采用电凝钳对囊肿表面进行凝固,形成凝固带,使用分离钳将卵巢和囊肿进行分离,穿刺抽吸巧克力囊液,采用抓钳将囊肿壁和卵巢完全剥离,止血后冲洗盆腔将标本取出。
观察组:给予介入性超声治疗,患者治疗前超声评估选取穿刺点,在超声引导下按照超声仪器设定的穿刺引导线进针进入囊肿中心,拔除针芯抽空囊腔液体,冲洗后确保囊腔液体澄清,根据囊腔大小注入无水乙醇治疗后抽出液体,并保留5 mL无水乙醇,以达到最佳治疗效果。
1.3 检测方法
在患者术后初次月经第2天抽取空腹静脉血5 mL,离心后分离血清,采用酶联免疫吸附法测定患者血清抑制素B(INHB)和抗苗勒管激素(AMH)浓度变化,试剂由美国雅培公司提供,严格按照试剂盒说明书进行操作。
1.4 统计学处理
采用SPSS 19.0 软件,计量资料采用均数±标准差表示,组间比较使用t检验,治愈率、复发率比较使用χ2检验,检验水准a=0.05。
2 结果
2.1 两组治愈及复发情况比较
观察组治愈率明显高于对照组(P<0.05),而复发率明显低于对照组(P<0.05),见表2。

表2 两组治愈及复发情况比较Tab.2 Comparison of cure rates and recurrence rates in two groups
2.2 两组治疗前后LH、FSH及窦状卵泡数比较
观察组治疗前后LH、FSH 及窦状卵泡数差异比较无统计学意义(P>0.05);对照组治疗后6个月FSH较治疗前升高(P<0.05),而窦状卵泡数较治疗前降低(P<0.05);观察组治疗后6个月FSH明显低于对照组(P<0.05),而窦状卵泡数明显高于对照组(P<0.05)。见表3。
2.3 两组治疗前后卵巢超声检查结果
观察组治疗前后卵巢间质动脉阻力指数、搏动指数及卵巢直径比较无统计学意义(P>0.05);对照组治疗后卵巢间质动脉阻力指数和搏动指数较治疗前升高(P<0.05),而卵巢直径较治疗前降低(P<0.05);观察组治疗后卵巢间质动脉阻力指数和搏动指数明显低于对照组(P<0.05),而卵巢直径明显高于对照组(P<0.05)。见表4。
2.4 两组治疗前后INHB、AMH比较
观察组和对照组治疗后INHB和AMH均较治疗前降低(P<0.05);观察组治疗后INHB 和AMH 明显高于对照组(P<0.05)。见表5。
3 讨论
子宫内膜异位症是临床妇科最为常见的疾病,好发于育龄期女性,异位的子宫内膜会伴随人体性激素变化形成周期性增殖、出血等体征,会刺激周围的组织形成纤维化的囊肿,一旦压力过高会导致囊壁发生破裂,形成局部的炎症反应和组织纤维化,反复出血导致陈旧性的血液演变为巧克力样囊液,对女性的身心健康产生严重影响[3-4]。研究发现子宫内膜异位症对8%~10%育龄女性产生影响,近1/3原发性或继发性不孕与子宫内膜异位症有关,而且部分绝经后的女性由于内源性雌激素存在还会出现复发[5]。目前认为卵巢子宫内膜异位囊肿发生的重要原因为种植转移和化生两种生物学行为导致[6]。传统的治疗方法主要是采取手术和药物治疗方法,目的是提升受孕率并延缓子宫内膜异位症发展,防止囊肿出现破裂[7]。药物治疗虽然有一定治疗效果,由于治疗周期长且停药后容易复发,因此受到了一定限制[8]。开放性手术治疗则对患者创伤较大,患者术后恢复慢。随着腹腔镜器械在临床的广泛应用,腹腔镜下行异位囊肿剥离取得了较好的治疗效果,对患者机体形成的炎症反应轻微,但是由于手术需要在全麻下开展,因此手术风险依然存在,而且部分病灶同周围的组织粘连紧密,手术进行剥离过程会导致囊肿发生破裂,使得囊肿无法进行完整的剥离,一旦囊液出现外渗后会形成种植播散,术后复发率较高[9-10]。

表3 两组治疗前后LH、FSH及窦状卵泡数比较Tab.3 Comparison of LH,FSH and the number of sinusoidal follicles before and after treatment in two groups
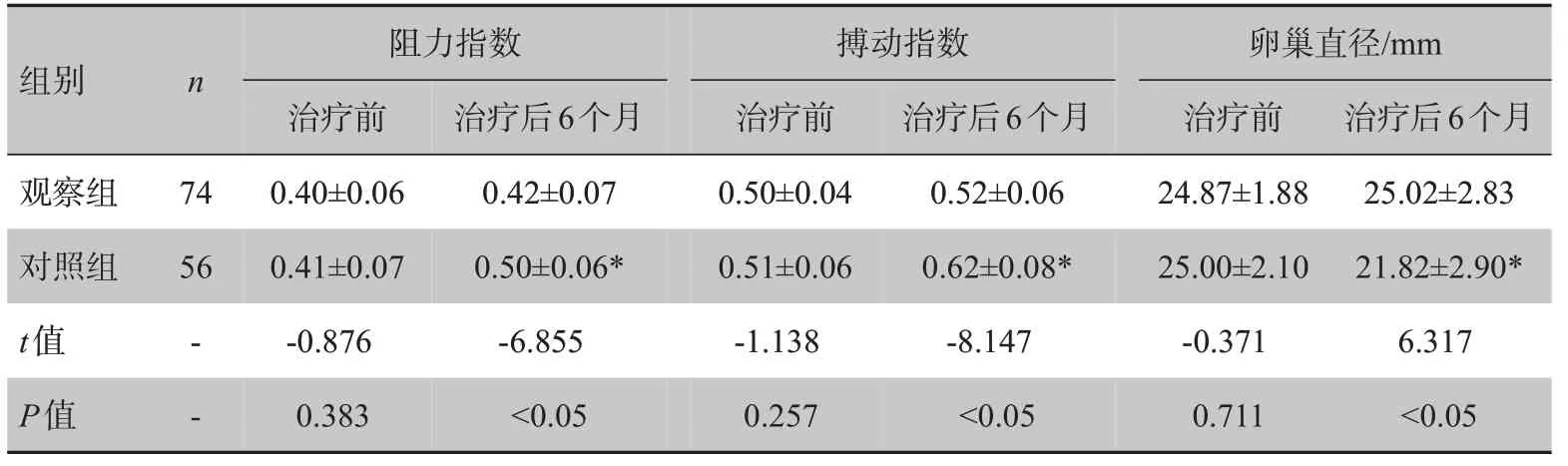
表4 两组治疗前后卵巢超声检查结果Tab.4 Results of ovarian ultrasound examination before and after treatment in two groups
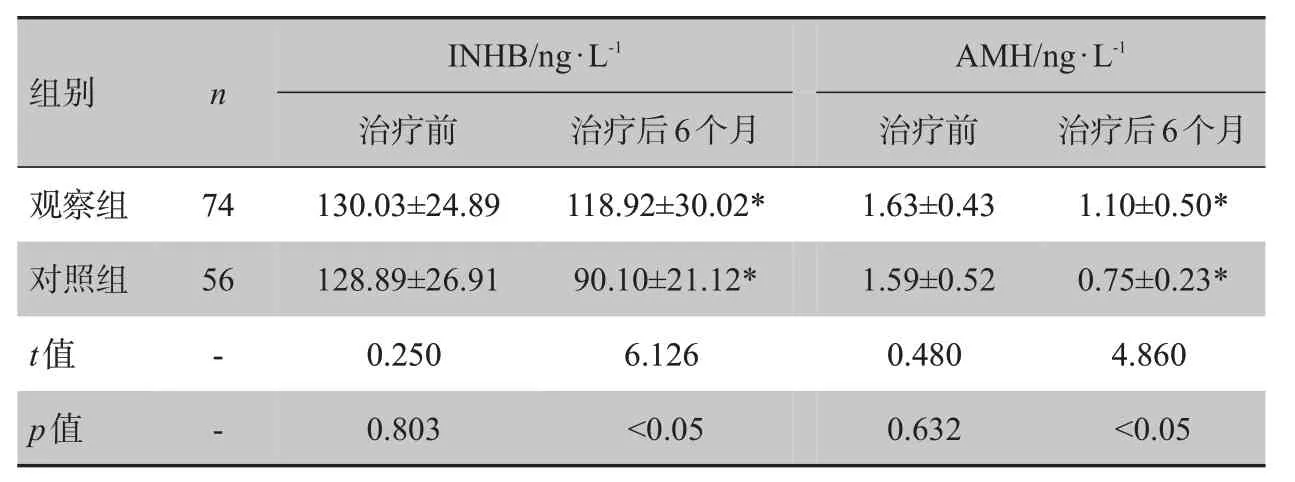
表5 两组治疗前后INHB、AMH比较Tab.5 Comparison of INHB and AMH before and after treatment in two groups
近年来随着临床微创理念的飞速发展,介入性超声治疗卵巢子宫内膜异位囊肿在临床开展应用,通过在超声下引导穿刺进入囊肿注入硬化剂,可以让囊肿壁的子宫内膜腺体和间质细胞出现蛋白凝固、变性和坏死,形成无菌炎症反应导致囊腔凝固和硬化,可以保留更多的卵巢组织,不会对患者卵巢功能产生过多影响[11]。研究发现介入性超声治疗卵巢子宫内膜异位囊肿一方面具有可识别性,可以将囊肿的位置、大小和周围毗邻脏器的关系进行清晰显示,通过超声引导实现可视化操作过程,尤其是超声探头靠近囊肿可以利用探头角度进行360°旋转,利用引导线进行更精确定位,简单可靠,安全性高[12];另一方面该方法对患者创伤更小,而且无放射性损伤,不需要对患者进行麻醉,因此患者手术痛苦小,疗程较短,患者术后恢复更快,尤其是对于育龄女性不会影响工作和生活;此外该治疗方法可以进行重复操作,对设备的要求较低,因此在基层医院可以进行广泛推广应用[13]。本研究在开展介入性超声治疗卵巢子宫内膜异位囊肿中总结了几点体会:一是手术的时间应选择患者月经干净3~7 d内进行,由于月经后子宫内膜处于增殖早期,囊肿内的囊液相对稀薄,因此容易抽吸,异位囊肿内壁的基底层暴露更清晰,采用无水乙醇进行硬化更为彻底[14];二是为降低囊肿复发在穿刺过程中要确保将囊液抽吸干净,使用生理盐水对囊腔进行反复冲洗,同时要确保无水乙醇同囊壁进行充分接触,在拔除穿刺针前要向囊内注入5 mL无水乙醇作为保留;三是在穿刺过程中尽量一针进入囊腔,避免多次穿刺或者移动导致撕裂伤引发出血,术后应采用超声确认盆腔内无出血,同时叮嘱患者应变换体位进行观察,确保药物同囊肿的内壁完全充分接触,必要时术后可以预防性应用抗菌药物防止感染发生[15]。本研究优势在于证实了采用介入性超声治疗卵巢子宫内膜异位囊肿的临床效果以及对患者卵巢储备功能影响,为临床治疗卵巢子宫内膜异位囊肿寻求更为可靠的治疗方案,但本研究纳入患者有限,随访时间较短,还需要开展多中心、大样本量、长期随访观察进行深入论证。
