老年胃癌患者缺氧诱导因子-1α及-2α的表达及其临床意义
2019-04-28李文金张先俊余世界
李文金,张先俊,余世界
(1湖北省第三人民医院阳逻院区消化内科,武汉 430415;2潜江市中心医院消化内科,武汉 433199;3武汉大学人民医院消化内科,武汉 430060)
胃癌能够导致患者整体死亡率上升[1]。部分地区的流行病学研究显示,胃癌的发病率可超过848/10万。在具有相关高危因素的群体中,胃癌的发病风险可进一步上升[2]。对于胃癌的发生机理,越来越多的研究关注到细胞因子或者肿瘤相关蛋白的改变。缺氧诱导因子-1α(hypoxia inducible factor-1 alpha,HIF-1α)及HIF-2α的阳性表达,能够通过诱导局部缺氧环境的形成,加剧癌细胞核DNA的转录速度,提高癌细胞的浸润和黏附能力[3]。相关研究探讨了HIF-1α和HIF-2α的表达与妇科恶性肿瘤或者肝脏恶性肿瘤的关系,认为HIF-1α和HIF-2α的阳性表达与恶性肿瘤的发生密切相关[4],但对二者在胃癌患者中的分析研究尚不足。本研究选取在湖北省第三人民医院阳逻院区消化内科接受治疗的老年胃癌患者为研究对象,探讨HIF-1α和HIF-2α的表达与胃癌的病情关系,报道如下。
1 对象与方法
1.1 研究对象
选取2017年2月至2018年3月期间在我院接受治疗的老年胃癌患者100例,其中男性65例,女性35例,年龄65~84(72.4±4.2)岁。纳入标准:(1)≥65岁;(2)经病理诊断确诊为胃癌;(3)无其他部位原发肿瘤。排除标准:(1)临床资料不全;(2)合并其他系统严重疾病。选取同期在我院接受胃镜检查的健康老年人(≥65岁)100名作为对照组,其中男性50例,女性50例,年龄65~85(72.4±5.0)岁。本项研究经医院伦理委员会评审通过,患者或家属均签署知情同意书。
1.2 方法
收集2组研究对象基本资料,并观察2组HIF-1α和HIF-2α的表达情况。比较不同临床病理特征胃癌患者HIF-1α和HIF-2α表达的差异,分析影响胃癌患者HIF-1α和HIF-2α表达的因素。
胃镜下采集胃癌组患者的病灶组织,对照组取上皮良性病变组织。石蜡包埋,连续性切片厚度3 μm,60℃烤片60 min,常规脱水后,采用EDTA进行抗原修复,加入10 μl蒸馏水,10%过氧化氢5 μl,室温下孵育30 min,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤3次,3 min/次,加入HIF-1α及HIF-2α蛋白的单克隆抗体(1∶1000,购自罗氏公司),37℃孵育60 min,PBS洗涤3次,3 min/次,加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的HIF-1α及HIF-2α蛋白二抗(1∶2000,购自罗氏公司),37℃孵育20 min,PBS洗涤3次,3 min/次,加入显色剂后,PBS冲洗和复染,脱水后在显微镜下进行观察。
HIF-1α及HIF-2α蛋白的阳性着色表达于细胞质,偶可见表达于细胞核,二者的阳性表达均呈黄色、棕黄色、褐色。免疫组化结果判定可根据:(1)着色强度:0分为无色、1分为淡黄色、2分为棕黄色、3分为褐色、黑色;(2)阳性细胞比例:≤10%为1分、11%~50%为2分、51%~75%为3分、>75%为4分。两种积分相乘总分<3分为阴性、≥3分为阳性。
1.3 统计学处理

2 结 果
2.1 2组研究对象一般资料比较
2组研究对象的年龄、性别等一般资料差异均无统计学意义(P>0.05;表1)。

表1 基线资料比较
BMI: body mass index.
2.2 2组研究对象HIF-1α及HIF-2α表达的比较
胃癌组患者的HIF-1α及HIF-2α阳性表达率均显著高于对照组(P<0.001;表2)。

表2 2组研究对象HIF-1α及HIF-2α阳性表达率的比较
HIF: hypoxia inducible factor.
2.3 影响胃癌患者HIF-1α及HIF-2α表达的单因素分析
临床分期、组织学分级和淋巴结转移情况对胃癌患者HIF-1α及HIF-2α阳性表达率有显著影响(P<0.05;表3)。
2.4 影响胃癌患者HIF-1α及HIF-2α表达的多因素logistic分析
将单因素分析有统计学差异的因素作为自变量,将HIF-1α及HIF-2α阳性表达作为因变量进行多因素logistic回归分析,结果显示,淋巴结转移情况和临床分期是影响胃癌患者HIF-1α及HIF-2α阳性表达的独立危险因素(P<0.05;表4)。
3 讨 论
幽门螺杆菌感染、饮食习惯或者携带遗传易感基因,均能够促进胃癌发生[5]。老年胃癌患者的病死率可达35%以上,无瘤生存时间不足34个月[6,7]。对于胃癌患者的病情评估具有重要的意义。虽然血清糖类抗原125(carbohydrate antigen 125,CA125)或者癌胚抗原(carcino-embryonic antigen,CEA)等肿瘤相关抗原能够在胃癌的诊疗过程中发挥作用,但部分单中心的临床分析研究发现,二者评估胃癌病情与实际病情的一致性率较低[8]。
缺氧诱导因子是炎症性诱导相关因子,能够通过诱导癌细胞转录上游启动子激活,提高其对于癌细胞周期调控的影响程度,促进癌细胞核异常分裂。缺氧诱导因子能够通过结合癌细胞膜表面的糖蛋白配体,促进癌细胞内多种信号通路的激活,改变癌细胞肿瘤生物学特征[9]。相关研究还认为,缺氧诱导因子能够促进局部肿瘤新生毛细血管形成,提高肿瘤病灶组织的血流灌注程度,进而加剧恶性肿瘤的发生发展[10,11]。部分研究者已经探讨了缺氧诱导因子表达与胃癌的关系,认为缺氧诱导因子的阳性表达与胃癌的发生密切相关[12],但缺乏对于缺氧诱导因子表达与胃癌临床病理特征关系的研究。
本研究结果表明,胃癌组患者的HIF-1α及HIF-2α阳性表达率均显著高于对照组(P<0.001),提示缺氧诱导因子能够参与到胃癌的病情进展过程,考虑与如下因素有关[13,14]。(1)HIF-1α及HIF-2α阳性表达,能够促进癌细胞凋亡比例下降,导致癌细胞凋亡速度减慢;(2)HIF-1α及HIF-2α能够激活癌细胞细胞核转录因子-κB信号通路,提高癌细胞持续性自我增殖的速度。王伟宏等[15]研究认为,在胃癌患者中, 缺氧诱导因子的阳性表达率可平均上升45%以上,在合并明显肿瘤恶病质或者远处转移的患者中,缺氧诱导因子的阳性表达率上升更为显著。本研究结果表明,临床分期、组织学分级和淋巴结转移情况对胃癌患者HIF-1α及HIF-2α阳性表达率有显著影响(P<0.05),提示缺氧诱导因子的表达与胃癌患者临床病理特征的关系。这主要由于缺氧诱导因子的阳性表达,能够提高癌细胞的浸润深度,促进癌细胞黏附淋巴结组织,进而加剧了胃癌患者临床病理特征进展。但不同性别来源的患者,其缺氧诱导因子的表达差异并无统计学意义,提示相关细胞因子的表达并无明显的性别分布差别。进一步的多因素logistic回归分析结果表明,淋巴结转移情况和临床分期是影响胃癌患者HIF-1α及HIF-2α阳性表达的独立危险因素(P<0.05),提示了缺氧诱导因子的表达与胃癌患者综合性病情的关系。
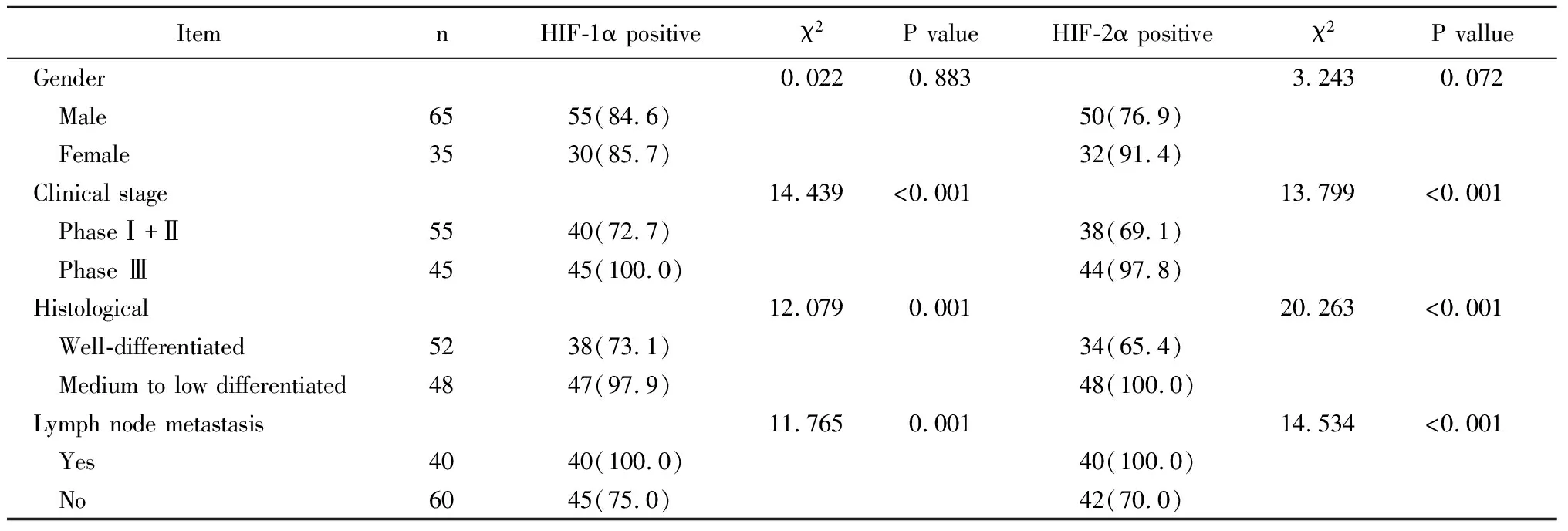
表3 影响胃癌患者HIF-1α及HIF-2α表达的单因素分析
HIF: hypoxia inducible factor.

表4 影响胃癌患者HIF-1α及HIF-2α表达的多因素logistic分析
HIF: hypoxia inducible factor.
综上所述,在胃癌患者中,HIF-1α及HIF-2α的阳性表达率明显上升,同时缺氧诱导因子的表达与胃癌患者的临床病理特征具有密切联系。后续研究希望可以探讨缺氧诱导因子的表达与胃癌患者生存预后的关系。
