LHA-VTA Orexin-A通路对大鼠胃牵张敏感神经元放电活动和胃功能的调控研究
2019-04-26宗勇刘潇柠金婷婷孙向荣栾晓高胜利郭菲菲
宗勇 刘潇柠 金婷婷 孙向荣 栾晓 高胜利 郭菲菲

【摘要】 目的:觀察下丘脑外侧核(LHA)-中脑腹侧被盖区(VTA)Orexin-A通路对大鼠胃牵张敏感神经元放电活动和胃排空的影响。方法:大鼠经VTA给予Orexin-A,采用单细胞外放电记录方法,观察VTA内胃牵张敏感神经元放电活动;酚红定量法测定大鼠胃排空,并观察电刺激下丘脑外侧核后,VTA内Orexin-A反应性胃牵张敏感神经元放电活动及大鼠胃排空的变化。结果:电生理记录到58个胃牵张敏感VTA神经元(GD),胃扩张后呈现兴奋效应(GD-E)41个,呈现抑制效应(GD-I)17个。VTA微量注射Orexin-A,41个GD-E中,68.29%的神经元放电频率显著升高(P<0.05),而17个GD-I中,70.59%的神经元放电频率显著增加(P<0.05)。VTA预先注射Orexin1型受体拮抗剂SB-334867,则Orexin-A对胃牵张敏感神经元的作用被完全阻断(P>0.05)。电刺激LHA,在VTA记录到31个Orexin-A反应性GD-E神经元,其中有70.97%神经元进一步呈现兴奋效应(P<0.05);在VTA记录到的17个Orexin-A反应性GD-I神经元,其中有64.71%神经元放电频率显著升高(P<0.05)。SB-334867预处理VTA可抑制电刺激LHA的作用(P<0.05)。胃排空研究结果显示,VTA内微量注射Orexin-A和电刺激LHA,大鼠胃排空均显著增加(P<0.05),VTA预先微量注射SB-334867,可阻断该效应(P<0.05)。结论:下丘脑LHA-VTA存在Orexin-A功能通路,该通路可能参与胃功能的调控。
【关键词】 Orexin-A; 下丘脑外侧核-中脑腹侧被盖区通路; 胃牵张敏感神经元; 胃排空
doi:10.14033/j.cnki.cfmr.2019.26.002 文献标识码 A 文章编号 1674-6805(2019)26-000-04
Regulation of LHA-VTA Orexin-A Pathway on Discharge Activity of Gastric Distension Responsive Neurons and Gastric Emptying in Rats/ZONG Yong,LIU Xiaoning,JIN Tingting,et al.//Chinese and Foreign Medical Research,2019,17(26):-6
【Abstract】 Objective:To observe the effect of Orexin-A pathway from lateral hypothalamic nucleus(LHA) to ventral tegmental area(VTA) on the discharge activity of gastric distension(GD) responsive neurons and gastric emptying in rats.Method:Extracellular discharges of single unit neuron was used to observe the discharge activity of GD-responsive neurons in VTA.Phenol red quantitative method was used to measure the gastric emptying in rats.The changes of the discharge activity of GD-responsive neurons in VTA and the gastric emptying in rats were observed after VTA Orexin-A administration or LHA electrical stimulation.
Result:Electrophysiological study showed that 58 GD were recorded in the VTA,of which 41 showed excitatory effects(GD-E) and 17 showed inhibitory effects(GD-I).Out of the 41 GD-E neurons,the discharge frequency of 68.29% was significantly increased(P<0.05).Out of GD-I neurons,the discharge frequency of 70.59% was significantly rised(P<0.05).After preadministration of Orexin-A receptor antagonist SB334867 into VTA,the effect of Orexin-A on GD sensitive neurons was completely blocked(P>0.05).31 Orexin-A reactive GD-E neurons in VTA were recorded after electrical stimulation of LHA,of which 70.97% neurons showed further excitatory effects(P<0.05);in orexin-A sensitive GD-I neurons,the discharge frequency of 64.71% neurons were significantly rised(P<0.05).Orexin-A receptor antagonist SB-334867 could inhibit the effects(P<0.05).The gastric emptying of rats was significantly increased by microinjection of Orexin-A in VTA(P<0.05) or electrical stimulation of LHA(P<0.05).Pre-microinjection of SB-334867 into VTA could block the effects(P<0.05).Conclusion:There is an Orexin-A pathway between LHA-VTA,which may be involved in the regulation of gastric function.
【Key words】 Orexin-A; LHA-VTA pathway; Gastric distension-sensitive neurons; Gastric emptying
First-authors address:School of Basic Medicine,Qingdao University,Qingdao 266071,China
下丘脑包含室旁核(PVN)、弓状核(ARC)、腹内侧核(VMH)、背内侧核(DMH)和外侧区(LHA)等,主要通过协调行为、代谢和神经内分泌反应等发挥作用[1]。下丘脑LHA因损伤后动物模型出现摄食量下降和致死性的昏睡,一直被认为是“饥饿中枢”和重要的觉醒核团,且是中枢少数几个表达神经肽Orexin的核团之一[2-3]。Orexin主要作用是促进摄食和维持觉醒状态,包括Orexin-A和Orexin-B两种亚型,其受体为Orexin 1型和2型,在中枢广泛分布,Orexin神经元轴突在整个大脑中广泛投射,有广泛而复杂的功能[4-5]。
VTA是中脑边缘多巴胺系统的核心脑区,在成瘾药物,如吗啡作用下,VTA内多巴胺(DA)神经元被激活,使伏隔核(NAc)内DA水平显著升高,这是成瘾药物发挥奖赏和强化效应及成瘾行为建立的重要神经基础[6]。进一步动物实验发现,VTA、NAc和LC等成瘾和奖赏行为反应有关核团内存在Orexin神经投射纤维[7],且VTA注射Orexin激活VTA多巴胺能神经元,增强由食物或药物引发的奖赏行为[8-10]。
本研究应用神经元单细胞外放电方法记录电刺激LHA对VTA神经元放电频率,通过胃排空变化观察VTA在Orexin调控摄食中的作用,从而能够对LHA表达Orexin作用和VTA在摄食、代谢和奖赏成瘾间相互调控作用有进一步认识,为肥胖和成瘾治疗提供理论基础。
1 材料与方法
1.1 实验动物与分组
Sprague-Dawley(SD)健康大鼠,成年雄性,体重200~250 g,标准饲料,饮水进食无限制。动物实验前适应性饲养1周。按照《青岛大学实验动物保护和使用管理办法》要求进行所有动物实验。细胞外放电记录共用大鼠90只,其中VTA注射Orexin-A后用50只,电刺激LHA后用40只。大鼠胃排空共用48只,其中VTA注射Orexin-A后用24只,随机分为三组(n=8):生理盐水组、Orexin-A组、SB334867+Orexin-A组;电刺激LHA后用24只,随机分为三组(n=8):假电刺激组(SS)、电刺激组(ES)、SB334867+ES组。
1.2 实验方法
1.2.1 动物麻醉 大鼠禁食18 h后,腹腔注射水合氯醛麻醉(10%,300 mg/kg)。实验过程中根据动物反应程度酌情注射水合氯醛维持麻醉状态,每次低于首剂量的1/3。
1.2.2 胃部手术 分离大鼠胃部,胃大弯侧切开胃腔,长约
1 cm,开口处放入胃扩张球囊,球囊接聚乙烯软管到电子恒压器,缝合胃部切口。再结扎胃幽门与十二指肠结合部,避免十二指肠反流。最后缝合腹部切口。为模拟胃部摄食扩张,由电子恒压器注射3~5 ml生理盐水进入胃内球囊,持续20 s,间隔4 min,共2 h[11]。
1.2.3 VTA埋管术 空腹大鼠麻醉后固定于恒温脑立体定位仪。参照Paxinos大鼠脑解剖图谱[12],按VTA(前囟后5.6~6 mm,正中线旁开0.5~1 mm,颅骨下8~9 mm)定位用牙科钻在颅骨开口,将不锈钢套管(29 G)缓慢插入VTA,用牙托粉固定,缝合头皮。术后7 d,每日腹腔注射青霉素8万单位。
1.2.4 玻璃微电极制备 按要求(尖端直径约3~10 μm,电极阻抗5~20 MΩ)制备四管玻璃微电极[13],1号管灌注0.2%滂胺天蓝(pH 7.7),滂胺天蓝内插入银电极丝,传导电流信号至电生理记录仪;2、3和4号管分别用于注射Orexin-A溶液、SB-334867溶液或0.5 mol/L氯化钠溶液。
1.2.5 细胞外放电记录 记录前,监听器和记录仪所示波形判断玻璃微电极的尖端进入空气与琼脂界面,再用微量推进器缓慢将微电极送至监测核团。探寻、记录稳定的细胞外放电神经元,并鉴别其是否为胃扩张敏感神经元。压力注射仪经2、3、4管将干预药物分别注射于细胞表面,压力:3.0~35.0 psi,给药时间:100~1 500 ms/次,重复次数:2~5次[14]。神经元放电信号经放大器后输入记录仪,POWERLAB生物信号处理软件分析神经元放电频率变化。
1.2.6 电刺激伏隔核 空腹大鼠麻醉后固定于脑立体定位仪。参照Paxinos大鼠脑解剖图谱,将刺激电极插入LHA(前囟后5.6~6 mm,正中线旁开0.5~1 mm,颅骨下8~9 mm),连接至电刺激器,设定参数:波宽0.5 ms,强度20 μA,频率50 Hz,持续时间10 s[15]。实验后,多聚甲醛灌注固定,取脑行冠状切片,HE染色观察电极位置,電极位于LHA内数据计入统计。
1.2.7 胃排空实验 1.5 ml的酚红注入空腹大鼠胃内。20 min后,处死大鼠,分离幽门和贲门,分别结扎后取下完整胃部。胃大弯侧剖开胃体,内容物全部倒入100 ml NaOH溶液(0.1 N)中,缓慢搅匀后置于室温1 h。5 ml待测液上清与0.5 ml三氯乙酸(20%)混匀后离心(3 000 r/min,20 min)。离心后取1 ml上清液与4 ml NaOH溶液(0.5 N)充分混合,测量混合液对560 nm光的吸收值。胃排空率计算公式如下:胃排空率(%)=(1-酚红灌胃20 min后吸收值/酚红标准吸收值)×100%。
1.3 统计学处理
应用SPSS 17.0对数据统计分析,数据以(x±s)表示。多样本均数比较采用单因素方差分析,两组间样本均数比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Orexin-A对中脑腹侧被盖区胃牵张敏感神经元放电活动的影响
本实验共用大鼠50只,在VTA内共记录到58个胃牵张敏感神经元(GD),其中有41个神经元放电频率从(5.65±1.27)Hz增大至(7.73±2.33)Hz(P<0.05),为胃牵张兴奋性神经元(GD-E)。有17个神经元放电频率从(5.78±0.97)Hz减小至(3.42±0.56)Hz(P<0.05),为胃牵张抑制性神经元(GD-I)。
VTA经四管玻璃微电极微量注射Orexin-A,41个GD-E神经元中,有28个神经元(28/41,68.29%)放电频率从(6.14±1.22)Hz升高到(9.21±1.43)Hz(图1 A),有9个神经元(9/41,21.95%)放电频率从(6.87±1.46)Hz降低到(4.13±1.12)Hz,差异有统计学意义(P<0.05),其余4个神经元(4/41,9.76%)注射Orexin-A后放电频率无显著变化(P>0.05)。Orexin1型受体拮抗剂SB334867预处理VTA,可阻断Orexin-A对GD神经元的作用(P<0.05,图1A)。
GD-I神经元中,Orexin-A刺激12个神经元(12/17,70.59%)放电频率从(6.03±1.42)Hz升高到(9.22±1.90)Hz(P<0.05;图1B),4个神经元(4/17,23.53%)放电频率被抑制,从(6.23±1.01)Hz下降到(3.12±0.92)Hz(P<0.05),1个神经元(1/17,23.53%)对Orexin-A无明显反应(P>0.05)。VTA中预先注射SB334867,可阻断Orexin-A对GD神经元的影响(P<0.05,图1B)。生理盐水对VTA中GD神经元放电频率无影响(P>0.05)。
图1 中脑腹侧被盖区中微量注射Orexin-A对大鼠胃牵张敏感神经元的影响
注:A为GD-E神经元;B为GD-I神经元。
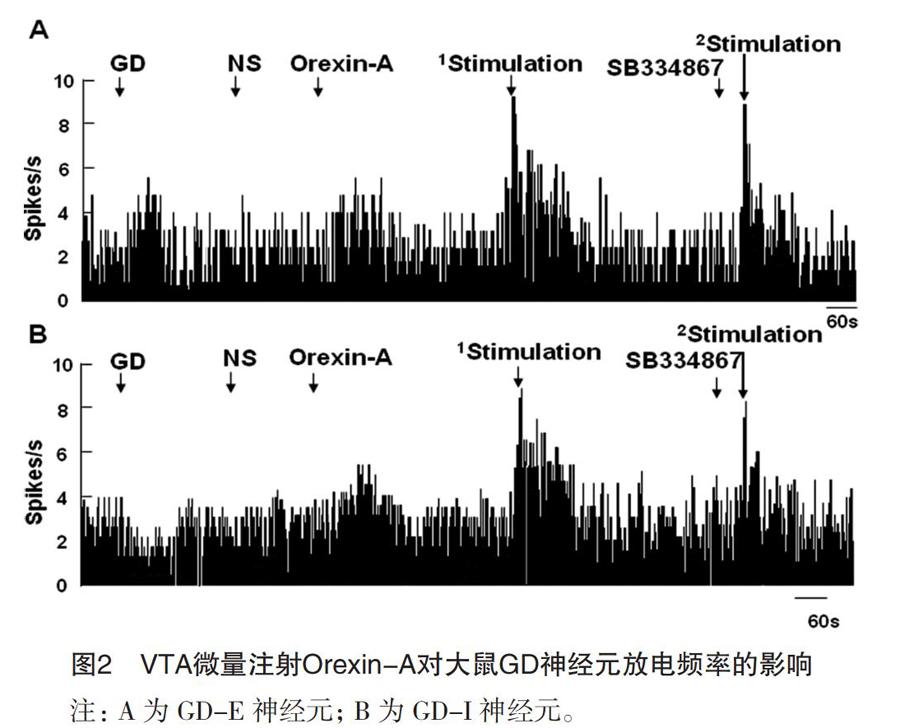
2.2 电刺激下丘脑LHA对VTA内Orexin-A反应性胃牵张敏感神经元放电活动的影响
本组共用40只大鼠,在VTA中鉴别出43个GD-E神经元,26个GD-I 神经元。Orexin-A刺激31个GD-E神经元(31/43,72.09%)和17个GD-I神经元(11/17,64.71%)放电频率升高。
上述31个GD-E神经元中,22个(22/31,70.97%)放电频率在电刺激LHA时加快,从(6.41±1.98)Hz升高至(12.55±3.35)Hz(P<0.05,图2A),6个(6/31,19.35%)放电频率减慢[(6.15±2.06)Hz vs (3.49±1.27)Hz,P<0.05,图2A],其余3个(3/31,9.68%)神经元放电频率无明显变化(P<0.05,图2A)。
17个可被Orexin-A激活的GD-I神经元中,11个神经元(11/17,64.71%)在电刺激LHA时出现兴奋状态,放电频率升高[(6.28±1.28)Hz vs (9.65±2.29)Hz,P<0.01,图2B],5个(5/17,29.41%)神经元放电频率受抑制[(6.91±1.78)Hz vs (4.02±1.06)Hz,
P<0.05],1个(1/17,5.88%)神经元的放电频率无显著变化(P>0.05)。
进一步研究电刺激LHA对VTA中GD神经元调控作用是否通过orexin递质通路,VTA中预先注射SB334867降低电刺激LHA对VTA内GD-神经元放电频率的作用(P<0.05,图2A、2B)。VTA内单独注射SB334867,GD-E神经元和GD-I神经元放电频率均未出现显著改变(P>0.05,图2A、2B)。
图2 VTA微量注射Orexin-A对大鼠GD神经元放电频率的影响
注:A为GD-E神经元;B为GD-I神经元。
2.3 VTA微量注射Orexin-A对大鼠胃排空的影响
VTA微量注射Orexin-A后,Orexin-A组大鼠20 min胃排空率与生理盐水组相比显著增加[(94.4±3.9)% vs (78.2±16.7)%,P<0.05,图3]。SB334867预处理VTA显著降低Orexin-A引起的大鼠胃排空增加[(81.2±4.2)%,P<0.05]。
图3 中脑腹侧被盖区微量注射Orexin-A对大鼠胃排空的影响
*与生理盐水组相比,P<0.05;#与SB334867+Orexin-A组比较,P<0.05。
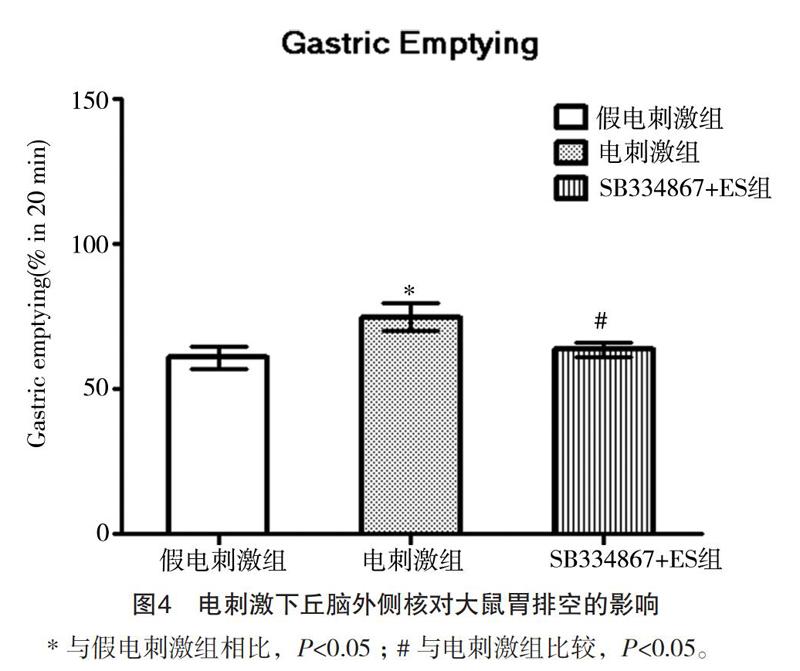
2.4 電刺激下丘脑LHA对胃排空的影响
与VTA中注射Orexin-A类似,LHA电刺激促进胃排空。电刺激LHA(50 mA)20 min后,胃排空率较假电刺激组增加[(74.67±4.76)% vs (60.79±3.98)%,图4],与假电刺激组相比,差异有统计学意义(P<0.05)。电刺激LHA前VTA中注射SB334867(6 μg),电刺激LHA增加胃排空的作用减轻,排空率为(63.56±2.54)%,与LHA电刺激组相比,差异有统计学意义(P<0.05)。以上结果提示LHA可通过VTA调控胃排空,且LHA和VTA间Orexin-A神经通路发挥重要作用。
3 討论
本研究发现,Orexin-A刺激VTA中胃牵张敏感神经元放电频率变化,电刺激下丘脑LHA区域也影响VTA中胃牵张敏感神经元放电频率,Orexin1型受体拮抗剂SB334867可阻断此作用;胃排空实验结果显示VTA注射Orexin-A和电刺激LHA均增加胃运动,且SB334867预处理后胃运动无显著增加。
本实验结果显示,VTA内胃牵张敏感神经元在Orexin-A刺激后放电频率发生变化,兴奋性部分增加,部分降低或无反应,提示VTA内胃牵张敏感神经元大部分表达Orexin-A受体。关于Orexin-A在VTA内作用机制,Borgland等[16-17]发现急性应用Orexin-A能够通过PKC/PLC信号通路剂量依赖性增加NMDA受体后兴奋性突触后电位,但对AMPA受体后兴奋性突触后电位无作用。Chiou等[18]还发现Orexin-A激活Gq/11偶联的PLC-DAGL通路,再通过2-花生酰甘油三酯(2-AG)逆行抑制GABA产生和释放。本实验电刺激LHA后,VTA部分神经元放电频率发生变化,说明LHA与VTA间存在信号传递,且1型受体拮抗剂SB334867预处理能够抑制此影响,进一步表明LHA内部分Orexin-A沿神经元轴突纤维投射至VTA发挥作用。
既然VTA内胃运动相关的神经元对Orexin-A有反应,那么Orexin-A在VTA内是否参与胃运动的调控,LHA到VTA的神经元投射又有什么功能?本实验观察VTA内注射Orexin-A促进大鼠胃排空,与Orexin-A外周或中枢DMN内注射作用一致。电刺激LHA后胃排空增强,且SB334867预处理阻断其作用,提示电刺激LHA后促进其表达Orexin-A,经轴突传递至VTA后具有一定生理功能。VTA由DA、GABA和谷氨酸(GLU)释放神经元组成,其中DA神经元最丰富,而GABA和GLU神经元分别占总数的35%和2%~5%[19]。因VTA无直接神经元投射至胃部,故推测Orexin-A刺激VTA兴奋后,通过GABA或多巴胺(DA)等递质直接或间接影响DMN等迷走神经核团,再发挥调控胃排空作用。
本实验通过电生理学和胃排空变化,观察LHA经Orexin-A递质对VTA神经元放电调控及对胃排空的促进作用,完善了生理条件下LHA与VTA间Orexin递质作用,为进一步研究Orexin在调控VTA有关的奖赏性摄食和非生理性摄食提供新的研究思路,为肥胖和成瘾治疗提供新的理论基础。
参考文献
[1] Cakir I,Nillni E A.Endoplasmic reticulum stress,the hypothalamus,and energy balance[J].Trends Endocrinol Metab,2019,30(3):163-176.
[2] Mobbs C V.Orphaned no more?Glucose-sensing hypothalamic neurons control insulin secretion[J].Diabetes,2016,65(9):2473-2475.
[3] Ono D,Yamanaka A.Hypothalamic regulation of the sleep/wake cycle[J].Neurosci Res,2017,118:74-81.
[4] Peyron C,Tighe D K,Van den Pol A N,et al.Neurons containing hypocretin(orexin) project to multiple neuronal systems[J].J Neurosci,1998,18(23):9996-10015.
[5] Nambu T,Sakurai T,Mizukami K,et al.Distribution of orexin neurons in the adult rat brain[J].Brain Res,1999,827(1-2):827.
[6] Morales M,Margolis E B.Ventral tegmental area:cellular heterogeneity,connectivity and behaviour[J].Nat Rev Neurosci,2017,18(2):73-85.
[7] Fadel J,Deutch A Y.Anatomical substrates of orexin-dopamine interactions:lateral hypothalamic projections to the ventral tegmental area[J].Neuroscience,2002,111(2):379-387.
[8] Korotkova T M,Sergeeva O A,Eriksson K S,et al.Excitation of ventral tegmental area dopaminergic and nondopaminergic neurons by orexins/hypocretins[J].J Neurosci,2003,23(1):7-11.
[9] Boutrel B,Kenny P J,Specio S E,et al.Role for hypocretin in mediating stress-induced reinstatement of cocaine-seeking behavior[J].Proc Natl Acad Sci USA,2005,102(52):19168-19173.
[10] Harris G C,Wimmer M,Aston-Jones G.A role for lateral hypothalamic orexin neurons in reward seeking[J].Nature,2005,437(7058):556-559.
[11] Appia F,Ewart W R,Pittam B S,et al.Convergence of sensory information from abdominal viscera in the rat brain stem[J].Am J Physiol,1986,251(2 Pt 1):G169-175.
[12] De Groot.The rat hypothalamus in stereotaxic coordinates[J].The Journal of Comparative Neurology,1959,113(3):389-400.
[13] Li Z L,Xu L,Sun X R,et al.Central nesfatin-1 influences the excitability of ghrelin-responsive gastric distension neurons in the arcuate nucleus and reduces gastric motility in rats[J].Eur J Neurosci,2013,38(11):3636-3643.
[14] Jhamandas J H,Lind R W,Renaud L P.Angiotensin II may mediate excitatory neurotransmission from the subfornical organ to the hypothalamic supraoptic nucleus:an anatomical and electrophysiological study in the rat[J].Brain Res,1989,487(1):52-61.
[15] Avetisyan E A,Adamyan F A,Petrosyan A A.The role of the septal nuclei in controlling the activity of vagosensitive neurons in the solitary tract nucleus in cats[J].Neurosci Behav Physiol,2004,34(5):473-478.
[16] Borgland S L,Taha S A,Sarti F,et al.Orexin A in the VTA is critical for the induction of synaptic plasticity and behavioral sensitization to cocaine[J].Neuron,2006,49(4):589-601.
[17] Borgland S L,Storm E,Bonci A.Orexin B/hypocretin 2 increases glutamatergic transmission to ventral tegmental area neurons[J]Eur J Neurosci,2008,28(8):1545-1556.
[18] Chiou L C,Tung L W,Lee Y S,et al.Orexin-endocannabinoid signaling in stress-induced cocaine relapse[C]//International Narcotic Research Conference,Cairns,Australia.2013.
[19] Taylor S R,Badurek S,Dileone R J,et al.GABAergic and glutamatergic efferents of the mouse ventral tegmental area[J].Journal of Comparative Neurology,2014,522(14):3308-3334.
(收稿日期:2019-07-26) (本文編辑:何玉勤)
*基金项目:中国博士后科学基金项目
(项目编号:2018M632627;2018M630749)
山东省医药卫生科技发展计划项目(项目编号:2018WS378)
①青岛大学基础医学院 山东 青岛 266071
②淄博市临淄区妇幼保健院
通信作者:高胜利
