百事乐加味方对脑卒中后抑郁模型大鼠海马-前额叶皮层神经细胞凋亡蛋白的影响
2019-04-25刘林刘检刘羽凌佳李弘肖波邵乐易亚乔
刘林 刘检 刘羽 凌佳 李弘 肖波 邵乐 易亚乔


摘要:目的 觀察百事乐加味方对脑卒中后抑郁(PSD)大鼠神经功能、形态学及海马(HP)、前额叶皮层(PFC)组织Bax、Bcl-2、Caspase-3蛋白表达的影响,从神经细胞凋亡方面探讨百事乐加味方防治PSD作用机制。方法 采用MCAO+CUMS+孤养法复合因素建立PSD模型。分组前进行行为学评分,随机分为假手术组、抑郁组、卒中组、PSD组、阳性药组和百事乐加味方高、低剂量组,各给药组给予相应药物,连续28 d。采用HE和Nissl染色观察HP、PFC组织形态学;采用免疫组化检测大鼠HP、PFC组织Bax、Bcl-2、Caspase-3蛋白表达。结果 对神经功能缺损评分的影响:与PSD组大鼠比较,百事乐加味方高、低剂量组第21、28日神经功能缺损评分显著改善(P<0.05,P<0.01);对HP、PFC组织形态学的影响:与PSD组比较,百事乐加味方高、低剂量组大鼠病变明显改善。对凋亡蛋白的影响:百事乐加味方高剂量组大鼠HP、PFC组织Bax、Caspase-3蛋白表达显著降低,Bcl-2蛋白表达显著升高,Bcl-2/Bax比值显著增大(P<0.01);百事乐加味方低剂量组大鼠HP、PFC组织Bcl-2蛋白表达显著升高,Caspase-3蛋白表达显著降低,HP组织Bax蛋白表达显著降低,Bcl-2/Bax比值显著增大(P<0.05,P<0.01)。结论 百事乐加味方通过调控凋亡蛋白表达,抑制细胞凋亡,减少神经病变,改善神经功能,从而发挥治疗作用,是其抗PSD主要作用机制之一。
关键词:海马-前额叶皮层环路;卒中后抑郁;神经元凋亡;脑缺血;大鼠
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2019)04-0061-07
卒中后抑郁(post-stroke depression,PSD)是最常见的脑血管疾病为主导致精神障碍类疾病,60%卒中患者受PSD影响,增加其死亡率和自杀率[1]。目前关于PSD发病机制的诸多假说均与海马、前额叶皮层、杏仁核、缰核等脑区密切相关,海马和前额叶之间存在突触交叉联系,即海马-前额叶皮层环路(hippocampal-prefrontal cortical circuit,HP-PFC),是处理神经信息的关键环路和PSD病理机制的重要靶点。以“疏肝解郁、活血化痰”治法组方的百事乐加味方可有效改善PSD患者中医症状,具有较好的抗抑郁及改善神经功能作用[2],但其作用机制有待进一步深入探讨。因此,本研究通过观察PSD大鼠海马、前额叶皮层病理形态学改变和凋亡相关因子Bcl-2、Bax和Caspase-3表达,从细胞凋亡方面探讨百事乐加味方防治PSD的作用机制,为临床广泛应用提供依据。
1 实验材料
1.1 药物
百事乐加味方(柴胡、贯叶连翘、川芎等),湖南中医药大学第一附属医院中药房提供,本实验用药按照传统煎煮法制备;盐酸氟西汀分散片,20 mg/片,礼来(苏州)制药有限公司,批号6621A;阿司匹林片,规格50 mg/片,舒泰神(北京)生物制药股份有限公司,批号141202。
1.2 动物
SD大鼠80只,SPF级,雄性,体质量(200±20)g,湖南斯莱克景达实验动物有限公司,动物许可证号SCXK(湘)2016-0002。饲养于湖南中医药大学第一附属医院SPF动物实验室,温度18~22 ℃、相对湿度40%~50%,自由摄食饮水。
1.3 主要试剂与仪器
Bax、Bcl-2、Caspase-3一抗,Bioss公司;羊抗兔/小鼠IgG,中杉金桥生物试剂公司,批号K173301E;DAB显色液,中杉金桥生物试剂公司,批号K176810E;甲苯胺兰,上海试剂三厂,批号201502;苏木精-伊红,国药集团化学试剂有限公司,批号BS0661;水合氯醛,国药集团化学试剂有限公司;蔗糖,广东光华科技股份有限公司。离心机,湖南湘仪实验室仪器开发有限公司;血液混匀仪,北京宏润达科技发展有限公司;AUW2200分析天平,日本岛津;BC51显微镜,日本奥林巴斯公司。
2 实验方法
2.1 造模
参照改良Koizumi法[2]制作局灶性脑缺血大脑中动脉栓塞(MCAO)模型。10%水合氯醛(3 mL/kg)腹腔注射麻醉,颈部正中切口,钝性分离右颈总动脉(CCA)主干、CCA分叉、颈外动脉(ECA)和颈内动脉(ICA),相继结扎CCA主干和ECA近心端,在CCA主干远端及ICA根部穿线备用,用微动脉夹暂时夹闭ICA远端,在距CCA分叉部3~4 mm处用眼科剪剪一小口,插入线栓,使线栓从CCA顺行进入ICA,松开ICA的微动脉夹,使线栓略呈弧形,向外上方的角度缓慢顺着ICA走向插入,防止误插入翼腭动脉。若插进约10 mm阻力明显则提示误插,此时可缓慢退出后调整方向再插,直到阻力感较明显时停止插入,此时插入深度约为18~20 mm(从CCA分叉处计算),说明线栓到达大脑中动脉(MCA)起始段,将阻断进入MCA的血流,引起局灶性脑缺血改变。结扎CCA主干远端及ICA根部备线,防止线栓脱落,剪断多出的栓线。生理盐水清洗,消毒棉球清洁手术野,逐层缝合。注射用青霉素钠盐4万U/只腹腔注射,预防术后感染[2-3]。大鼠单笼孤养,术后恢复7 d,再给予28 d慢性不可预见温和应激(CUMS),包括禁食、禁水、行为限制、潮湿垫料、昼夜颠倒、倾笼、夹尾7种刺激方法,每种方法使用4次,随机分布于4个应激周期中,制作PSD模型。
2.2 分组
实验大鼠在预养期间进行蔗糖水消耗实验和旷场试验行为评分,测定蔗糖水消耗实验和旷场试验的基线值,从中筛选出行为评分均一的大鼠,随机分为假手术组、卒中组、抑郁组、PSD组、阳性药组和百事乐加味高、低剂量组(高、低剂量组)。随机补充手术后死亡的大鼠和应激过程及实验过程中不可预料因素致死的大鼠,使每组最终达到8只以上。假手术组:给予假手术处理,除栓线不插入CCA外,其余操作同手术组;卒中组:制作局灶性脑缺血大脑MCAO模型,选择术后神经功能缺损评分>1分且<4分大鼠入组,每笼4只饲养;抑郁组:CUMS结合孤养法制备慢性应激抑郁模型;PSD组:MCAO模型术后恢复7 d加以孤养法结合CUMS法。
2.3 给药
除假手术组和卒中组,其余各组应激造模28 d,各组大鼠均于应激造模同时给药,假手术组、卒中组、抑郁组给予蒸馏水灌胃,高、低剂量组给予百事乐加味药液灌胃,阳性药组给予盐酸氟西汀+阿司匹林药液灌胃。给药体积均为10 mL/kg,每日1次。
2.4 指标检测
2.4.1 神经功能缺损评分
分别于分组前及应激后每周按照Longa分级法进行行为学评分:0分为无缺陷;1分为不能伸展对侧前肢;2分为对侧前肢屈曲;3分为轻度向对侧转圈;4分为严重向对侧转圈;5分为向对侧跌倒进行。观察各组神经功能缺损评分情况。
2.4.2 海马和前额叶皮层神经细胞形态观察
灌胃给药28 d后,取材前12 h禁食不禁水,10%水合氯醛腹腔注射麻醉,固定,腹主动脉采血处死大鼠,迅速以4%多聚甲醛心脏灌注固定,取大脑海马和前额叶皮层组织,经脱水、透明、浸蜡与包埋,将蜡块常规切片,HE、Nissl染色观察组织形态学变化。
2.4.3 海马和前额叶皮层细胞凋亡因子Bax、Bcl-2、Caspase-3检测
大鼠处死后,4%多聚甲醛固定,取大脑海马组织,经脱水、透明、浸蜡与包埋,将蜡块切片,脱蜡水化,抗体按1∶100稀释,滴加一抗,37 ℃显色1~2 h,DAB溶液显色,免疫组化检测细胞凋亡因子Bax、Bcl-2、Caspase-3的表达。
3 统计学方法
采用SPSS19.0统计软件进行分析。计量资料以x(—)±s表示,两组间比较用t检验,多组均数比较用方差分析。P<0.05表示差异有统计学意义。
4 结果
4.1 神经功能缺损评分结果
假手术组、抑郁组大鼠神经功能缺损评分基本为0分,表示无神经功能损伤或者不明显;单纯卒中组大鼠神经功能损伤随时间的延长,有一定自我修复作用,表现为神经功能缺损评分逐渐降低;大鼠行卒中手术后,慢性应激可加重卒中大鼠神经功能损伤,使神经功能缺损评分逐渐增加。与PSD组比较,高剂量组应激第14、21、28日神经功能缺损评分明显降低,差异有统计学意义(P<0.01,P<0.05);低剂量组应激第21、28日神经功能缺损评分明显降低,差异有统计学意义(P<0.01,P<0.05)。与卒中组比较,高剂量组应激第21、28日神经功能缺损评分明显降低,差异有统计学意义(P<0.01,P<0.05);低剂量组应激第28日神经功能缺损评分明显降低,差异有统计学意义(P<0.01,P<0.05)。结果见表1。
4.2 百事乐加味方对海马和前额叶皮层神经细胞病理形态的影响
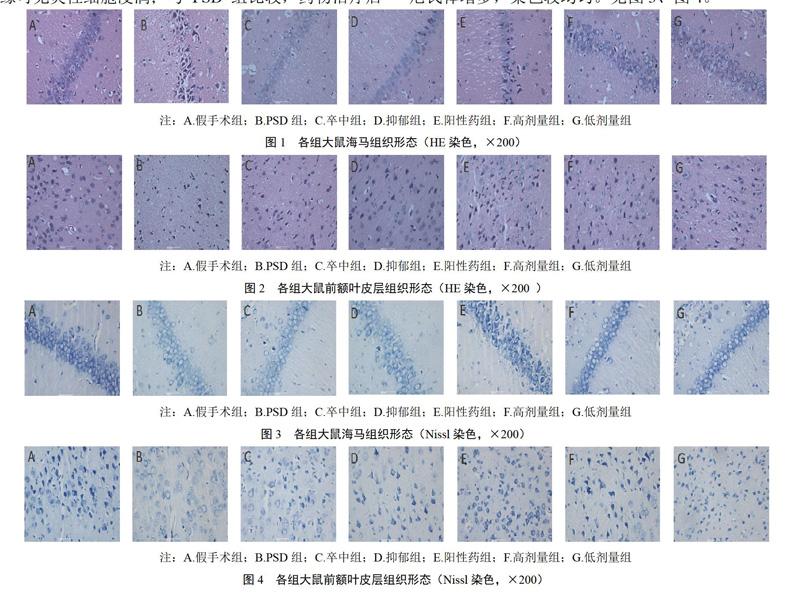
HE染色显示,假手术组大鼠海马和前额叶皮层组织细胞形态完整,排列紧密,胞核完整,核仁清晰,无水肿,未见明显坏死、炎细胞浸润等病理学改变;PSD组大鼠脑组织细胞结构模糊,核固缩,坏死灶边缘可见炎性细胞浸润;与PSD组比较,药物治疗后细胞变性、坏死等病理学改变明显改善。见图1、图2。Nissl染色显示,假手术组大鼠海马和前额叶皮层细胞排列规整,胞核清晰,尼氏体丰富,染色均匀。PSD组细胞损伤严重,细胞排列紊乱,尼氏体着色较浅,表达较低;与PSD组比较,各给药组大鼠海马和前额叶皮层细胞状态明显好转,细胞形态较完整,尼氏体增多,染色较均匀。见图3、图4。
4.3 百事乐加味方对海马和前额叶皮层细胞凋亡因子Bcl-2、Bax、Caspase-3表达的影响
与假手术组比较,PSD组大鼠大鼠海马和前额叶皮层组织Bcl-2表达水平明显下降,Bax、Caspase-3表达水平明显上升,Bcl-2/Bax比值明显降低,差异均有统计学意义(P<0.01);与PSD组比较,高剂量组大鼠海马和前额叶皮层组织Bcl-2表达明显升高,Bax、Caspase-3表达明显降低,Bcl-2/Bax比值明显增加(P<0.01,P<0.05),低剂量组大鼠Bcl-2表达水平明显升高,Caspase-3表达水平明显降低,Bcl-2/Bax比值明显增大(P<0.01,P<0.05);低剂量组大鼠海马组织Bax表达水平明显降低(P<0.05);低剂量组大鼠前额叶皮层组织Bax表达水平降低,但差异无统计学意义(P>0.05)。
与卒中组比较,高、低剂量组大鼠海马和前額叶皮层组织Bcl-2表达水平明显升高,Caspase-3表达水平明显降低,Bcl-2/Bax比值明显增大(P<0.01,P<0.05);高、低剂量组对大鼠海马和前额叶皮层组织Bax表达影响不显著,差异无统计学意义(P>0.05)。
与抑郁组比较,高剂量组大鼠海马和前额叶皮层组织Bcl-2表达明显升高,Caspase-3表达明显降低,Bcl-2/Bax比值明显增大(P<0.01,P<0.05);高剂量组对大鼠海马和前额叶皮层组织Bax表达影响不显著(P>0.05);低剂量组大鼠海马和前额叶皮层组织Bcl-2表达明显升高(P<0.05);低剂量组大鼠海马和前额叶皮层组织Bax、Caspase-3表达及Bcl-2/Bax比值差异无统计学意义(P>0.05)。见图5~图10和表2、表3。
5 讨论
细胞凋亡是一种生理性、程序性的细胞死亡,正常情况下对机体有益,病理刺激下则造成损伤,尤其在脑部。脑卒中后缺血、缺氧导致脑内自由基、谷氨酸等异常增多,诱导细胞凋亡。细胞凋亡在脑缺血神经损伤的发生发展过程中起着重要作用,是缺血性脑卒中致死、致残重要机制[3]。神经细胞凋亡和坏死也是抑郁症主要的病理过程之一,凋亡引起海马、皮层等脑区神经细胞功能和结构损伤,导致突触功能障碍,产生抑郁。通过抑制凋亡,可以明显改善神经功能,是防治抑郁症状的重要途径和研究热点[4]。从抑制细胞凋亡方面探讨抗抑郁作用机制是目前研究的热点之一。戢运建等[5]研究发现,PSD患者血清Bax、Fasl、Fas、Caspase-3表达显著升高,经药物治疗后,以上凋亡因子表达降低,抑郁明显改善,表明PSD发病与细胞凋亡密切相关。樊蔚虹等[6]研究表明,PSD大鼠模型海马组织Bax蛋白表达升高,Bcl-2蛋白表达下降,柴胡疏肝散通过调节Bax、Bcl-2蛋白表达,进而改善PSD大鼠抑郁状态。研究表明,脑源性神经营养因子(BDNF)参与神经细胞凋亡途径抗抑郁作用,通过抑制抑郁模型大鼠的海马神经元凋亡,可促进BDNF的表达,保护神经元细胞,改善抑郁症状[7]。邓海峰等[8]研究表明,毛蕊花糖苷治疗可明显降低抑郁模型大鼠前额叶皮层Caspase-3酶活性,从而降低细胞神经元细胞凋亡程度,发挥抗抑郁效应。本课题组前期研究发现,百事乐加味方可通过上调PSD大鼠海马、前额叶皮层BDNF的表达,发挥明显抗抑郁作用[9]。因此,在已有基础上,本研究从细胞凋亡途径,进一步深入探讨海马、前额叶皮层组织凋亡相关蛋白在PSD大鼠中的作用特点及机制。
海马是脑内重要边缘系统结构之一,抑郁症发病机制与海马区域神经细胞的萎缩和坏死密切相关。前额叶皮层与海马组成大脑结构中应对慢性应激的重要环路,是抑郁症防治的重要脑区。临床和实验研究表明,长期应激使前额叶神经网络的功能和结构缺陷,突触传递障碍,是导致抑郁症的情绪和认知异常的病理生理基础[10]。有研究表明,抑郁症患者和动物模型海马、前额叶皮层结构和功能改变,形状萎缩[11]。蛋白质组学研究发现,PSD前后大鼠海马、前额叶皮层参与神经细胞骨架重构和能量代谢蛋白质变化是不同的,海马有46个差异蛋白,其中22个蛋白向下调节[12]。海马、前额叶皮层等同时参与了PSD的病理生理过程。因此,仅着重于海马或其他单个解剖结构进行研究并不能准确把握其规律,开展海马、前额叶皮层等多个结构或环路研究并阐明结构、功能及分子机制已成为趋势。
线粒体凋亡途径是公认的细胞凋亡中心环节,Bcl-2家族蛋白是线粒体凋亡途径中的主要调控蛋白,Bcl-2家族蛋白中Bcl-2是最重要的抗凋亡蛋白,而Bax是最重要的促凋亡蛋白[13]。Bcl-2家族蛋白抗凋亡主要调节Cyt-c调节凋亡,Bcl-2可抑制Cyt-c的释放及Caspase的激活而抑制凋亡;Bax可诱导Cyt-c的释放和激活Caspase-3蛋白酶,引起细胞凋亡。Bcl-2/Bax比值直接反映细胞凋亡,提高Bcl-2/Bax比值则抑制凋亡,相反,降低则促进凋亡。本研究发现,与假手术组比较,PSD组大鼠海马和前额叶皮层组织Bcl-2表达水平明显下降,Bax、Caspase-3表达水平明显上升,Bcl-2/Bax比值明显减小。表明经MCAO+CUMS造模后,PSD大鼠脑内细胞凋亡发生异常是导致神经功能障碍主要机制之一。百事乐加味方由姜黄、柴胡、川芎等中药组成。现代药理研究表明,姜黄素为抗抑郁治疗的有效成分,姜黄素能有效减轻应激性损伤过氧化氢诱导皮层神经细胞凋亡过程[14]。柴胡皂苷A具有显著抗抑郁作用,其主要机制与其促进海马区BDNF活性和表达,进而减少神经细胞凋亡有关[15]。川芎嗪可治疗脑缺血导致神经功能损伤,其主要机制为调控Bcl-2/Bax表达,抑制神经细胞凋亡[16]。
本实验通过行为学、病理学和分子生物学检测方法确证,百事乐加味方可影响PSD大鼠细胞凋亡相关因子,通过增加海马、前额叶皮层组织抗凋亡因子Bcl-2表达,减少凋亡因子Bax、Caspase-3表达,增大Bcl-2/Bax比值,发挥抗神经元细胞凋亡作用,改善大鼠行为学指标和神经功能评分,从而产生较好的抗抑郁作用,并有一定的量效关系。本课题组今后的研究将对细胞凋亡蛋白的调控信号通路进行分析,并进一步通过多种途径和方法探究百事乐加味方抗神经元细胞凋亡作用机制。
综上,百事乐加味方抗神经细胞凋亡药理作用是其防治PSD主要机制之一。通过调控海马、前额叶皮层组织Bcl-2、Bax、Caspase-3蛋白表达,抑制神经细胞凋亡,减少神经病变,改善神经功能,具有较好的抗PSD作用。本研究可为该方的临床使用和基础研究提供依据。
参考文献:
[1] IFFERGANE G, BOYKO M, FRANK D, et al. Biological and behavioral patterns of post-stroke depression in rats[J]. Can J Neurol Sci, 2018,8:1-11.
[2] 刘林,刘羽,廖亮英,等.百事乐加味方抗抑郁作用的实验研究[J].中华中医药学刊,2016,34(2):317-319.
[3] SUN R, SONG Y, LI S, et al. Levo-tetrahydropalmatine attenuates neuron apoptosis induced by cerebral ischemia-reperfusion injury:Involvement of c-Abl activation[J]. J Mol Neurosci,2018,65(3):391- 399.
[4] 程瑞凤,华冰,景晶,等.甘草总黄酮抗大鼠应激抑郁行为作用及对海马脑区神经细胞凋亡调控相关蛋白表达的影响[J].中药药理与临床, 2014,30(2):69-72.
[5] 戢运建,况娥.脑卒中后抑郁患者血清TSH含量与神经递质、神经营养状态及神经细胞凋亡的关系[J].海南医学院学报,2017,23(9):1276-1283.
[6] 樊蔚虹,姚建平,赵文景.柴胡疏肝散对卒中后抑郁大鼠海马组织Bcl-2,Bax蛋白表达的影响[J].中国实验方剂学杂志,2011,17(3):181- 183.
[7] HUANG X, MAO Y S, LI C, et al. Venlafaxine inhibits apoptosis of hippocampal neurons by up-regulating brain-derived neurotrophic factor in a rat depression model[J]. Pharmazie,2014,69(12):909- 916.
[8] 邓海峰,孙缦利,陈浩,等.毛蕊花糖苷对抑郁症大鼠行为学和前额叶皮层内质网应激的影响[J].中国病理生理杂志,2018,34(1):101-106.
[9] 刘林,杨蕙,刘羽,等.百事乐加味方对卒中后抑郁大鼠海马-前额叶皮层环路形态及BDNF影响的实验研究[J].中华中医药杂志,2016,31(4):1398-1401.
[10] CZEH B, VARDYA I, VARGA Z. Long-term stress disrupts the structural and functional integrity of GABAergic neuronal networks in the medial prefrontal cortex of rats[J]. Front Cell Neurosci,2018,12:148.
[11] LICZNERSKI P, DUMAN R S. Remodeling of axo-spinous synapses in the pathoph ysiology and treatment of depression[J]. Neuroscience,2013,251:33-50.
[12] PAN J, LIU H, ZHOU J, et al. Ipsilateral hippocmpal proteomics reveals mitochondrial antioxidative stress impairment incortical-lesioned chronicmild stressed rats[J]. Curr Mol Med, 2014,14(9):1186-1196.
[13] BONNEAU B, PRUDENT J, Popqeorgiev N, et al. Non-aptotic roles of Bcl-2 family:the calcium connection[J]. Biochim Biophys Acta,2013,1833(7):1755-1765.
[14] 孫贤辉,梁华兵,周爽,等.姜黄素减轻过氧化氢诱导皮层神经细胞凋亡的JAK信号通路机制研究[J].临床和实验医学杂志,2018,17(14):1489-1493.
[15] 董海影,张静艳,柏青杨,等.柴胡皂苷A对抑郁模型大鼠海马神经细胞凋亡的保护作用[J].中国老年学杂志,2015,35(7):1935-1937.
[16] 孙斯琪,李琳,储利胜,等.川芎嗪预处理骨髓间充质干细胞移植对脑缺血大鼠神经细胞凋亡的影响[J].中华中医药杂志,2017,32(3):1259- 1262.
(收稿日期:2018-07-18)
(修回日期:2018-08-01;编辑:华强)
