人参三七川芎提取物对高糖高脂诱导的衰老血管内皮细胞自噬的影响
2019-04-25王雪方靖漪杨静修成奎雷燕
王雪 方靖漪 杨静 修成奎 雷燕
摘要:目的 观察人参三七川芎提取物对血管内皮细胞自噬流的影响,探讨其延缓高糖高脂诱导血管内皮细胞衰老的作用机制。方法 采用40 mmol/L葡萄糖和100 μmol/L棕榈酸钠造模,实验分为空白对照组、衰老模型组和中药组(200 mg/L),干预48 h。采用CCK-8检测细胞增殖能力;β-半乳糖苷酶染色检测细胞衰老程度;Western blot检测细胞p16、p21、微管相关蛋白1轻链3-Ⅱ(LC3B-Ⅱ)和p62蛋白表达;免疫荧光检测自噬流变化。结果 与空白对照组比较,衰老模型组细胞增殖能力和LC3B-Ⅱ表达降低,β-半乳糖苷酶蓝染细胞数量和p16、p21、p62蛋白表达增加,并存在自噬流阻滞;与衰老模型组比较,中药组细胞增殖能力增强, LC3B-Ⅱ表达升高,β-半乳糖苷酶蓝染细胞数量减少,p16、p21和p62表达降低,自噬流畅通。结论 人参三七川芎提取物可延缓高糖高脂引起的血管内皮细胞衰老,其机制可能与增强细胞自噬活性有关。
关键词:人参三七川芎提取物;血管内皮细胞;细胞衰老;自噬
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2019)04-0052-05
2型糖尿病(type 2 diabetes,T2DM)目前已成为严重威胁人类健康的疾病之一[1],其中大血管并发症在其各种并发症中约占75%,是T2DM患者致残致死的主要原因[2]。研究表明,血管内皮功能紊乱是T2DM大血管并发症的病理基础,而血管内皮细胞衰老在内皮功能紊乱过程中发挥关键作用[3-4]。细胞自噬是一种不同于细胞凋亡的程序性死亡,可将细胞内受损细胞器、生物大分子等结构通过溶酶体降解,实现自我保护及维持稳态,自噬缺陷与癌症、神经退行性变、炎症和代谢性疾病密切相关[5]。机体衰老过程中自噬活性逐渐衰减,在复制性和诱导性衰老的细胞中,通过不同途径适当上调自噬具有一定延缓细胞衰老的作用[6-8]。
本课题组前期研究发现,益气活血中药人参、三七、川芎能调节复制性衰老的微血管内皮细胞的自噬水平[9],但在高糖高脂诱导的衰老大血管内皮细胞中是否也有同样的调节作用,目前尚未见报道。因此,本研究以高糖高脂诱导的人主动脉内皮细胞衰老为模型,观察人参三七川芎提取物对细胞自噬的干预作用,为其临床应用提供依据。
1 实验材料
1.1 药物
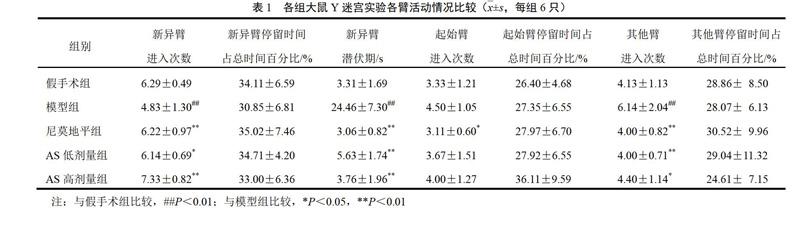
人参、三七、川芎合剂冻干粉,北京因科瑞斯医药科技公司制备提供。药物为道地药材,人参产自吉林,三七产自云南,川芎产自四川,按2∶3∶4比例破碎成粗粉,乙醇回收提取,过滤后弃药渣,醇提液回收至无醇味浓缩液,继续浓缩至稠膏状,再经干燥至干膏,最终每1 g冻干粉相当于原药材4.286 g,使用时以DPBS配制成10 g/L的贮存液,以0.22 μm滤器过滤分装,置于-20 ℃冰箱保存。依据药典对人参三七川芎提取物中指标性成分阿魏酸、三七皂苷R1、人参皂苷Rg1、人参皂苷Re和人参皂苷Rb1进行HPLC分析[10]。
1.2 细胞
人主动脉内皮细胞(HAEC),美国Sciencell公司,并提供细胞鑒定书。
1.3 试剂
内皮细胞培养基、胎牛血清、内皮细胞生长因子、青霉素/链霉素溶液、胰酶消化液、细胞冻存液,美国Sciencell公司,批号分别为1001、0025、1052、0503、
0103、0133;CCK-8细胞增殖-毒性检测试剂盒,日本同仁化学研究所,批号LG615;细胞衰老β-半乳糖苷酶检测试剂盒,上海碧云天生物技术有限公司,批号C0602;p21兔单克隆抗体,p16兔单克隆抗体,LC3B兔单克隆抗体、p62小鼠单克隆抗体,英国Abcam公司,批号分别为ab109199、ab51243、ab192890、ab56416;辣根酶标记山羊抗兔/山羊抗小鼠IgG(H+L),北京中杉金桥生物技术有限公司,批号ZB-2301、ZB-2305;巴弗罗霉素,美国MCE公司,批号88899-55-2;自噬腺病毒载体系统Ad-mRFP- GFP-LC3,汉恒生物科技(上海)有限公司;D-葡萄糖、棕榈酸钠美国Sigma公司,批号分别为SLBR0902V、SLBV2022;无脂肪酸BSA(d-BSA),北京索莱宝公司,批号1206F052。棕榈酸钠溶于PBS(95 ℃助溶)配成20 mmol/L溶液,将d-BSA按质量/体积溶于DPBS(55 ℃助溶)配成20%d-BSA溶液,将棕榈酸钠趁热加入到等体积的d-BSA中,配成10 mmol/L棕榈酸钠(含10%d-BSA)贮存液,4 ℃冰箱保存备用。
1.4 仪器
AE2000型倒置相差显微镜及成像系统(中国麦克奥迪实业集团有限公司),Forma 370型细胞培养箱(美国Thermo公司),Synergy H1型全自动酶标仪(美国Bio Tek公司),FV1000型激光共聚焦显微镜(日本Olympus公司),Mini-PROTEAN Tetra Cell型电泳槽系统,PowerPac universal power supply型通用电泳仪电源,Trans-blot sp cell型半干转印槽(美国Bio-Rad公司)。
2 实验方法
2.1 细胞培养
HAECs培养于含5%胎牛血清、内皮生长因子、青霉素(100 U/L)/链霉素(100 mg/L)的完全培养基,于饱和5%CO2培养箱37 ℃培养,至细胞密度为80%~90%,按照1∶2或1∶3传代培养。根据前期实验结果,本实验采用40 mmol/L D-葡萄糖联合100 μmol/L棕榈酸钠诱导HAEC细胞衰老[11]。实验分为空白对照组、葡萄糖/棕榈酸诱导的衰老模型组和人参三七川芎提取物干预的中药组。
2.2 CCK-8检测细胞增殖活力
细胞5×103个/孔接种于96孔板,每组设立6个复孔,待细胞贴壁后,每组进行相应的处理,药物作用指定时间后,将孔板中原液体吸出,向每孔内加入用基础培养基稀释成含10%CCK-8试剂液,置于37 ℃培养箱中孵育2~3 h,于酶标仪450 nm波长处检测吸光值。
2.3 细胞衰老β-半乳糖苷酶染色
待测细胞以2×104个/孔接种于24孔板中,细胞贴壁后,吸除细胞培养液,DPBS洗涤1次,每孔加250 μL β-半乳糖苷酶染色固定液,室温固定15 min,吸除细胞固定液,DPBS洗涤细胞3次,每孔加250 μL染色工作液,置于无CO2、37 ℃培养箱中孵育过夜。倒置光学显微镜下观察并计数,计算蓝染细胞数量占视野内总细胞量的比例。
2.4 Ad-mRFP-GFP-LC3检测自噬流
将状态良好的HAECs接种于激光共聚焦显微镜专用培养皿,贴壁24 h后取Ad-mRFP-GFP-LC3腺病毒(病毒滴度为1×107 PFU/mL)在冰上溶解,使用完全培养基按感染复数(MOI)=300稀释,处理4 h后换成新鲜完全培养基,置于5%CO2培养箱37 ℃培养过夜。根据实验分组干预48 h后置于荧光共聚焦显微镜下观察细胞内自噬体的形成情况[12]。
2.5 Western blot检测微管相关蛋白1轻链3-Ⅱ、p16、p21及p62蛋白表达
按RIPA蛋白抽提试剂说明提取各组总蛋白,经BCA法测定蛋白含量后调整蛋白浓度,加5×loading buffer,99 ℃变性10 min;8%~12%SDS- PAGE电泳,半干转印至PVDF膜,5%脱脂奶粉封闭1 h,1∶2000稀释一抗,4 ℃过夜;TBST清洗3次×5 min,1∶3000稀释二抗后室温孵育1 h;TBST清洗3次×5 min,ECL显示目的条带。采用Image Lab图像分析系统对条带灰度值进行分析,并以β-actin为内参照。
3 统计学方法
采用SPSS17.0统计软件进行分析。实验数据以x(—)±s表示,多组样本采用方差分析,若方差齐用LSD法进行两两比较;若方差不齐则用Dunnett's法分析。P<0.05表示差异有统计学意义。
4 结果
4.1 人参三七川芎提取物中主要成分含量
经HPLC检测,人参三七川芎提取物中5种主要成分含量见表1。
4.2 人参三七川芎提取物对细胞增殖能力的影响
与空白对照组比较,高糖高脂干预48 h可明显抑制HAECs的增殖;与衰老模型组比较,25~200 mg/L人参三七川芎提取物可明显促进细胞的增殖能力,并呈浓度依赖性。但随着提取物浓度的进一步增加,细胞的增殖能力下降,其中800、1000 mg/L剂量组对细胞有明显的抑制作用。由此确定中药最佳干预剂量为200 mg/L,后续中药组浓度选用该剂量进行实验。结果见图1。
4.3 人参三七川芎提取物对细胞衰老β-半乳糖苷酶染色的影響
衰老模型组β-半乳糖苷酶蓝染比例较空白对照组明显增加(P<0.05);200 mg/L人参三七川芎提取物处理后β-半乳糖苷酶蓝染阳性比例明显降低,差异有统计学意义(P<0.01)。结果见图2、表2。
空白对照组 衰老模型组 中药组
4.4 人参三七川芎提取物对细胞衰老相关蛋白p16、p21的影响
与空白对照组比较,衰老模型组HAECs p16、p21蛋白表达明显升高,差异有统计学意义(P<0.05,P<0.01);与衰老模型组比较,中药组HAECs p16、p21蛋白表达显著下降,差异有统计学意义(P<0.05,P<0.01)。结果见图3。
4.5 人参三七川芎提取物对自噬相关蛋白微管相关蛋白1轻链3-Ⅱ、p62的影响
与空白对照组比较,衰老模型组自噬相关蛋白LC3B-Ⅱ表达降低,p62表达明显升高,差异有统计学意义(P<0.05);与衰老模型组比较,中药组自噬相关蛋白LC3B-Ⅱ表达明显升高,p62显著下调,差异有统计学意义(P<0.05)。结果见图4。
4.6 人参三七川芎提取物对细胞自噬流的影响
将感染mRFP-GFP-LC3双荧光标记腺病毒细胞进行分组刺激,mRFP(红色荧光)用于标记及追踪LC3蛋白,溶酶体内部环境为酸性,当自噬小体与溶酶体融合,对酸性环境敏感的GFP(绿色荧光)淬灭。因此,红绿荧光Merge后,GFP+RFP+为黄色斑点,即为自噬体,GFP-RFP+为红色斑点,即自噬溶酶体,红/黄色斑点数目多少,可清晰判断出自噬流的强弱及自噬流通畅与否。与空白对照组比较,衰老模型组黄斑点和红斑点数量均减少,表明自噬虽增强,而自噬流不通畅;与衰老模型组比较,人参三七川芎提取物干预均可明显增加黄、红斑点的数量,尤其是红色斑点,表明自噬流通畅。结果见图5。
5 讨论
自噬是细胞内一种“自食”现象,细胞利用溶酶体降解自身受损蛋白质、衰老或损伤的细胞器等细胞结构,从而保证细胞能量代谢和新旧细胞器更迭的顺利进行[13]。自噬相关蛋白LC3Ⅱ的表达能敏感反映自噬状态,当自噬小体形成时,胞浆型蛋白LC3Ⅰ经酶解转变为LC3Ⅱ,并被募集定位在自噬体膜上,其水平在一定程度上反映了自噬体数量和自噬程度。自噬标记蛋白p62是多泛素化结合蛋白,自噬发生时p62作为自噬底物蛋白,参与自噬的过程并在自噬溶酶体中降解,因此,p62蛋白水平与自噬活性成反比,可反映自噬反应的强弱[14]。
细胞自噬与细胞衰老关系密切。在衰老过程中,细胞可通过启动自噬,清除受损的生物大分子和功能异常的线粒体等,避免损伤的累积,维持细胞形态正常和功能的稳定,延长细胞寿命[15-16]。但糖尿病患者长期处于糖脂代谢紊乱状态,高糖和高脂环境通过抑制ULK1磷酸化、自噬小体形成和溶酶体降解等环节,下调血管内皮细胞自噬水平[17-18],这可能是导致血管内皮细胞进入衰老期,造成血管内皮完整性丧失和功能紊乱,促进血管并发症形成的机制之一[19-20]。
中医理论认为,气血是构成人体的最基本物质,“以奉生身,莫贵于此”,是脏腑经络等组织器官进行生理活动的物质基础,而气虚血瘀是人体衰老的主要病机。人参、三七、川芎三药联用有益气活血、通脉活络、延年益寿的功效。本研究采用人参三七川芎提取物干预高糖高脂处理的HAEC后,发现人参三七川芎提取物可促进细胞增殖,减少β-半乳糖苷酶蓝染细胞数量,并降低p16和p21表达水平,表明人参三七川芎提取物能有效延缓高糖高脂诱导的内皮细胞衰老。
进一步对细胞自噬机制研究发现,中药组既可增加LC3B-Ⅱ表達,也可降低p62水平,表明人参三七川芎提取物能增强衰老内皮细胞的自噬活性,诱导细胞自噬的发生。自噬是一个细胞内的动态过程,即“自噬流”,细胞内自噬体的增加既可能由于自噬小体形成的增加,也可能由于自噬小体降解的减少[21]。为明确人参三七川芎提取物作用于整个“自噬流”的环节,本研究利用mRFP-GFP-LC3双荧光标记腺病毒作为研究工具,发现在高糖高脂诱导的衰老细胞中,自噬流阻滞于下游自噬溶酶体的降解,表明其自噬活性的增强源于自噬流不通畅;而人参三七川芎提取物干预可明显增加黄、红斑点的数量,尤其是红色斑点,表明可促进自噬流通畅,中药组自噬活性增强是通过促进自噬小体的形成阶段从而促进整个细胞“自噬流”的顺利进行。
综上,本研究发现人参三七川芎提取物能通过调节细胞自噬延缓高糖高脂引起的血管内皮细胞衰老,可为减少糖尿病大血管并发症提供一定的借鉴和参考。然而,人参三七川芎提取物通过哪些具体分子信号通路增强自噬而延缓细胞衰老、其间内在联系是什么、如何保证自噬的平衡状态既可诱导又不至于过度等,这些问题在本研究中尚未涉及,需要今后进一步深入研究。
参考文献:
[1] GUARIGUATA L, WHITING D R, HAMBLETON I, et al. Global estimates of diabetes prevalence for 2013 and projections for 2035[J]. Diabetes Res Clin Pract,2014,103(2):137-149.
[2] DAVIES M J, TRINGHAM J R, TROUGHTON J, et al. Prevention of type2 diabetes mellitus. A review of the evidence and its application in a UK setting[J]. Diabetic Medicine,2004,21(5):403-414.
[3] LIAO P, YANG D, LIU D, et al. GLP-1 and ghrelin attenuate high glucose/high lipid-induced apoptosis and senescence of human microvascular endothelial cells[J]. Cellular Physiology & Biochemistry International Journal of Experimental Cellular Physiology Biochemistry & Pharmacology,2017,44(5):1842.
[4] HAYASHI T, MATSUIHIRAI H, MIYAZAKIAKITA A, et al. Endothelial cellular senescence is inhibited by nitric oxide:implications in atherosclerosis associated with menopause and diabetes[J]. Proc Natl Acad Sci USA,2006,103(45):17018-17023.
[5] LEVINE E, PACKER M, CODOGNO P. Development of autophagy inducers in clinical medicine[J]. Journal of Clinical Investigation,2015, 125(1):14-24.
[6] 蔡世忠,王亚平.细胞衰老与细胞自噬的生物学关联及其意义[J].生命科学,2011,23(4):335-341.
[7] HARRISON D E, STRONG R, SHARP Z D, et al. Rapamycin fed late in life extends lifespan in genetically heterogeneous mice[J]. Nature,2009,460:392-395.
[8] MADEO F, TAVERNARAKIS N, KROEMER G. Can autophagy promote longevity?[J]. Nat Cell Biol,2010,12(9):842-846.
[9] 王强,修成奎,杨静,等.人参三七川芎醇提物对衰老人心脏微血管内皮细胞自噬的影响[J].中医杂志,2017,58(6):516-519.
[10] 修成奎,雷燕,王强,等.自然衰老大鼠血管老化中细胞骨架的改变及人参三七川芎提取物的干预作用[J].中国中西医结合杂志,2017,37(8):968-972.
[11] 王雪,修成奎,杨静,等.人参-三七-川芎提取物对高糖高脂诱导血管内皮细胞衰老的影响[J].中国实验方剂学杂志,2019,25(1):124-129.
[12] 范芳,陈娇,徐勇,等.高糖通过调控FBW7表达影响自噬的研究[J]. 中国糖尿病杂志,2017,25(6):546-551.
[13] MIZUSHIMA N, LEVINE B, CUERVO A M, et al. Autophagy fights disease through cellular self-digestion[J]. Nature,2008,451:1069.
[14] KLIONSKY D J, ABDELMOHSEN K, ABE A, et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition)[J]. Autophagy,2016,12(1):1-222.
[15] MARTINEZLOPEZ N, ATHONVARANGKUL D, SINGH R. Autophagy and Aging[J]. Advances in Experimental Medicine & Biology,2015,847:73.
[16] HO T T, WARR M R, ADELMAN E R, et al. Autophagy maintains the metabolism and function of young and old stem cells[J]. Nature, 2017,543(7644):205-210.
[17] CHEN F, CHEN B, XIAO F Q, et al. Autophagy protects against senescence and apoptosis via the RAS-mitochondria in high- glucose-induced endothelial Cells[J]. Cellular Physiology & Biochemistry,2014,33(4):1058-1074.
[18] WEIKEL K A, CACICEDO J M, RUDERMAN N B, et al. Glucose and palmitate uncouple AMPK from autophagy in human aortic endothelial cells[J]. American Journal of Physiology Cell Physiology,2015,308(3):249-263.
[19] YOKOI T, FUKUO K, YASUDA O, et al. Apoptosis signal-regulating kinase 1 mediates cellular senescence induced by high glucose in endothelial cells[J]. Diabetes,2006,55(6):1660-1665.
[20] VOGHEL G, THORINTRESCASES N, FARHAT N, et al. Cellular senescence in endothelial cells from atherosclerotic patients is accelerated by oxidative stress associated with cardiovascular risk factors[J]. Mechanisms of Ageing & Development,2007,128(11):662-671.
[21] ZHANG Y, XU X, RRE J. MTOR overactivation and interrupted autophagy flux in obese hearts:a dicey assembly?[J]. Autophagy, 2013,9(6):939-941.
(收稿日期:2018-10-28)
(修回日期:2019-02-14;編辑:华强)
