Ki67、MCM2、ERCC1和FLI-1在恶性腹膜间皮瘤中的表达及其与预后的关系*
2019-04-25梁育飞郑国启李春英孙宁宁郭忠建
梁育飞,郑国启△,李春英,孙宁宁,郭忠建
(沧州市中心医院:1.消化内科;2.病理科,河北沧州 061001)
恶性腹膜间皮瘤(malignant peritoneal mesothelioma,MPeM)是发生于腹膜间皮组织的恶性肿瘤,发病率低,易被漏诊或误诊[1]。该病以40~70岁多见,男女比例约2∶1,临床表现缺乏特异性。组织病理学及免疫组织化学染色在间皮瘤的诊断中占有重要地位[2],该病病死率高,预后差。因此,寻找预后影响因素已成为目前研究的热点。Ki67、微型染色体维持蛋白2(minichromosome maintenance protein 2,MCM2)、核苷酸切除修复交叉互补因子-1(excision repair cross complementing group 1,ERCC1)、FLI-1、血管内皮生长因子受体-3(vascularendothelial growth factor receptor 3,VEGFR-3)、程序性死亡受体-配体1(programmed death ligand 1,PD-L1)和绒毛蛋白Villin通过促进细胞分化增殖及抑制细胞凋亡等不同途径在肿瘤细胞的发生、发展、侵袭及转移等过程中发挥着重要作用。本研究应用免疫组织化学SP法检测以上7种标记物在MPeM组织中的表达,分析其与临床病理特征的关系,探讨这些标记物与临床病理因素对预后判断的价值,为临床治疗提供参考。
1 资料与方法
1.1一般资料 经本院医学伦理委员会批准(伦理号:2012-012-01),收集2013年1月至2016年12月在本院经B型超声引导下穿刺活检或手术获取的14例患者非上皮型MPeM组织石蜡标本,并收集同期30例患者上皮型MPeM组织石蜡标本。所有患者均为初诊病例并且资料完整。标本切片均经两名有经验的病理科医师阅片后确诊,MPeM病理诊断符合2012年美国《间皮瘤病理学诊断指南》[2]。患者年龄42~84岁,平均(62.86±10.89)岁,男15例、女29例。临床TNM分期[3]:Ⅰ期,肿瘤局限于腹膜;Ⅱ期,肿瘤侵犯腹腔内淋巴结;Ⅲ期,肿瘤向腹腔外淋巴结转移;Ⅳ期,远处血行转移。Ⅰ+Ⅱ期患者34例,Ⅲ+Ⅳ期患者10例。
1.2主要试剂 鼠抗人Ki-67单克隆抗体(克隆号:MIB-1),兔抗人微小染色体维持蛋白2克隆抗体(克隆号:EP-40),鼠抗人ERCC1单克隆抗体(克隆号:UMAB8),鼠抗人FLI-1单克隆抗体(克隆号:MRQ-1),鼠抗人血管内皮生长因子受体-3单克隆抗体(克隆号:KLT9),鼠抗人PD-L1单克隆抗体(克隆号:UMAB-228),鼠抗人Villin单克隆抗体(克隆号:OTI3B3),均购自中国北京中杉生物技术有限公司,严格按照说明书操作。
1.3方法
1.3.1免疫组织化学检测及判定标准 全部腹膜组织标本在同一条件下采用免疫组织化学染色SP法。经10%中性甲醛固定,常规石蜡包埋并切片,切片厚度4 μm,常规二甲苯脱蜡,梯度酒精脱水,加入一抗,经孵育过夜后,滴加生物素标记二抗,二氨基联苯胺(DAB)显色,苏木素对比复染,常规脱水、透明、干燥、中性树胶封片。每张切片随机取3个高倍视野,以阳性细胞比例的平均值定义为该肿瘤的阳性细胞百分比。Ki67阳性细胞多数为核着色,呈棕黄色,少数为较弱的细胞质染色;MCM2、ERCC1和FLI-1阳性表达主要定位于细胞核,表现为细胞核内有棕黄色到深褐色颗粒;VEGFR-3阳性表达主要定位于细胞膜或细胞质,呈棕黄色至棕褐色颗粒;PD-L1和Villin均以细胞质呈棕黄色至棕褐色为阳性。阳性染色细胞百分比小于5%,判为“-”;5%~<26%判为“+”;26%~50%判为“++”,>50%判为“+++”。
1.3.2随访 生存期以病理诊断证实为MPeM的日期为起点,随访至2017年6月,以月为单位,至随访终点仍生存作为截尾值处理。全组无失访病例。
1.4统计学处理 应用SPSS19.0统计软件进行统计分析。计数资料以例数或百分比表示,比较采用χ2检验及Fisher精确概率法。相关性分析采用Spearman等级分析。单因素生存分析比较采用Kaplan-Meier法,时序检验(Log-rank法)比较其差异,多因素生存分析采用Cox比例风险模型。以P<0.05为差异有统计学意义。
2 结 果
2.1标记物在MPeM组织中的表达 在44例MPeM中,MCM2阳性率最高,为100.0%;其次为FLI-1,阳性表达者42例,阳性率为95.4%;ERCC1阳性表达者31例,阳性率为70.4%;Ki67阳性表达者21例,阳性率为47.7%;VEGFR-3、Villin、PD-L1的阳性率分别为18.2%、15.9%、6.8%。见图1。

表1 MPeM各标记物与临床病理学的关系(n)
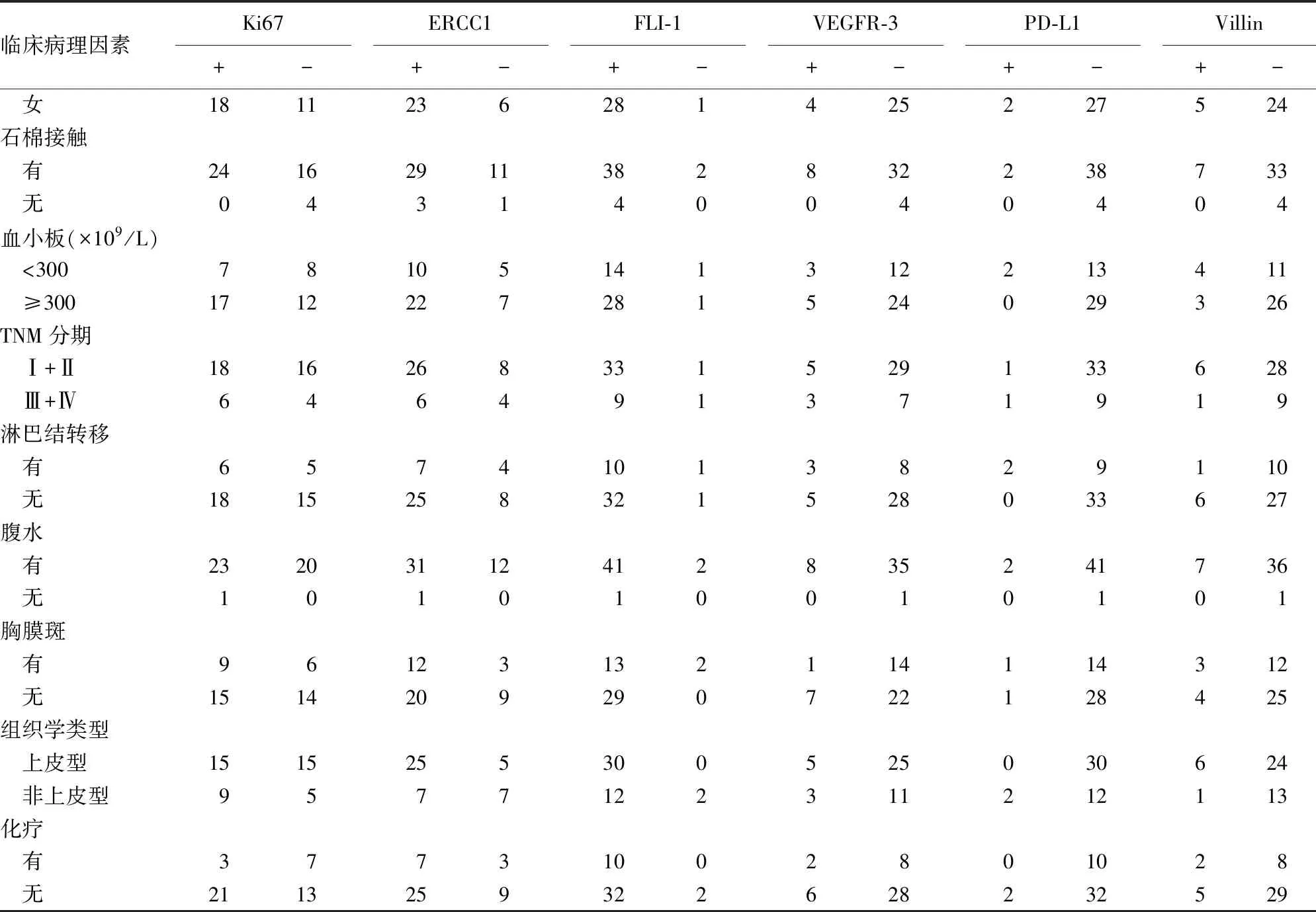
续表1 MPeM各标记物与临床病理学的关系(n)
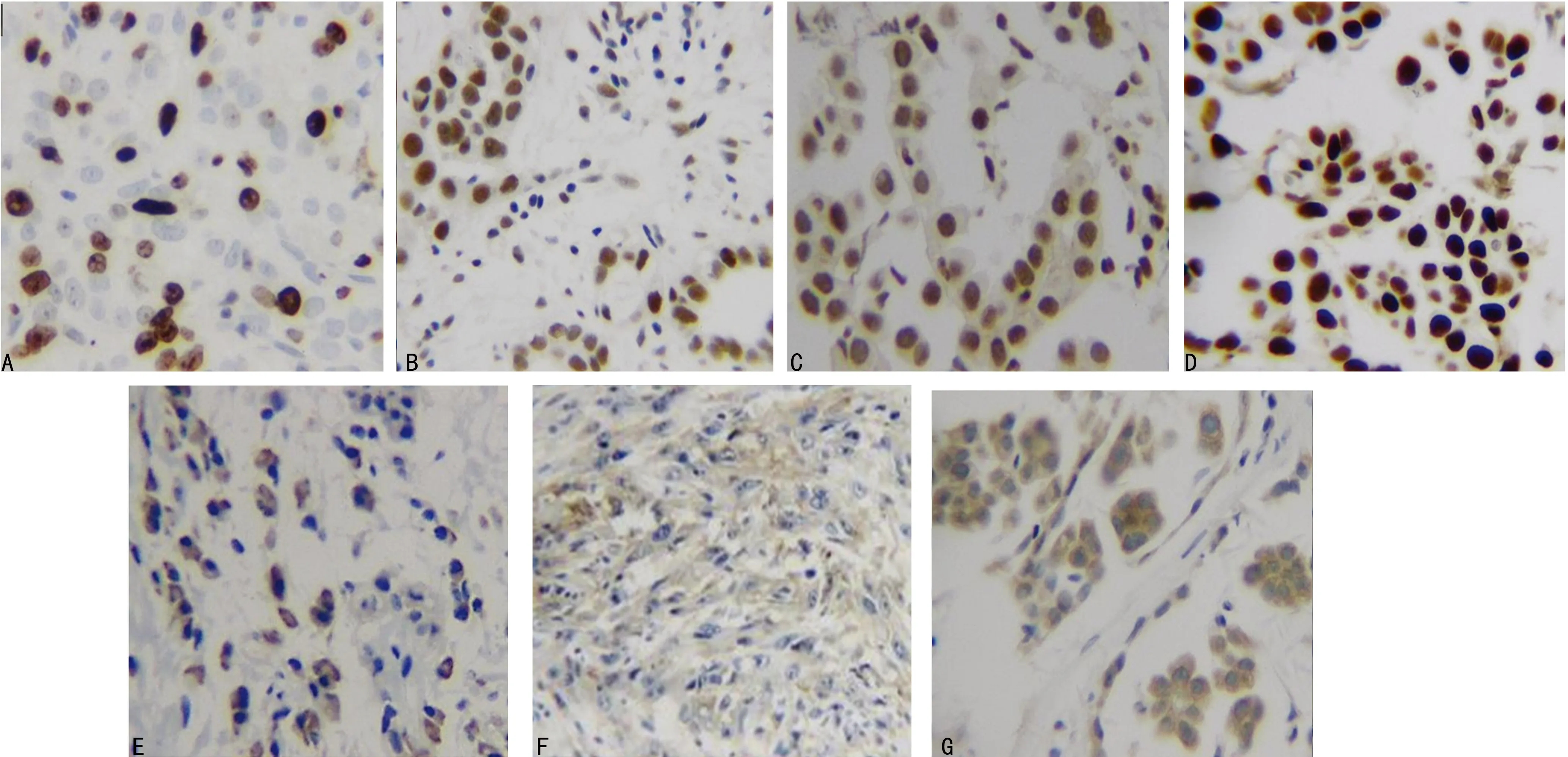
A:Ki67;B:ERCC1;C:FLI-1;D:MCM2;E:VEGFR-3;F:PD-L1;G:Villin
图1 7种标记物在MPeM的表达(SP,×400)
2.2标记物与临床病理学的关系 44例MPeM中,6项标记物(Ki67、ERCC1、FLI-1、VEGFR-3、PD-L1和Villin)与临床病理因素的关系见表1。经统计分析,各指标组间比较,差异均无统计学意义(P>0.05)。
2.3各标记物表达间的相关性 在44例MPeM中,FLI-1和ERCC1的表达呈正相关(r=0.337,P=0.025);FLI-1和PD-L1(r=-0.374,P=0.012)、ERCC1和PD-L1(r=-0.418,P=0.005)的表达均呈负相关。其余标记物相互间均无相关性。
2.4影响MPeM患者预后的单因素及多因素分析 本组44例患者随访资料完整,无失访病例。最后随访时间为2017年6月。随访期间,40例患者死于疾病复发。1年总生存率为19.9%,2年总生存率为4.4%,中位生存时间为7个月,见图2。将患者性别、年龄(60岁)、石棉、血小板、TNM分期、淋巴结转移、腹水、胸膜斑、组织学类型、化疗及7项标记物进行单因素分析,显示化疗(P=0.027)、TNM分期(P=0.006)、ERCC1(P=0.027)及Ki67标记指数大于或等于20%(P=0.030)是与预后有关的因素,而其余指标均与预后无关(P>0.05)。见图3、表2。
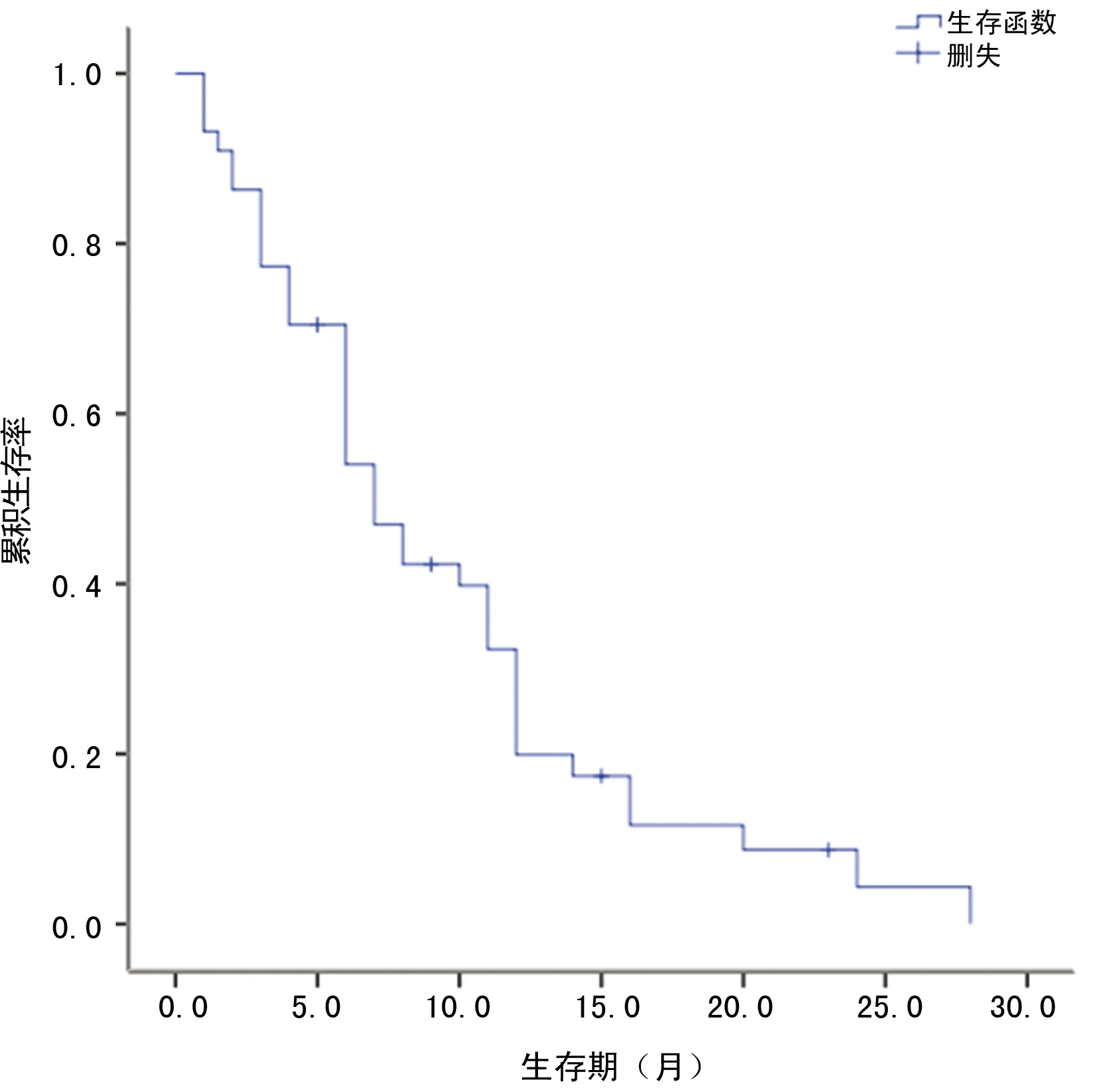
图2 44例MPeM患者的总生存曲线
2.5影响MPeM患者预后的多因素分析 将单因素分析有意义的4项指标纳入COX比例风险模型进行多因素分析,结果显示,TNM分期(P=0.031)及Ki67标记指数大于或等于20%(P=0.036)是影响MPeM预后的独立危险因素,见表3。
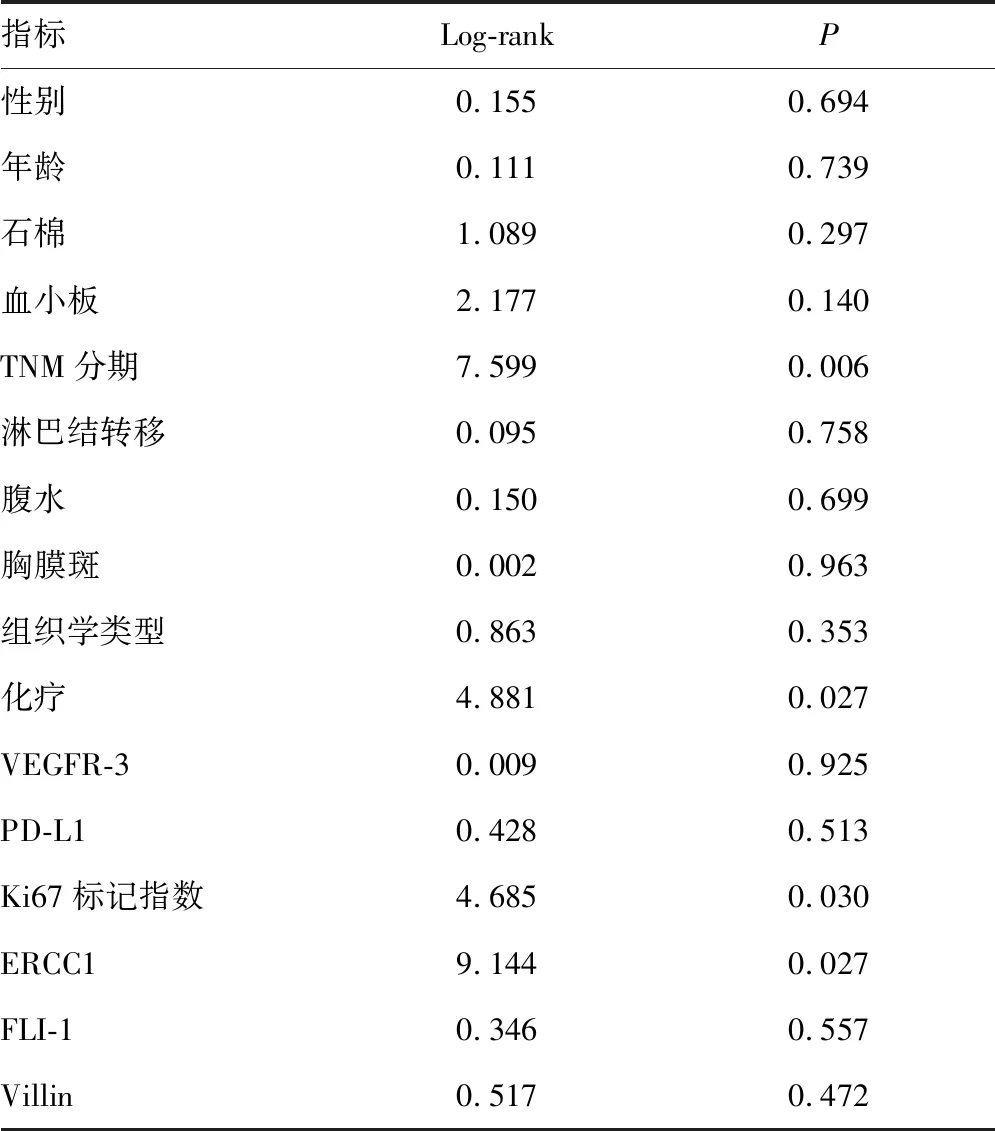
表2 MPeM预后相关因素的单因素分析

A:ERCC1与MPeM生存时间的关系;Ki67与MPeM生存时间的关系;TNM分期与MPeM生存时间的关系;化疗与MPeM生存时间的关系
图3 ERCC1、Ki67、TNM分期、化疗与MPeM生存时间的关系

表3 MPeM预后相关因素的多因素分析
3 讨 论
MPeM是一种腹膜少见疾病,临床缺乏特异性,确诊需靠腹膜活组织病理学检查,免疫组织化学染色对于诊断具有重要意义。针对其机制及预后的研究已成为目前关注的热点,不同学者对于MPeM预后的因素分析有不同结论。YAN等[4]报道,组织分型、无淋巴结转移、手术及腹腔内热灌注化疗(HIPEC)是独立的预后影响因素。DAMHUIS等[5]报道,年龄及性别是独立的预后影响因素。免疫组织化学指标对预后的影响如何,文献较少报道。因此,本研究联合临床病理学指标及Ki67、ERCC1、Fli-1等免疫组织化学指标进行预后分析,以期得出影响MPeM预后的危险因素。
肿瘤的发生、发展和转移是多步骤、多因素、多阶段和多基因改变的复杂过程,有多重因子参与其中。Ki67抗原是目前较为肯定的核增殖标志物,是检测肿瘤细胞增殖活性最可靠的指标之一,与多种肿瘤的预后有关[6-7]。Ki-67在MPeM组织中表达的报道较少,主要与MPeM相对少见有关。PILLAI等[8]研究了42例MPeM肿瘤中Ki67的表达,结果提示Ki67抗原的高表达与不良生存相关。本研究中,Ki67阳性表达率为47.7%,单因素和多因素检测Ki67标记指数大于或等于20%与预后有关,且是预后的独立危险因素。这提示肿瘤分化越差,增殖活性越强,恶性程度越高。根据肿瘤大小、淋巴结转移及远处转移所制订的TNM分期能够较好地反映肿瘤的发展程度,同时对于预后有一定参考价值[9]。本研究中,Ⅰ+Ⅱ期患者生存期明显较Ⅲ+Ⅳ期患者长,也是预后的独立危险因素,提示肿瘤分期越早,治疗越早,对于疾病转归越有利。
ERCC1不仅是核苷酸切除修复(NER)活性的标志性基因,也是细胞存活必需的DNA修复基因。在肿瘤组织中,ERCC1通过对放射线或者化疗药物的DNA损伤修复导致治疗失败。目前研究较多的是胃癌、大肠癌[10]、肺癌等。MATSUBARA等[11]认为,ERCC1是进展期胃癌预后评估的有效指标。另有研究报道,ERCC1阴性表达的患者有很好的化疗反应性,是评价患者预后的一个重要因子[12]。本研究结果显示,ERCC1的阳性表达率达70.4%,生存分析显示ERCC1与预后有关,但并不是独立危险因素,提示ERCC1表达强度越强,患者生存时间越短,与上述研究相符。FLI-1基因是人类ETS基因家族中的一员,参与DNA转录、细胞增殖和肿瘤发生。MHAWECH-FAUCEGLIA等[13]发现,尤文肉瘤/原发性神经外胚层肿瘤(EWS/PNET)、嗅神经母细胞瘤、小细胞肺癌、横纹肌肉瘤、非霍奇金淋巴瘤、良恶性血管瘤、鳞状细胞癌、腺癌组织中均可检测到不同程度的FLI-1表达。KAYGUSUZ等[14]对52例患者胃肠道间质瘤组织进行检测,却未发现FLI-1表达,提示其不参与胃肠道间质瘤的形成。本研究中,FLI-1的阳性表达率高达95.4%,提示腹膜间皮瘤与胃肠道间质瘤的发病机制存在明显差别,可以用来作为诊断腹膜间皮瘤的参考指标。
MCM2只存在于细胞周期的细胞核中,在增殖细胞中表达水平高,在静止期细胞或分化好的细胞中不表达或水平很低,提示MCM2可以作为增殖细胞的特异标志。有研究显示,在胃癌组织中MCM2的表达明显高于正常黏膜组,且MCM2的表达水平与预后呈正相关[15]。本研究结果显示,MCM2在MPeM中的表达率为100.0%,提示MCM2与腹膜间皮瘤病理类型无关,也提示检测MCM2对于诊断MPeM具有很高的参考价值。但在生存分析中,MCM2不是影响预后的因素,这可能与MPeM的发病机制有关,是否与病例数相对不足有关尚不清楚,需进一步积累资料证实。
Villin通常只表达于有刷状缘的细胞上,如胃肠道上皮细胞、胰腺和胆管上皮细胞等,因此,Villin蛋白在胃肠道癌、胰腺癌和胆管癌中有较高的表达[16]。VEGFR-3是受体型酪氨酸蛋白激酶家族成员,是第一个被鉴定的淋巴管内皮标记物,它在肿瘤组织血管和淋巴管中均有表达,血管内皮生长因子-C(VEGF-C)可以与VEGFR-3结合参与淋巴管生成的调控,促进肿瘤转移[17]。本研究中,Villin的表达率仅为15.9%,这可以作为鉴别间皮瘤和腺癌的特异抗体之一,而VEGFR-3的阳性率也仅为18.2%,这提示MPeM不是以淋巴转移为主,而是以匍匐浸润为主要转移方式。
值得注意的是,本研究中,PD-L1的阳性率仅为6.8%。PD-L1可以负性调控T淋巴细胞介导的肿瘤杀伤反应,从而使肿瘤细胞逃离免疫系统的监视,避免免疫细胞的杀伤[18]。笔者推测,腹膜间皮瘤属于惰性肿瘤,转移或浸润慢,PD-1及其配体PD-L1可能未启动肿瘤杀伤效应,本组中有1例患者口服PD-1抑制剂pembrolizumab,复查腹膜间皮瘤较前进展,提示对于腹膜间皮瘤,不适宜应用PD-1抑制剂pembrolizumab治疗,并且PD-L1也不适宜用于MPeM的检测及预后。
综上所述,在本组MPeM中,MCM2和FLI-1对于诊断MPeM具有较高的敏感性,VEGFR-3和Villin对于鉴别腺癌和MPeM具有一定价值,Ki67和TNM分期是影响预后的独立危险因素。由于本组病例数较少,需进一步增加样本量以增进准确性。
