脑梗死过程中微RNA-181d和肿瘤坏死因子α的表达及机制研究*
2019-04-25单海雷焦光美窦志杰张晓璇高燕军
单海雷,焦光美,窦志杰,马 征,张晓璇,杨 宁,高燕军
(承德医学院附属医院神经内科,河北承德 067000)
脑梗死是世界范围内人群死亡的主要原因之一,也是导致长期神经功能损伤的主要原因。多重因素导致的疾病复杂性阻碍脑梗死的诊断和治疗[1]。虽然已开展许多有关脑梗死治疗的临床试验,但目前血栓溶解仍是主要治疗方法[2]。因此,迫切需要开发新的有效的诊断和治疗方法。微RNAs(microRNAs,miRNAs)是生物体内广泛存在的含19~24个核苷酸的非编码RNA,其可与靶基因mRNA的3′非翻译区域(3′UTR)结合,阻止它们的翻译。miRNAs可调节多种细胞活动,如细胞增殖、分化、凋亡、器官发育、机体代谢和肿瘤发生。且近年来,许多研究已经注意到miRNAs在脑梗死中的作用。脑缺血后,大脑中miRNAs的表达发生改变[3]。另外,有些miRNA在人体血清或血浆中稳定存在,可以作为组织损伤和病理状态的特异标志物[4]。研究发现,miR-181家族中,miR-181a对小鼠的缺血性神经损伤具有保护作用[5],下调的miR-181b通过对热休克蛋白A5(HSPA5)和UCHL1蛋白水平的负调控,诱导神经保护对抗缺血性损伤,为缺血性脑卒中提供了一个潜在的治疗靶点[6]。缺血后miR-181c直接作用于肿瘤坏死因子-α(TNF-α),从而调节小胶质激活和小神经胶质细胞介导的神经元损伤[7]。然而,miR-181家族的第4个重要成员miR-181d在脑缺血中的作用还鲜有报道。本研究旨在通过检测脑梗死患者和大脑中动脉阻塞(MCAO)模型小鼠血清中miR-181d的表达水平及其与炎症的关系,初步揭示miR-181d在脑梗死中的作用。现报道如下。
1 材料与方法
1.1材料
1.1.1血清标本 采用回顾性研究方法,收集32例发病48 h内入住承德医学院附属医院的脑梗死患者血清(脑梗死损伤组),其中男21例,女11例,年龄34~73岁,平均(54.0±18.7)岁。另选取体检正常的健康对照人群13例收集血清(对照组),男9例,女4例,年龄38~69岁,平均(53.0±14.7)岁。所有患者采血前均未进行过扩容、扩血管及溶栓治疗,无创伤及手术史;并且除外其他癌症、感染或免疫疾病患者。两组性别、年龄及高血压、糖尿病、高血脂等并发症比较,差异均无统计学意义(P>0.05),具有可比性。本研究符合医学伦理学标准,获得患者或家属的知情同意,同时经本院伦理委员会批准。
1.1.2小鼠MCAO模型 C57BL/6雄性小鼠,体质量为20~25 g,于22~24 ℃正常昼夜交替环境饲养。称重后,按70 mL/kg腹腔注射5%水合氯醛。参照Longa线栓法建立小鼠左侧MCAO模型。36只小鼠分为假手术组(n=6)和脑梗死组(n=30)。脑梗死组于梗死后1、3、7、14、28 d取材。
1.2方法
1.2.1血样采集和血清总RNA提取 收集脑梗死患者发病48 h内的静脉血5 mL,置于含乙二胺四乙酸(EDTA)的抗凝管中,4 ℃冰箱静置30 min,3 000 r/min离心30 min,取上层血清置于无RNA酶离心管中,然后按照血清miRNA提取试剂盒说明书(北京天根生化科技有限公司)提取血清总RNA。
1.2.2细胞培养 THP-1细胞购自美国ATCC公司。人胚肾HEK-293T细胞系购自CBTCCCAS。这些细胞均用DMEM培养基[含10%胎牛血清(FBS,购自美国Invitrogen公司上海分公司)]于37 ℃、含5% CO2的细胞培养箱中培养。
1.2.3实时定量反转录PCR(qRT-PCR) 从血清中提取的总RNA用TaqMan®MicroRNA Reverse Transcription Kit(美国Applied biosystem公司)和miR-181d特异性反转录引物反转录成特异性产物。然后使用TaqMan miR-181d探针(美国Applied biosystem公司)在IQ5实时定量PCR仪(美国Bio-Rad公司)上进行qRT-PCR。整个反应体系严格按照说明书进行。
1.2.4酶联免疫吸附试验(ELISA) 使用Abcam公司试剂盒(人TNF-α ELISA试剂盒ab46087;小鼠TNF-α ELISA试剂盒ab208348)检测。使用每个样品的3个平行样进行统计分析。
1.2.5报告基因质粒构建 包含miR-181d潜在结合位点的人TNF-α 3′-UTR序列是通过PCR扩增获得,以HEK-293T细胞的DNA为模板。突变质粒采用上海碧云天生物技术有限公司的快速突变系统生成。PCR产物通过SgfI和PmeI位点连接到psiCHECK-2载体上(美国Promega公司)。插入片段的序列通过DNA测序证实。所用引物:TNF-α-3′-UTR-WT-正向:5′-GAC CGC GAT CGC CCA CTA AGA ATT CAA ACT G-3′;TNF-α-3′-UTR-WT-反向:5′-CTT AGT TTA AAC CGA TTA CAG ACA CAA CT-3′;TNF-α-3′-UTR-Mut-正向:5′-TTT ATT ATT TAT TTA TTT ACA GAA CTT ACA ATT TAT TTG-3′;TNF-α-3′-UTR-Mut-反向:5′-CAA ATA AAT TGT AAG TTC TGT AAA TAA ATA AAT AAT AAA -3′。
1.2.6荧光素酶报告基因检测实验 将含TNF-α 3′-UTR或其突变体的报告基因载体的psiChECK-2质粒和miR-181d或对照模拟物一起,使用脂质体2000试剂(美国Invitrogen公司)瞬时转染到HEK-293T细胞中。48 h后,用被动裂解缓冲液100 μL(美国Promega公司)裂解细胞,然后按照Promega双荧光素酶报告系统试剂盒说明书(美国Promega公司)检测裂解液的荧光素酶表达水平(体系:20 μL;使用贝特霍尔德FB12光度计测量)。内参为海肾荧光素酶。
1.2.7蛋白质印迹法(Western blot) 细胞吸去上层细胞培养基后用磷酸盐缓冲液(PBS)洗涤3遍,然后加入RIPA裂解液,98 ℃变性10 min;用制备好的10%丙烯酰胺(SDS)胶板电泳(90 V电压);用硝酸纤维素膜转膜过夜(100 V,4 ℃);脱脂牛奶常温封闭2 h;用含2%牛奶的PBS配置一抗过夜孵育;1‰ TBST洗膜3遍,每遍10 min,用含2%牛奶的PBS配置二抗,和膜室温孵育2 h;再用1‰ TBST清洗膜3遍,每遍15 min。加入辣根过氧化物酶底物,反应2 min,用上海勤翔ChemiScope 6000化学发光系统曝光。

A:血清miR-181d表达水平比较;B:血清TNF-α表达水平比较;C:miR-181d和TNFα表达水平的相关性分析
图1 脑梗死组与对照组血清miR-181d和TNF-α的表达及相关性分析

A:血清miR-181d表达水平比较;B:血清TNF-α表达水平比较;C:小鼠MCAO模型血清miR-181d和TNF-α表达水平的相关性分析;*:P<0.01,与假手术组比较
图2 小鼠MCAO模型血清miR-181d和TNF-α的表达和相关性分析
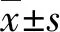
2 结 果
2.1miR-181d、TNF-α在脑梗死损伤组与对照组血清的表达变化及相关性 脑梗死损伤组患者血清miR-181d表达水平低于对照组(P=0.015 7),见图1A。与对照组比较,脑梗死损伤组患者血清TNF-α表达水平升高(P=0.038 8),见图1B。进一步对所有血清标本miR-181d和TNF-α表达水平进行相关性分析,结果表明TNF-α和miR-181d的表达水平呈负相关(r=-0.703 8,P=0.000 4),见图1C。
2.2miR-181d和TNF-α在MCAO模型小鼠血清中的表达变化及相关性 利用qRT-PCR和ELSIA检测假手术组和不同时段脑梗死组小鼠血清miR-181d和TNF-α的表达水平。结果表明,脑梗死组小鼠血清miR-181d表达水平低于假手术组,并且miR-181d表达水平随着脑梗死发生时间的不断增加而降低,见图2A。与之相反,TNF-α在脑梗死组小鼠血清中的表达水平高于假手术组,并且随着脑梗死发生时间的不断增加而升高,见图2B。在小鼠MCAO模型血清中,miR-181d和TNF-α的表达水平呈负相关(r=0.965 3,P=0.001 8),见图2C。

A:人类TNF-α 3′-UTR的miR-181d结合位点模式图,突变序列显示在下方; B:报告基因实验检测miR-181d与TNF-α 3′-UTR的结合;C:100 nmol/L miR -181d的类似物转染到野生型的THP-1细胞中,qRT-PCR检测miR-181d的表达;D:miR -181d的类似物转染到野生型的THP-1细胞中,Western blot检测TNF-α的表达;*:P<0.01,与Ctrl mimics比较
图3 miR-181d通过结合到3′-UTR抑制TNF-α表达
2.3miR-181d对TNF-α的抑制作用 通过在线分析软件Targetscan(http://www.targetscan.org/vert_71/)搜索发现miR-181d潜在与TNF-α的3′UTR的500~507 bp位置发生结合,且进化上高度保守(图3A)。接下来构建了野生型和突变型的TNF-α 3′UTR片段(针对miR-181d潜在结合位点),并将它们连接到报告基因质粒psiCHECK2上。然后同时转染miR-181d 模拟物或对照模拟物及含TNF-α 3′UTR的报告基因质粒于HEK-293T细胞中。检测结果表明,miR-181d模拟物可以显著抑制含野生型TNF-α 3′UTR的报告基因的活性,表明miR-181d可以与TNF-α 3′UTR结合。但是当miR-181d的潜在结合位点发生突变后,抑制作用减弱,说明这个结合位点对miR-181d来说,是十分重要的(图3B)。进一步在THP-1细胞中过表达miR-181d(图3C),发现TNF-α的蛋白水平降低(图3D)。
3 讨 论
miRNA在脑发育和功能上起着十分关键的作用,血液循环中的大部分miRNA并不是从破碎的组织细胞被动漏出,而是从受损组织细胞主动分泌进入血液循环,并进入靶细胞发挥作用。本研究中结果显示,脑梗死患者血清miR-181d的表达水平明显低于健康对照人群。此外,本研究成功建立了小鼠MCAO模型,在MCAO模型小鼠中血清miR-181d水平明显低于假手术组,并且随着病程的延长持续降低。总的来说,这些发现证实血清miR-181d的下调可以作为脑梗死的一个生物标志物。本研究的不足之处在于没有确定血清miR-181d下调的原因。另一方面,由于本研究所使用的临床病例数较少,其结论的推广确立有待扩大样本的前瞻性临床研究证实。
研究表明炎症是脑梗死的关键因素[8],白细胞介素(IL)-1、IL-2、TNF-α、IL-6、IL-10、IL-12、转化生长因子β1(TGF-β1)等炎性因子均参与了脑梗死的发生、发展[9-12];脑梗死患者血清TNF-α、IL-2、TGF-β1等水平明显升高,TNF-α、IL-2、TGF-β1可促进脑组织的炎性反应及血管斑块的形成,上述炎性因子的表达水平与病情严重程度及梗死面积相关。本研究在脑梗死患者血清标本中同样检测到TNF-α表达水平升高。此外,在小鼠MCAO模型中血清TNF-α水平亦表现为上调。相关性分析显示,在临床样本和小鼠模型中,miR-181d和TNF-α的表达均呈明显负相关。说明miR-181d和TNF-α之间存在着潜在的调控关系。关于这一点,在其他的研究和体系中也得到证实。在星形胶质细胞中,HUTCHISON等[13]研究发现敲除miR-181可以增强高迁移率组蛋白B1(HMGB1)的产生并促使脂多糖(LPS)诱导产生多种炎性因子,同时过表达miR-181会导致炎症抑制因子IL-10的表达升高。DAN等[14]研究发现在脓毒症多导致的免疫麻痹过程中,乌本苷可以通过诱导miR-181的转录,导致TNF-α mRNA水平的降解和蛋白水平的下调。然而,也有文献报道,miR-181和TNF-α在功能上也有可能存在正向的协同作用。GHORBANI等[15]发现在小鼠成纤维细胞中,过表达miR-181可以增强TNF-α所诱导的线粒体膜电位的降低和随后发生的细胞凋亡。本研究同时利用双荧光酶报告基因和Western blot实验证明miR-181d可以通过与TNF-α mRNA的3′-UTR 区域相结合来抑制TNF-α的表达。说明炎性细胞是血清中miR-181d作用的靶细胞之一。在正常的生理过程中,miR-181d的表达抑制炎性反应的发生。而在脑缺血疾病发生时,miR-181d的表达出现下调,血清中miR-181d的表达也随之降低,后者的表达下降会导致炎性细胞中TNF-α表达的升高。也就是说,miR-181d的表达变化不仅可以作为临床脑缺血性疾病的诊断和预后指标。同时过表达miR-181d不失为治疗和改善脑梗死的一种潜在选择。在后续的研究中,需要利用细胞和动物实验进一步明确miR-181d在脑梗死过程中所发挥的功能。另一方面,miR-181d作为miRNA,可以参与调控多种信号通路的转导,这方面有待进一步的研究。
miR-181家族共有miR-181a、miR-181b、miR-181c和miR-181d四个miRNA。它们分别由不同染色体区域转录而成,且序列上高度相似。有关4种亚型在脑缺血性疾病研究中的深入程度有所不同,以miR-181a的研究最多。如小鼠脑卒中后,miR-181a抑制剂的治疗可以改善小鼠的行为学指标[5]。而OUYANG等[16]却发现miR-181a可以通过靶向GRP78使脑缺血病情恶化。此外,MA等[17]研究表明在临床脑卒中患者中miR-181c的表达升高,同时miR-181c可以促进神经瘤母细胞Neuro-2a的凋亡。在小鼠MCAO模型中,miR-181类似物的处理可以降低小神经胶质瘤细胞的激活并促进凋亡细胞的表达[7]。本研究检测到脑梗死患者和小鼠大脑中动脉阻塞(MCAO)模型血清miR-181d表达下调,血清TNF-α表达升高,并进一步在人胚肾细胞(HEK-293T)细胞和THP-1细胞中证明miR-181d可以抑制TNF-α的表达。结合前述报道,系统地阐明了miR-181家族各成员在脑缺血性疾病中的表达谱及其功能的差异。
